Магний, пиридоксин и тромбообразование: молекулярные роли при беременности
- Аннотация
- Статья
- Ссылки



Нормальные уровни магния в тканях тела – фундаментальный параметр, непосредственно влияющий на здоровье женщины. Однако современное питание характеризуется сильными деформациями минерального состава рациона: избыточным потреблением поваренной соли (хлорида натрия) и дефицитом поступления солей калия, кальция и магния. Как следствие, недостаток магния встречается достаточно часто в популяционных группах. Так, 16-42% населения в таких странах, как США, потребляют менее 2/3 рекомендованного количества магния (1). Популяционное исследование около 16000 немцев указало на субоптимальный уровень потребления магния у 33,7% населения, причем 14,8% данной выборки имели яркую клиническую картину магниевого дефицита и нуждались в магнезиальной терапии (2). Поэтому с 1995 года Всемирная организация здравоохранения классифицировала патологическое состояние «недостаточность магния» как заболевание, имеющее свой код (код Е61.3 по МКБ-10).
Одним из негативных последствий гипомагнезиемии, приводящим к осложнениям беременности (невынашивание, гестоз и др.), является повышенная склонность крови к тромбообразованию (3, 4). И наоборот – препараты магния могут задерживать образование тромбов (5-7), улучшая макроциркуляцию и микроциркуляцию, в т.ч. в сосудах плаценты. Положительные влияния магния на гомеостаз подтверждаются исследованиями на экспериментальных животных: в/в сульфат магния значительно сокращал смертность от тромбоэмболизма у мышей (8, 9). Исследования также показали, что торможение тромбообразования зависимо от дозы магния; ингибирующий эффект на агрегацию тромбоцитов оказывают препараты магния в клинически эффективных концентрациях (5). Предметом настоящей статьи является систематический анализ физиологических и молекулярных механизмов воздействия магния на процессы тромбообразования.
Влияние уровней магния и приема магниевых препаратов на процессы тромбообразования имеет общетерапевтическое значение в кардиологии, неврологии, эндокринологии и др. Традиционно в акушерско-гинекологической практике магниевые препараты используются для снижения повышенного тонуса матки и профилактики преждевременных родов. В данном случае магний понижает тонус мышечной ткани за счет антагонизма с кальцием, обеспечивающим сокращение мышц. Фундаментальные исследования последних 10-20 лет показали и раскрыли многогранность воздействия магния на физиологию. В нашей предыдущей работе (10) мы представили анализ молекулярных функций практически всех известных магний-зависимых плацентарных белков. Сформулированная молекулярная картина влияния магния на функционирование плаценты указала на непреходящую роль адекватной магниевой поддержки физиологического течения беременности.
Невынашивание – основное осложнение, отягощающее течение и прогноз беременности. У многих пациенток в основе невынашивания лежат тромбоэмболии в сосудах плаценты. Сама по себе беременность является гиперкоагуляционным состоянием (11-18). Нарушения баланса свертывания крови не только является одной из ведущих причин невынашивания, преждевременных родов, но и замедления/остановки роста плода, гестоза и др. (11, 12). Невынашивание (англ. «recurrent pregnancy loss») встречается от 1% до 10% беременных и в 50-60% случаев наследственно обусловлено (13-15).
Слаженное функционирование различных физиологических механизмов (каскада свертывания крови, адгезии тромбоцитов, вазодилатации/вазоконстрикции, ангиогенеза сосудов плаценты и др.) профилактирует тромбоэмболии и поддерживает нормальное течение беременности. Активно обсуждаются перспективы магниевых препаратов в акушерстве, гинекологии и перинатальной медицине как антагониста кальция в процессах тромбообразования. Углубленное понимание механизмов воздействия магния на тромбофилию при беременности может в значительной степени помочь более осмысленному ведению пациенток. В настоящей статье после детального анализа этих молекулярных механизмов мы кратко рассматриваем данные доказательной медицины по использованию магния для профилактики тромбозов.
Механизмы влияния магния на процесс тромбообразования
Основной процесс в тромбообразовании – гемостаз, сложный физиологический процесс, посредством которого происходит переход крови из текучего состояния в нетекучее и обратно. Гемостаз может быть подразделен на четыре основных этапа:
- локальная вазоконстрикция для ограничения кровяного потока в месте повреждения;
- активация тромбоцитов и образование первоначального тромба на месте повреждения;
- перекрестное сшивание первоначального тромба посредством фибриновых нитей (коагуляция);
- частичное, а затем полное растворение фибринового сгустка для восстановления нормального потока крови (фибринолиз).
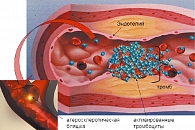
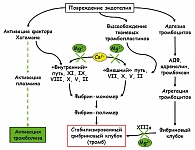
Хотя коагуляция является основным процессом гемостаза, состояние системы коагуляции далеко не единственный фактор, влияющий на формирование тромба. Например, присутствие атеросклеротических бляшек и микроэмболов сужает просвет артерий и артериол и создает возможность для их обструкции (рисунок 1). Противовоспалительные процессы, связанные с атеросклерозом, могут сами по себе инициировать агрегацию тромбоцитов с образованием первоначального тромба.
В целом, механизм тромбообразования может быть описан тремя общеизвестными фундаментальными физиологическими механизмами (т.н. триадой Вирхова (26)). Триада Р. Вирхова (1856) отражает три специфических механизма, которые могут приводить к возникновению тромба:
- изменения в токе крови (вазоконстрикция);
- изменения в свертываемости крови (коагуляция, фибринолиз);
- изменения в стенках сосудов (атеросклероз, воспаление, нарушение структуры соединительной ткани).
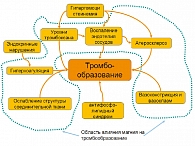
Во время беременности слаженная работа системы гемостаза – залог рождения здорового ребенка. Вышеупомянутые патофизиологические процессы, в той или иной мере способствующие тромбообразованию у беременных, суммированы на рисунке 2. Эти процессы взаимосвязаны. Что более важно, практически все эти процессы (за исключением анти-фосфолипидного синдрома, гипергомоцистеинемии и эндокринных нарушений) зависят от уровней магния в крови. Гипергомоцистеинемия в значительной степени зависит от витаминов группы В: фолиевой кислоты (В9), цианокобаламина (В12) и пиридоксина (витамин В6).
В Российском сателлитном центре института микроэлементов ЮНЕСКО при участии О.А. Громовой, Н.К. Тетруашвили, И.Ю. Торшиной, И.С. Юргель, О.А. Лимановой был проведен анализ возможных механизмов влияния уровней магния на каждый из процессов, стимулирующих тромбообразование:
- синтез тромбоксана;
- коагуляцию;
- воспаление эндотелия сосудов;
- атеросклероз;
- дисплазию соединительной ткани;
- вазоконстрикцию (рисунок 2).
Затем нами были рассмотрены молекулярные эффекты пиридоксина. Мы приводим данные доказательной медицины по антитромботическому действию магния.
Магний и синтез тромбоксана, дезагрегация
Дезагреганты (дипиридамол, ацетилсалициловая кислота и т.д.) – одно из типичных назначений при беременности, особенно на последнем триместре. Фундаментальные исследования, проводимые более 30 лет, многократно подтверждают, что магний является дезагрегантом (16). Магний ингибирует воздействие многих активаторов агрегации тромбоцитов, и прежде всего тромбоксана А2 (17). Кроме того, магний (сернокислая магнезия, 3 ммоль/л) способствует значительному снижению уровней тромбоксана А2 (5, 18) и соответственно уменьшению поверхности тромба (19). При дефиците магния в крови уровни тромбоксана А2 в плазме крови и в моче повышаются (20). Магний уменьшает активность тромбоцитов и увеличивает среднее время кровотечения, при этом скорость фибринолиза остается неизменной (21).
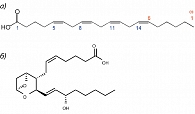
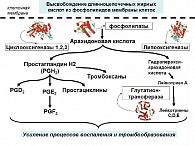
Тромбоксан А2 является одним из простаноидов, которые образуются в каскаде биотрансформаций арахидоновой кислоты. Арахидоновая кислота (АРК) – разновидность омега-6 ПНЖК (полиненасыщенных жирных кислот), присутствующая в значительном количестве в фосфолипидах, составляющих клеточные мембраны. АРК – незаменимая жирная кислота, метаболиты которой выполняют важные регуляторные функции, такие как поддержание тонуса мускулатуры, сохранение целостности сосудов и остановка кровотечения при небольших травмах. Поэтому среди метаболитов АРК преобладают вещества, обладающие вазоконстрикторными и провоспалительными свойствами (простагландины F, лейкотриены 4 ряда), и также индукторы коагуляции (тромбоксаны).
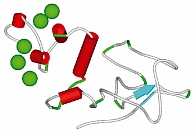
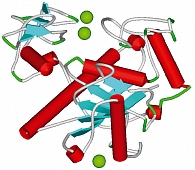
На первом этапе АРК синтезируется из фосфолипидов посредством фосфолипаз, катализирующих гидролиз фосфолипидов до жирных кислот. Затем арахидоновая кислота преобразуется в простаноиды (простагландины, простациклины, тромбоксаны) через циклооксигеназы. Пространственные структуры ферментов этих классов представлены на рисунках 5, 6.
Хотя сам факт влияния магния на уровни тромбоксана был доказан десятками независимых исследований, точного молекулярного механизма воздействия не было предложено. Рассмотрение ферментов каскада арахидоновой кислоты позволяет высказать несколько предположений. Каждый из этих ферментов содержит тот или иной ион металла (фосфолипаза – кальций, циклооксигеназа и липоксигеназа – железо). Ионы магния могут ингибировать весь каскад АРК путем вытеснения кальция или железа. Синтез тромбоксанов значительно замедлится при ингибировании магнием фосфолипазы, содержащей два иона кальция в активном центре. Принимая во внимание кальциево-магниевый антагонизм, достаточная дотация магния приведет к замещению кальция в активном центре и падению активности фосфолипаз.
Данная гипотеза построена в соответствии с имеющимися данными о молекулярных эффектах магния на уровни тромбоксанов. Повреждения мембран и в самом деле усиливаются при низких уровнях магния (< 0,25 mM) (3). Низкие уровни магния соответствуют увеличению высвобождения АРК из мембран (т.е. увеличению активности фосфолипаз), что и приводит к увеличению уровней тромбоксана и простациклина (22). Дефицит магния стимулирует биосинтез не только тромбоксана А2, но и других простаноидов – тромбоксана В2, простагландинов Е2, F1 и простациклина (4, 23). Был отмечен синергидный эффект магния и аспирина (24), что косвенно указывает на снижение именно фосфолипазной активности.
Магний также может влиять на активность ферментов через регуляцию гомеостаза кальция путем ингибирования гидролиза фосфоинозитидов. При этом увеличивается внутриклеточная концентрация аденозинмонофосфата (АМФ), регулирующего гомеостаз кальция (5). Следовательно, снижение уровней кальция будет приводить к снижению активности фосфолипаз.
Магний и коагуляция
Так как беременность является гиперкоагуляционным состоянием, антикоагулянты используются в акушерско-гинекологической практике наряду с дезагрегантами. Влияние магния на снижение уровней тромбоксана и, как следствие, на уменьшение агрегации тромбоцитов сопровождается отчетливым антикоагуляционным эффектом. На модели магниевого дефицита у свиней наблюдается увеличение уровня тромбоксана, параллельное снижению уровня магния и увеличению на 57% активности прокоагулянтного белка С (PROC). В то же время уровни антикоагулянтных белков антитромбина III и белка S (PROS) снижаются на 15-20% (25).
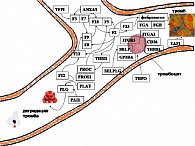
Общие молекулярные механизмы коагуляции крови хорошо изучены. Они включают собственно каскад коагуляции (активация которого приводит к образованию фибриновых волокон и сеток, стабилизирующих структуру тромба) и фибринолитический каскад (осуществляющий деградацию тромба посредством гидролиза фибриновой сетки). Процессы коагуляции и фибринолиза занимают центральное место в гемостазе, т.к. именно они приводят к образованию устойчивых тромбов, которые при соответствующих условиях и являются непосредственными причинами невынашивания беременности. Схема каскада свертывания крови представлена на рисунке 6 и в таблице 1. Основные молекулярные гены, вовлеченные в каскад коагуляции, приведены на рисунке 7.
Считается, что процесс коагуляции подразделяется на два основных пути: «внешний» механизм инициации коагуляции и «внутренний» механизм инициации коагуляции. «Внешняя» инициация коагуляции происходит при значительном повреждении (разрыве) сосуда, которое ведет к проникновению тканевого фактора свертывания (ген F3) в кровяное русло. Вслед за этим образуется комплекс F3-F7 в комплекс, активирующий факторы F9 и F10. В свою очередь F10a и кофактор F5a образуют протромбиназный комплекс, который затем активирует тромбин – центральный компонент молекулярного каскада коагуляции крови. В результате активированный тромбин катализирует преобразование фибринoгена (гены FGB, FGA) в фибрин. Разложение фибринового сгустка – функция фермента под названием плазмин. Плазмин образуется из плазминoгена тканевым активатором плазминогена и урокиназой. Действие тканевого активатора плазминогена может быть приостановлено специфическим белком-ингибитором (ген PAI1).
«Внутренний» механизм коагуляции срабатывает при отсутствии значительного повреждения ткани и представляет собой реакцию на присутствие любой чужеродной поверхности в кровяном русле или стенке сосуда (например, при контакте с коллагеновыми волокнами соединительной ткани сосудов при микроповреждениях эндотелия). Этот механизм коагуляции включает преобразование прекалликреина в калликреин и активизацию фактора свертывания F12 (т.н. «фактор Хагемана»). F12 активирует фактор F11, который, в свою очередь, активирует F9, F8 и F10. Хотя иногда говорится, что внутренний механизм коагуляции имеет «незначительную роль» в гемостазе, абнормальные состояния стенок сосудов (возникающие, например, вследствие атеросклероза или воспаления) могут приводить к активизации свертывания через внутренний механизм и увеличивать вероятность тромботических инцидентов (26).
Недавние исследования показывают, что понятия «внутреннего» и «внешнего» механизмов инициации не более чем просто удобные категории и не отражают реальной сложности физиологии коагуляции. Например, белок-белковый комплекс F3-F7a не только активизирует F10, но также фактор F9 «внутреннего» механизма коагуляции (27). Серьезные кровотечения, связанные с дефицитом F8 и F9, также позволяют предположить, что только «внешний» механизм не является достаточным для поддержания нормального гемостаза (28, 29).
Наиболее вероятным механизмом воздействия магния непосредственно на коагуляцию является замещение кальция в структурах прокоагуляционных белков. Антагонизм между кальцием и магнием хорошо известен. Не менее хорошо известно, что многие прокоагулянтные белки (протромбин F2, факторы свертывания крови F13, F10, F11, F7, F8, F9, белок PROC) являются кальций-зависимыми белками с достаточно похожими пространственными структурами. Ионы кальция связываются N-концевыми Gla-доменами этих белков и необходимы для поддержания процессов коагуляции. Активность этих белков может падать вследствие генетических дефектов, при дефиците кальция или избытке магния. Соответственно, замещение кальция на магний приводит к уменьшению прокоагулянтной активности этих белков и, следовательно, к уменьшению склонности к тромбообразованию. Краткая информация об этих белках приведена в таблице 2.
Gla-домен (Гла-домен) – эссенциальный фрагмент пространственной структуры коагуляционных факторов F2, F7, F9, F10, PROC и др. Этот фрагмент характеризуется очень близкой пространственной структурой во всех белках (рисунок 5). Гла-домены прокоагулянтных белков связывают гиалоуронан внеклеточной матрицы (матрикса) и необходимы для надежной фиксации тромба снаружи от поврежденной части сосуда. Остатки глутамовой кислоты в синтезированой белковой цепи Гла-доменов конвертируются при посредстве витамина К в гамма-карбоксиглутаматы (Гла), которые, собственно, и связывают ионы кальция (30).
Связывание кальция необходимо для поддержания конформации (пространственной структуры домена), необходимой для взаимодействия с гиалоуронаном. Гла-домены также содержат гиброфобные участки, взаимодействующие с клеточной мембраной (31, 32).
Помимо связывания с Гла-доменами, магний может влиять на коагуляцию через протеолиз фактора фон Виллебранда (ФФВ) и активность эктонуклеозиддифосфогидролазы. Известно, что сульфат магния уменьшает агрегацию тромбоцитов через ускорение протеолиза и секреции фактора фон Виллебранда (33).
Протеолиз осуществляется посредством ADAMTS-13 протеиназы, известной также как «ФФВ-протеиназа» (рисунок 9). Увеличение активности ADAMTS-13 предрасполагает к гипокоагуляции вследствие более активной переработки ФФВ (34, 35).
Эктонуклеозид трифосфатдифосфогидролаза (ген ENTPD1) гидролизует АТФ и другие нуклеотиды. Этот фермент требует магний в качестве кофактора и экспрессируется в основном на активированных лимфоцитах и эндотелиальных клетках. В нервной системе активность этого фермента важна для регуляции нейротрансмиссии (36).
В сердечно-сосудистой системе активность ENTPD1 соответствует пониженной агрегации тромбоцитов (37).
Схемы терапии беременных обязательно должны включать разрешенные в применении у беременных препараты, содержащие органические соли магния (цитрат магния, лактат магния – например, препарат Магне В6), особенно если лечение Курантилом (дипиридамол) и Фраксипарином (гепарин) зашло в тупик.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.