Подходы к профилактике и лечению диабетической невропатии
- Аннотация
- Статья
- Ссылки


Изучение патогенеза сахарного диабета на протяжении последних десятилетий существенно расширило понимание сущности болезни. Так, наряду с классическим триумвиратом (неадекватная секреция инсулина (дисфункция бета-клеток), редукция усвоения глюкозы мышцами (инсулинорезистентность) и повышение продукции глюкозы печенью), исследователи все больше внимания уделяют дополнительным звеньям патогенеза, в частности нарушению расщепления жиров жировой тканью, секреции глюкагона, резорбции глюкозы почками, а также нарушениям со стороны нервной системы. Общеизвестно, что нервная и эндокринная системы в организме человека тесно взаимосвязаны. Неудивительно, что нервная система вовлекается в патологический процесс при большинстве эндокринных заболеваний. При сахарном диабете наиболее уязвимой для поражения является периферическая нервная система. Головной мозг чаще страдает опосредованно через усугубление сосудистой недостаточности в результате ассоциированных с сахарным диабетом дисметаболических нарушений.
Поражение периферической нервной системы у больных сахарным диабетом встречается в 20–40% случаев. Постановка диагноза диабетической полиневропатии не представляет каких-либо затруднений в фазу манифестации клинических симптомов. Однако диагноз может быть поставлен на основании параклинических проявлений еще на доклиническом этапе. Именно ранняя доклиническая диагностика способствует успешному лечению. Традиционный неврологический осмотр выявляет бессимптомную невропатию у 30% пациентов. Углубленный осмотр, включающий количественное сенсорное тестирование и электрофизиологическое исследование скорости проведения по нервам, позволяет выявить невропатию у 30–40% больных, у которых отсутствуют какие-либо отклонения в неврологическом статусе при традиционном осмотре. К сожалению, в клинической практике больным диабетом редко проводится электрофизиологическое тестирование. Тем не менее каждый клиницист должен стремиться, по крайней мере, мониторировать неврологический статус больного сахарным диабетом.
Классификация диабетических невропатий
Диабетические невропатии (ДН) различаются по клинической картине и патогенезу. Классификация ДН базируется на распространенности невропатических симптомов (диффузные и фокальные формы невропатий), типе ведущих клинических симптомов (сенсомоторные или вегетативные невропатии) и ведущем патогенетическом факторе (метаболические или васкулярные невропатии). Возможны смешанные формы ДН (табл. 1).
Диффузные невропатии
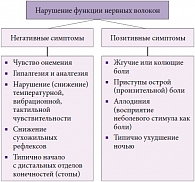
Диффузные симметричные диабетические полиневропатии включают хроническую сенсорную и сенсомоторную невропатию, инсулининдуцированную невропатию, транзиторную гипергликемическую невропатию, острую болевую невропатию, хроническую воспалительную демиелинизирующую невропатию и автономную невропатию [3]. При диффузных формах диабетической невропатии поражаются сенсорные, моторные и вегетативные (автономные) волокна. Периферический нерв формируется из тысячи отдельных нервных волокон, каждое из которых содержит отросток нервной клетки – аксон – и окружающую его миелиновую оболочку (миелиновый футляр). Сахарный диабет может стать причиной повреждения как аксона, так и миелина. Нарушение функции нервных волокон приводит к развитию дефицитарных симптомов (негативные симптомы) и симптомов раздражения (позитивные симптомы) (рис.) [2].
Хроническая дистальная симметричная сенсомоторная невропатия – наиболее частый вариант поражения периферической нервной системы при сахарном диабете. Эта форма характеризуется медленным (хроническим) течением. Первые симптомы (онемение и парестезии) появляются в нижних конечностях обычно спустя несколько лет от начала основного заболевания. Как правило, сенсорные симптомы локализуются симметрично, но у некоторых больных дебютируют унилатерально. Больные жалуются на болевые дизестезии (покалывание, пощипывание, «ползание мурашек», жгучие и/или режущие, стреляющие боли). Сверлящие, жгучие боли часто персистируют, серьезно нарушая сон. Из-за аллодинии (восприятие нормального афферентного стимула как болевого) обычное прикосновение одеяла к стопам для больного становится мучительным.
Моторные симптомы появляются позже и остаются умеренно выраженными (мягкий парез) даже на отдаленных стадиях болезни. Первым симптомом пареза часто становится слабость в мышцах-разгибателях стопы или большого пальца, что клинически проявляется спотыканием на ровном месте. Безусловно, большинство пациентов с типичной дистальной симметричной невропатией наблюдаются у специалистов-эндокринологов. Расширенное неврологическое обследование необходимо при подозрении на конкурирующую с диабетом причину невропатии. Следующие клинические характеристики могут свидетельствовать о наличии дополнительного повреждающего фактора:
- тяжесть сахарного диабета не соответствует тяжести невропатии;
- парезы или боль возникают на ранней стадии на фоне относительно сохранной чувствительности;
- асимметричное распределение симптомов невропатии;
- симптомы более выражены на верхних конечностях, чем на нижних конечностях;
- имеются маркеры семейной невропатии (например, семейный анамнез, полая стопа).
Приблизительно у половины пациентов с ДН имеется как минимум одна потенциальная дополнительная причина повреждения нервного волокна. Чаще всего это алкогольный абузус, гипертриглицеридемия, дефицит витамина B12. Диагностика сопутствующих повреждающих факторов, безусловно, играет решающую роль для проведения успешной терапии. Возникновение инсулининдуцированной невропатии (инсулиновый неврит) совпадает по времени с началом терапии инсулином или таблетированными сахароснижающими препаратами. Полагают, что поражение нервов связано с уменьшением уровня энергетического субстрата в результате резкого снижения содержания глюкозы. Резкие колебания уровня глюкозы в крови могут спровоцировать снижение кровотока по сосудам нервов и ишемию нервных волокон. Полное восстановление после стабилизации уровня сахара в крови происходит в течение 6–24 месяцев, что связывают с завершением регенерации аксонов.
Транзиторная гипергликемическая полиневропатия возникает у лиц с недавно диагностированным или плохо контролируемым диабетом. Клинически характеризуется распространенными парестезиями, захватывающими конечности и туловище, которые мгновенно исчезают после достижения контроля гипергликемии. Быстрота регресса проявлений полиневропатии свидетельствует о том, что она связана с функциональными и метаболическими, а не со структурными изменениями в периферических нервных волокнах. Не ясно, является ли транзиторная полиневропатия предвестником более стойкого поражения периферической нервной системы. Острая болевая невропатия характеризуется неожиданно возникающими тяжелыми жгучими болями в стопах, которые могут сочетаться с «глубинной» болью в проксимальной мускулатуре, с «пронзающей» болью, иррадиирующей от стопы в ногу, и интенсивной аллодинией в конечностях и туловище.
Некоторые исследователи считают неслучайной ассоциацию между хронической воспалительной демиелинизирующей невропатией и сахарным диабетом. Типичная клиническая картина включает симметричную слабость с демиелинизацией и блоками проведения импульса на электромиографии. Для хронической воспалительной демиелинизирующей невропатии характерно более быстрое прогрессирование слабости, чем при типичной хронической сенсомоторной диабетической невропатии.
Вегетативные нарушения у пациентов, страдающих диабетом, обычно ассоциированы с другим неврологическим дефицитом, но могут возникать изолированно от других симптомов. Наиболее потенциально опасным осложнением диабета считается автономная диабетическая невропатия. К сожалению, вегетативная недостаточность часто остается нераспознанной. В зависимости от ведущего синдрома выделяют кардиальную, урогенитальную, желудочно-кишечную (диабетический гастропарез) и трофическую формы. Наиболее частым симптомом является сфинктерная дисфункция, проявляющаяся сфинктерной недостаточностью или атонией мочевого пузыря, атаками диареи, особенно в ночное время, и импотенцией. Другие симптомы периферической вегетативной недостаточности включают тахикардию, ортостатическую гипотензию, отеки стоп и суставов, сухость кожных покровов.
Доминирование этих симптомов характерно для наиболее опасной кардиальной формы автономной невропатии. В результате нарушения симпатического и парасимпатического контроля над работой сердца пациенты с автономной невропатией имеют фиксированный пульс; характерна тахикардия покоя. Более серьезным симптомом является нарушение поддержания артериального давления во время стояния, в результате чего возникает ортостатическая гипотензия и тахикардия во время стояния. Клиницисты часто оставляют без внимания ортостатические изменения артериального давления у пациента. Именно с ортостатической гипотензией связана жалоба на головокружение у этой категории больных. Основными осложнениями кардиальной формы невропатии являются «денервированное сердце», безболевой или малосимптомный инфаркт миокарда, аритмии, ведущие к «синдрому внезапной смерти». От 25 до 50% пациентов умирают через 5–10 лет после диагностики кардиальной вегетативной невропатии.
Фокальные и мультифокальные невропатии
В отличие от диффузных форм невропатии, фокальные формы развиваются остро или подостро, и основным повреждающим механизмом при этих формах является ишемия. Среди краниальных нервов наиболее часто поражаются третий и шестой (глазодвигательный и отводящий) нервы, а среди соматических – срединный, локтевой и малоберцовый нервы. Мононевропатии возникают вследствие фокальной ишемии, компрессии или травматизации (туннельные невропатии).
Проксимальная асимметричная диабетическая невропатия встречается значительно реже, чем дистальные формы. Исторически эта форма описывалась под разными названиями: диабетическая амиотрофия, диабетическая полирадикулопатия, диабетическая люмбосакральная плексопатия, синдром Брунса – Гарланда. В силу своей низкой распространенности (данная форма возникает приблизительно у 1% пациентов, страдающих сахарным диабетом), необычности клинической картины, представленности в классификациях под разными топическими названиями эта форма вызывает чрезвычайные диагностические трудности у клинициста. Клиническая картина проксимальной диабетической асимметричной невропатии характеризуется острым началом и доминированием болевой симптоматики, которая часто усугубляется в ночное время. К сожалению, пациенты и врачи не всегда связывают боль с диабетом.
Обычно боли локализуются проксимально и поражают нижние конечности больше, чем верхние. Одновременно с болью возникает мышечная слабость с последующей атрофией мышц тазового пояса и бедренной мускулатуры. Чаще всего в процесс вовлекаются четырехглавая мышца бедра и подвздошно-поясничная мышца, в результате у пациента развивается слабость флексии бедра и ощущение нестабильности колена, что максимально проявляется при подъеме по лестнице. Коленные рефлексы редуцируются или выпадают, а ахилловы могут быть сохранны или снижены в случае наличия сопутствующей дистальной полиневропатии. Симптомы прогрессируют монофазно или ступенчато. Обычно начало унилатеральное, но в течение нескольких недель или месяцев мышечная слабость распространяется на другую сторону тела.
Диабетическая радикулоплексопатия характеризуется мультифокальным поражением корешков, спинномозговых нервов и сплетений, преимущественно на пояснично-крестцовом уровне. Характерные электрофизиологические находки включают редукцию сенсорных и моторных амплитуд (амплитуда М-ответа). При этом электрофизиологические показатели (преимущественно амплитуда М-ответа) демонстрируют неравномерную степень поражения отдельных нервов с мигрирующей асимметрией по стороне тела. Даже в тяжелых случаях, когда больные на тот или иной срок утрачивают способность к самостоятельному передвижению, прогноз относительно благоприятен. Боль обычно проходит в течение нескольких недель, но иногда сохраняется в течение 6–9 месяцев. Парез и атрофия также сохраняются в течение многих месяцев. Иногда восстановление занимает несколько лет, а у части больных остается резидуальный дефект.
Неврологическим симптомам может сопутствовать общее похудание пациента, иногда весьма существенное. Преимущественно страдают пожилые люди, имеющие сахарный диабет второго типа, пик заболеваемости приходится на возраст 65 лет. Среднее время от диагностики диабета до начала развития невропатии составляет приблизительно четыре года. В отличие от диабетической сенсомоторной полиневропатии, диабетическая амиотрофия в меньшей степени ассоциирована с другими микроваскулярными осложнениями диабета (ретинопатия, нефропатия) [4].
Исследование биоптатов пораженных нервов подтверждает их ишемическое повреждение в результате микроваскулита. Для большинства случаев характерна мультифокальная утрата нервных волокон, инфильтрация волокна гемосидеринсодержащими макрофагами и/или неоваскуляризация [5, 6]. Исследования последних лет демонстрируют наличие иммунореактивных маркеров, экспрессируемых в клетках эндоневрия, что позволяет обсуждать участие иммунных механизмов в повреждении нервного волокна [7]. С ростом доказательств участия иммуновоспалительных механизмов в патологическом процессе появились попытки использовать иммуносупрессивную терапию (кортикостероиды или интравенозный иммуноглобулин), однако убедительных доказательств эффективности данной терапии у этой категории больных пока нет.
Лечение диабетических невропатий
Лечение ДН базируется на трех основополагающих принципах: оптимизация контроля глюкозы, блокирование патологических путей метаболизма, симптоматическое лечение.
Оптимизация контроля глюкозы
Важность контроля глюкозы крови (снижение уровня гликозилированного гемоглобина (HbA1c) < 7%) признается всеми экспертами. У пациентов, получающих замещающую инсулинотерапию, снижение HbA1c, например, с 9% до 7% приводит к уменьшению риска развития и прогрессирования микроваскулярных осложнений, в частности, на 60% снижается риск развития невропатии. Похожие результаты были получены и при улучшении гликемического контроля с помощью таблетированных сахароснижающих препаратов.
Однако эффективность оптимизации контроля глюкозы различается в зависимости от типа диабета (первый или второй) и цели терапии (профилактика развития невропатии или замедление прогрессирования симптомов уже сформированной невропатии). Превентивный эффект наиболее выражен у пациентов, страдающих сахарным диабетом первого типа. Вероятно, это объясняется более поздней диагностикой диабета второго типа и, соответственно, более длительным периодом воздействия гипергликемии на нервную систему (феномен, известный как «гипергликемическая память»). Кроме того, форсированная редукция HbA1c до низкого уровня может нанести дополнительный вред пациентам, страдающим диабетом в течение длительного времени [8].
Эффект в отношении замедления прогрессирования невропатии также более выражен у пациентов с сахарным диабетом первого типа. У пациентов с сахарным диабетом второго типа не менее важное значение имеют снижение веса, повышение физической активности, нормализация артериального давления и оптимизация липидного обмена. На сегодняшний день оптимальный метаболический контроль остается основополагающим этиологическим лечением всех осложнений диабета, включая ДН. Однако оптимальный контроль глюкозы только замедляет течение ДН, но не приводит к редукции симптомов. К тому же достижение целевых уровней глюкозы крови возможно далеко не у всех пациентов. Именно поэтому оптимизация контроля глюкозы не исключает патогенетической терапии. Более того, с каждым годом появляется все больше аргументов в пользу дополнительных форм терапии.
Патогенетическая терапия
Патогенетическое лечение базируется на блокировании патологических метаболических путей, вовлеченных в гликолиз. В результате большего использования организмом в условиях повышенного уровня глюкозы метаболических «шунтов» клетки становятся более восприимчивыми к окислительному стрессу, возникает воспаление и повреждение клеток, страдает капиллярное кровообращение. Многие фармацевтические субстанции, демонстрирующие эффект в эксперименте, оказались неэффективными в клинике или слишком токсичными [9]. Одной из немногих фармацевтических субстанций, хорошо зарекомендовавшей себя при клиническом применении, оказалась альфа-липоевая кислота. В 1990-х гг. были проведены основополагающие исследования эффективности и безопасности альфа-липоевой кислоты для лечения ДН с соблюдением требований доказательной медицины. Благодаря исследованию SYDNEY (Symptomatic Diabetic Neuropathy study – Исследование симптоматической диабетической невропатии) было доказано влияние альфа-липоевой кислоты на сенсорные симптомы диабетической полиневропатии. В исследовании SYDNEY участвовали пациенты со стабильным сахарным диабетом, осложненным сенсомоторной невропатией, которые получали внутривенно 600 мг альфа-липоевой кислоты или плацебо пять дней в неделю, всего 14 инфузий [10]. После курса терапии в группе активного лечения отмечалось значимое улучшение (на 5,7 пунктов) по шкале общей оценки симптомов (Total Symptom Score, TSS, оценивает основные позитивные невропатические симптомы) по сравнению с группой плацебо (изменение на 1,8 пунктов, p < 0,001).
Помимо быстрого улучшения сенсорных симптомов наблюдалась редукция процессов дегенерации нервных волокон. Авторами был сделан вывод об эффективности включения в терапию сенсорных симптомов ДН альфа-липоевой кислоты. В 2004 г. были опубликованы данные метаанализа, базирующегося на четырех рандомизированных плацебоконтролируемых исследованиях (ALADIN I (Alpha-Lipoic Acid in Diabetic Neuropathy – Альфа-липоевая кислота при диабетической невропатии), ALADIN III, SYDNEY, NATHAN II (Neurological Assessment of Thioctic Acid in Diabetic Neuropathy – Неврологическая оценка применения тиоктовой кислоты при диабетической невропатии II)), суммарно включавших свыше 1000 больных. Метаанализ убедительно показал, что уже после 3-недельного курса терапии альфа-липоевой кислотой 600 мг внутривенно положительный эффект отмечался более чем у 50% больных [11]. Причем улучшение наблюдалось как в отношении позитивных невропатических симптомов, так и в отношении неврологического дефицита. Результаты проведенных клинических исследований позволили сформировать алгоритм лечения больных ДН. Терапию начинают с внутривенного введения альфа-липоевой кислоты в разовой дозе 600 мг в течение 14–15 дней. В дальнейшем применяют таблетированные формы.
Другой многообещающей субстанцией, рассматривающейся с точки зрения патогенетической терапии, является витамин В1 (тиамин и бенфотиамин). Тиамина фосфат, биологически активная форма витамина, является кофактором транскетолазы, которая детерминирует эффективность пентозофосфатного метаболизма. Активация транскетолазы через ее кофактор позволяет организму активнее использовать пентозофосфатный путь в условиях повышенной концентрации глюкозы. Усиление «движения» через пентозофосфатный путь приводит к значительному снижению уровня всех наиболее агрессивных метаболитов гликолиза: полиола, гексозамина, протеинкиназы С и конечных метаболитов (AGE, advanced glycation endproduct – конечные продукты повышенного гликозилирования). Однако у пациентов, страдающих сахарным диабетом, уровень тиамина снижен приблизительно на 25% [12], и вышеописанный путь метаболизма становится неэффективным. Именно поэтому для пациентов с сахарным диабетом необходимо адекватное возмещение витамина В1.
Тиамина пирофосфат синтезируется путем фосфорилирования из тиамина и превращения его деривата бенфотиамина, обладающего более высокой биодоступностью, чем у водорастворимого тиамина. Бенфотиамин – жирорастворимая форма витамина В1, обеспечивающая достижение необходимых лечебных концентраций тиамина в клетках по механизму пассивной диффузии, в отличие от водорастворимого тиамина, поступление которого в клетки ограничено, так как требует наличия белков-переносчиков, не способных обеспечить лечебные концентрации тиамина в клетках. Эффективность бенфотиамина в отношении болевых и других сенсорных симптомов ДН была детально оценена в двух плацебоконтролируемых исследованиях. В исследовании BEDIP (BEnfotiamine in the treatment of Diabetic Polineuropathy – Бенфотиамин в лечении диабетической полиневропатии) было продемонстрировано, что курс терапии бенфотиамином 100 мг 3 р/сут в течение трех недель эффективно уменьшал симптомы симметричной дистальной невропатии у пациентов с сахарным диабетом второго и первого типов по сравнению с плацебо [13]. Особенно ярко был выражен позитивный эффект в отношении редукции боли. В последующем исследовании BENDIP (BENfotiamine in DIabetic Polyneuropathy – Бенфотиамин при диабетической полиневропатии) было проведено определение оптимальной дозы бенфотиамина [14]. Анализ результатов шестинедельного лечения показал, что редукция клинических проявлений по шкале невропатических симптомов составила 1,47 единиц для бенфотиамина 200 мг 3 р/сут, 0,79 единиц для бенфотиамина 100 мг 3 р/сут и 0,67 единиц для плацебо (p = 0,033).
Наиболее выраженный эффект наблюдался в отношении редукции боли, ощущения онемения. В широкомасштабном исследовании, включающем более тысячи больных, получавших бенфотиамин в монотерапии в течение 9 недель, было продемонстрировано значимое влияние бенфотиамина на сенсорные симптомы невропатии [15]. Так, доля больных, страдающих от жжения, онемения и/или парестезий в стопах, снизилась с 97,2% в начале исследования до 33,6% после завершения курса лечения (p < 0,01). Наибольший эффект наблюдался у пациентов, получавших более высокие дозы витамина (300 мг против 150 мг). Пока наиболее оправданным считается использование бенфотиамина у пациентов с болевой формой ДН. Дополнительными полезными эффектами бенфотиамина для больных диабетом являются прямое антиоксидантное действие и уменьшение выраженности эндотелиальной дисфункции. Окислительный стресс и эндотелиальная дисфункция мелких и крупных сосудов – важнейшие аспекты всех осложнений сахарного диабета.
Позитивный опыт использования бенфотиамина в лечении ДН также был подтвержден в других исследованиях, в том числе в исследованиях применения в комбинации с пиридоксином и цианокобаламином. Безусловно, комбинация «бенфотиамин, В6 и В12» представляет собой комплекс направленного нейротропного действия, способствующий регенерации поврежденных нервных волокон. У российских неврологов и эндокринологов также накоплен большой клинический опыт использования бенфотиамина для профилактики и лечения ДН. Следует отметить, что в обычной клинической практике специалисты отдают предпочтение комбинированным формам, содержащим бенфотиамин в сочетании с другими витаминами группы В. Среди препаратов отечественного производства выделяется препарат Комбилипен табс – комплекс витаминов группы В для приема внутрь – В1 (бенфотиамин), В6, В12, – показавший эффективность в лечении и профилактике ДН, а также обладающий значительными экономическими преимуществами [16]. Комбилипен табс имеет сбалансированный состав, и даже при трехразовом применении в сутки дозы не выйдут за пределы безопасного диапазона. Согласно данным проведенного открытого рандомизированного исследования, целью которого являлось сравнительное изучение фармакокинетики тиамина после однократного перорального приема комбинированных витаминных препаратов – Комбилипен табс и Нейромультивит (100 мг витамина В1 в виде бенфотиамина и тиамина гидрохлорида соответственно), было продемонстрировано, что относительная биодоступность тиамина у здоровых лиц при приеме препарата Комбилипен табс в 2,4 раза выше по сравнению с биодоступностью тиамина из препарата Нейромультивит [18].
Симптоматическое лечение
Симптоматическое лечение в основном направлено на купирование болевого синдрома. Болевой синдром, сопутствующий сенсорной невропатии, патогенетически представляет собой невропатическую боль. Подходы к лечению невропатической боли в настоящее время достаточно хорошо разработаны. Как правило, последовательно или одномоментно используют антиконвульсанты и антидепрессанты (табл. 2) [17]. Среди антиконвульсантов наиболее успешно применяются прегабалин, габапентин, окскарбазепин, карбамазепин, препараты вальпроевой кислоты. Среди антидепрессантов высокой анальгетической активностью обладают трициклические антидепрессанты и антидепрессанты двойного действия (дулоксетин, венлафаксин). Воздействуя на отдельные клинические проявления невропатии, все эти препараты не оказывают влияния на механизмы развития диабетической невропатии, то есть не являются патогенетической терапией.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.