Цервикальная радикулопатия: диагностика и терапия
- Аннотация
- Статья
- Ссылки
Традиционно локальную боль в спине подразделяют в соответствии с отделами позвоночника. Анатомоструктурные особенности физиологических отделов позвоночника в значительной степени определяют распространенность и клинику болевых синдромов. Чаще всего боли в спине локализуются в шейном и поясничном отделах позвоночника. Приблизительно треть взрослых лиц в популяции в течение года испытывают боли в спине, при этом 14% испытывают боль и в шее, и в пояснице, 12% – только в пояснице и 5% – только в шее [1]. В медицинской литературе чаще всего внимание уделяется боли в нижнем отделе спины (low back pain) как наиболее частому болевому синдрому. Доля боли в шейном отделе позвоночника, конечно, существенно меньше доли поясничной боли, но боли в шейном регионе в абсолютных цифрах представляют собой значительную социальную и медицинскую проблему.
Боли в шее, в отличие от аксиальных болей другой локализации, обусловлены более широким спектром причин, что вызывает значительные затруднения у клиницистов. Кроме того, в силу физиологической подвижности шея гораздо чаще подвергается различным неблагоприятным воздействиям. Потенциальными источниками боли в шее могут быть позвонки, мышцы, связки, фасеточные суставы, межпозвонковые диски. Постепенная дегенерация межпозвонковых дисков и фасеточных суставов шеи происходит в процессе общего старения организма. Как правило, боли в шее, особенно хронические, ассоциированы с болью в плечевом поясе, пояснице, суставах, голове.
Дегенеративные изменения в шейном отделе позвоночника являются источником трех клинических синдромов: аксиальных болей в шее, цервикальной радикулопатии, цервикальной миелопатии. У некоторых пациентов наблюдается комбинация этих трех синдромов. В то же время дегенеративные изменения шейного отдела позвоночника могут протекать асимптомно без болевых проявлений. Так, выраженные дегенеративные изменения дисков шейных позвонков обнаруживаются у 25% взрослых людей до 40 лет, у 50% людей после 40 лет и, наконец, у 85% людей в возрасте 60 лет [2, 3]. Между тем болевые синдромы в шейном отделе позвоночника у этой возрастной категории встречаются значительно реже. Наиболее часто поражается диск C5–С6 и в несколько меньшей степени – диски C6–С7 и C4–С5 [3].
Аксиальные боли в шее
Аксиальные боли в шее, не ассоциированные с неврологическим дефицитом, – наиболее частый синдром в клинической практике. Антифизиологические позы, усталость мышц шеи, низкая двигательная активность и, как следствие, дисфункция мышечной и связочной ткани являются значимыми факторами, содействующими развитию боли в области шеи. Этиология аксиальной боли в шее не всегда ясна, что, в свою очередь, обусловливает трудности лечения. Среди наиболее распространенных причин выделяют мышечно-скелетные боли в области шеи, боли, ассоциированные с хлыстовой травмой, и цервикальную головную боль.
Мышечно-скелетные (аксиальные) шейные боли (неспецифические доброкачественные) являются результатом дисфункции мышечно-связочного аппарата (миофасциальные боли) или дегенерации цервикальных дисков и фасеточных суставов. Миофасциальные болевые синдромы – наиболее распространенная причина боли в области шеи (30–85% случаев), плеча, головы. Исследования показывают, что в перегруженных группах мышц шеи (например, трапециевидной), вызывающих боль, наблюдается сниженный кровоток, сниженный уровень фосфатов с макроэргической связью по сравнению с мышцами здоровой стороны [4]. Это подтверждает, что шейные мышцы могут быть первичным источником боли. Артропатии фасеточных суставов и поражения межпозвонковых дисков также могут послужить причиной боли в шейной области. Боль может развиться как следствие повреждения синовиальной сумки, раздражения нервных волокон и ноцицептивных нервных окончаний наружной трети межпозвонкового диска.
Другим независимым фактором риска боли в области шеи является предшествующая травма шеи. Чаще всего боли развиваются после травмы по типу ускорение/торможение (разгибательный механизм повреждения). В большинстве случаев хлыстовая травма возникает при транспортных авариях, но может произойти и, например, при дайвинге. Эти боли формируются за счет разнообразных генераторов, включая миофасциальные, сухожильные, дискогенные и суставные источники. Клинические проявления боли в шее, связанные с неспецифическими мышечно-скелетными и травматическими факторами, во многом схожи. Эти боли локализуются в задних парамедианных мышцах. Типичными зонами иррадиации боли являются затылок, плечи или область лопаток. Обычно боли сопровождаются тугоподвижностью шеи в одном или нескольких направлениях и могут быть ассоциированы с локальными субъективными чувствительными нарушениями (покалывание, ощущение жжения, горения).
У трети пациентов с мышечно-скелетными причинами боли наблюдается головная боль и более часто – у двух третей пациентов – унилатеральные или билатеральные боли в плечевом поясе. Цервикогенные головные боли (ЦГБ) – неспецифический симптомокомплекс, этиологически и патогенетически связанный с патологией различных анатомических образований в шейном регионе. Источниками формирования ЦГБ могут быть:
- верхние шейные мышцы, сухожилия;
- унковертебральные сочленения;
- фасеточные суставы;
- периост, связки;
- диск С2–С3;
- вертебральная и внутренняя сонная артерии;
- твердая мозговая оболочка верхнего отдела спинного мозга.
ЦГБ имеет ярко выраженные клинические особенности, позволяющие отличить ее от первичных головных болей. Обычно характерна односторонняя боль, особенно для дебюта заболевания. В дальнейшем на высоте приступа боль может распространяться на другую сторону, но все же доминируя на стороне возникновения. На начальных этапах ЦГБ является эпизодической, в дальнейшем трансформируясь в хроническую. Быстрая хронизация – характерный признак этой головной боли. Важнейшим диагностическим критерием ЦГБ являются симптомы вовлечения шеи. Пациенты предъявляют жалобы на «окостенелость», «зажатость» в шее. Может наблюдаться ограничение объема движений в шейном отделе.
Цервикальные радикулопатии
Цервикальные радикулопатии – это моторные и/или сенсорные нарушения в области шеи и плечевого пояса, возникающие в результате внешней компрессии на шейные нервы, обычно остеофитом или фрагментами диска. Чаще всего цервикальная радикулопатия возникает у лиц среднего возраста, пик заболеваемости приходится на возраст 50–55 лет. Заболеваемость цервикальной радикулопатией составляет 83,2 на 100 000 человек [5], распространенность в популяции – 3,5 на 1000 человек [6].
Как правило, болезнь развивается постепенно, но может начаться внезапно. Первым симптомом обычно является периодическая боль в задней шейной области, часто сопровождающаяся напряжением паравертебральных мышц. В дальнейшем (при боковой грыже) боль иррадиирует в руку на стороне поражения, появляется онемение и покалывание в зоне иннервации сдавленного корешка. Как и при грыжах поясничных дисков, боль усиливается при натяжении нервных стволов, кашле и чихании. Радикулярные боли односторонние, острые, стреляющие. Боль сопровождается сенсорными нарушениями (покалывание, жжение), локализованными в дерматомах, иннервируемых компримируемым корешком. Истинная радикулярная боль «длинная», поскольку распространяется унилатерально на верхние конечности, иррадиируя в пределах дерматомов. Боль может усиливаться при разгибании руки или латеральной ротации головы. Особенно значительное усиление боли наблюдается при наклоне головы в сторону пораженного корешка (пациент «смотрит» в сторону боли). Собственно, этот прием лежит в основе симптома натяжения на шейном уровне. Так, при радикулопатии на шейном уровне поворот и наклон головы в сторону пораженного корешка приводят к сужению межпозвонковых отверстий и усилению микротравматизации корешков, что проявляется усилением боли (позитивный симптом натяжения).
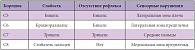
Наиболее важным симптомом для диагностики радикулопатии является комбинация боли с симптомами выпадения (гипестезии, утрата рефлексов, слабость мышц и их гипотрофия). Характерные для шейных корешков симптомы выпадения представлены в таблице 1 (приведенная симптоматика – односторонняя и соответствует стороне пораженного корешка). Комбинация симптомов у разных больных весьма вариабельна. Так, анализ клинических симптомов у 736 пациентов с достоверной радикулопатией показал, что 99% имели боль в руке, 85% – сенсорный дефицит, 79% – боль в области шеи, 71% – рефлекторный дефицит, 68% – моторный дефицит и 52% – боль в области лопатки [7].
Наиболее часто страдает седьмой шейный корешок – 70% случаев, реже вовлекается шестой шейный корешок – до 20% случаев, оставшиеся 10% приходятся на поражение пятого и восьмого шейных корешков [8]. Поражение третьего и четвертого шейных корешков встречается крайне редко. Частое вовлечение седьмого и шестого шейных корешков объясняется особенностями биомеханики шейного отдела позвоночника, благодаря которой наибольшая нагрузка приходится на нижнешейные диски, что влечет за собой более быстрое их изнашивание. За микротравматизацию корешков на шейном уровне в основном ответственны остеофиты и артрозы унковертебральных сочленений. Гораздо реже на шейном уровне встречается патология дисков. Это связано с меньшей аксиальной нагрузкой, которую несет шейный отдел позвоночника, по сравнению с поясничным отделом. Кроме того, задняя продольная связка, которая препятствует выпадению диска кзади, на шейном уровне развита лучше, чем на поясничном уровне.
Последствия клинически значимой грыжи в шейном отделе позвоночника более опасны, чем в поясничном отделе позвоночника. Грыжа чаще всего возникает на уровне C5–C6 или C6–C7. В шейном отделе, в отличие от поясничного, задняя продольная связка слабее в центральной зоне, поэтому выпячивание диска может происходить не только в заднебоковом, но и в заднем направлении. В последнем случае происходит сдавление спинного мозга с нижним спастическим парапарезом, снижением проприоцептивной чувствительности в ногах вследствие поражения задних столбов, усилением сухожильных рефлексов и двусторонним рефлексом Бабинского (цервикальная миелопатия). На шейном уровне корешки чаще сдавливаются в самом межпозвоночном отверстии, суженном в результате костных разрастаний. Непосредственно компрессию корешка может вызвать макротравма гиперэкстензионного характера, микротравматизация, связанная с особенностями профессиональной деятельности.
На животных моделях хронической невральной компрессии показано, что после 1–4 недель в заднем корешке и ганглии повышается концентрация медиаторов боли, в том числе субстанции Р [9]. Компрессия нарушает аксональный ток, что приводит к изменению метаболизма нейротрансмиттеров в аксоне и может стать причиной нарушения функции корешка. Соприкосновение двух чужеродных тканей (периневрия и костной структуры) инициирует локальный воспалительный ответ, который сопровождается выбросом воспалительных альгогенов, в частности альфа-фактора некроза опухоли.
Патогенетически болевой синдром при радикулопатии носит смешанный характер, включающий ноцицептивный и нейропатический компоненты. Ноцицептивный механизм связан с раздражением болевых рецепторов в наружных слоях поврежденного диска и окружающих его тканях, в том числе в спазмированных мышцах. Нейропатический компонент болевого синдрома связан с повреждением волокон корешка компрессией, интерневральным отеком, ишемией и воспалением. Повреждению подвергается как миелиновая оболочка волокна (демиелинизация), так и собственно волокно (аксональная дегенерация) [9].
В настоящее время достоверно подтверждено участие в формировании боли ионных каналов мембран поврежденных нервных волокон, благодаря которым генерируются и проводятся эктопические (спонтанные) разряды, воспринимаемые мозгом как чувство боли. Образование новых патологических синаптических связей (спрутинг-феномен) афферентных аксональных терминалей в заднем роге спинного мозга приводит к ошибочному восприятию неболевой информации как болевой (клинический феномен аллодинии), что является еще одним из возможных патологических механизмов. Доказано, что симпатическая вегетативная нервная система может участвовать в формировании нейропатической боли. Симпатические постганглионарные волокна образуют новые связи, благодаря чему происходит обмен информацией между симпатическими и соматосенсорными афферентами, и активация симпатических постганглионарных волокон приводит к возбуждению ноцицепторов.
Рассмотренные нейропластические изменения, участвующие в поддержании нейропатической боли, предположительно, индуцируются изменениями в нейротрасмиссии. Действительно, в экспериментах на животных показано, что на фоне боли имеется редукция количества ГАМК-содержащих нейронов в спинном мозге и повышение глютаматергической нейротрансмиссии. Радикулярная боль часто сопровождается формированием вторичного миофасциального синдрома, который, как правило, играет довольно значимую самостоятельную роль в поддержании болевого синдрома и его модификации.
При подозрении на цервикальную радикулопатию пациент должен быть проконсультирован неврологом. Обязательно проводится нейровизуальное исследование (магнитно-резонансная или компьютерная томография шейного отдела позвоночника). Боль, связанная с радикулопатией, сама по себе не является показанием к оперативному вмешательству и весьма эффективно лечится консервативно (лечение может продолжаться более 8 недель). Поэтому пациенты с радикулярной болью и незначительным неврологическим дефицитом лечатся консервативно, и только при неэффективности консервативного лечения и доказанной нейровизуализационно компрессии обсуждаются возможности оперативного вмешательства. Большинство пациентов с цервикальной радикулопатией имеют благоприятный прогноз [5]. Приблизительно у трети пациентов с цервикальной симптоматической радикулопатией симптомы рецидивируют.
Цервикальная миелопатия
Цервикальная миелопатия – состояние, которое встречается гораздо реже приведенных выше клинических синдромов, надежные эпидемиологические данные по нему отсутствуют. Цервикальная миелопатия, ассоциированная с дегенеративным поражением шейного отдела позвоночника, является наиболее распространенной причиной нетравматического нижнего парапареза или тетрапареза. Обычно развивается у пожилых пациентов. Основным симптомом является прогрессирующий в течение месяцев или еще медленнее спастический нижний парез с нарушением ходьбы. Практически всегда нарушение ходьбы сопровождается чувствительными, в том числе болевыми, и иногда моторными симптомами верхних конечностей. Парестезии в сочетании с нарушением тонкой моторики формируют синдром «неловкой, онемевшей руки» (миелопатическая рука). У некоторых пациентов наблюдается выраженное ограничение подвижности шейного отдела позвоночника. Экстензия и флексия шеи могут сопровождаться ощущением прохождения тока по позвоночнику или конечностям (синдром Лермитта). Клинический диагноз должен быть подтвержден результатами магнитно-резонансной или компьютерной томографии на нескольких уровнях, иногда необходима миелография. При применении радиологических методов исследования выявляется либо врожденно узкий спинальный канал на шейном уровне, либо дегенеративные изменения дисков и остеофиты, значительно сужающие его сагиттальный размер (менее 13 мм).
Терапия боли в шее
При слабой или средней степени тяжести боли в области шеи предпочтение отдается консервативным методам лечения. Хирургическое лечение показано при тяжелой степени боли, не отвечающей на консервативное лечение, прогрессировании заболевания или при наличии мышечной слабости и неврологическом дефиците. При отсутствии абсолютных показаний к оперативному лечению выбор метода лечения зависит от желания и индивидуальных запросов пациента. В связи с этим пациент должен быть информирован о возможных рисках и преимуществах оперативного лечения. В большинстве случаев, когда болевой синдром является ведущим, консервативное ведение пациентов признается наиболее предпочтительным.
Одним из условий успешной терапии является купирование болевого синдрома начиная с первого дня острого периода. Интенсивная корешковая боль требует полимодального обезболивания, основу которого составляют простые анальгетики, нестероидные противовоспалительные препараты (НПВП). При интенсивной боли или в случае недостаточного ответа на НПВП назначают легкий опиоид в качестве альтернативной или дополнительной терапии. Для воздействия на нейропатический компонент радикулярной боли могут быть использованы некоторые препараты из группы антиконвульсантов (карбамазепин, габапентин, прегабалин, ламотриджин) и антидепрессанты. Антидепрессанты особенно показаны пациентам с длительностью болевого синдрома более 6–7 недель.
Наряду с этими подходами достаточно популярными в купировании острой радикулярной боли оказались комбинированные витаминные препараты, содержащие тиамин (витамин В1), пиридоксин (витамин В6) и цианокобаламин (витамин В12). Хорошо известна нейротропность витаминов группы В, которые существенным образом влияют на процессы в нервной системе (обмен веществ, метаболизм медиаторов, передачу возбуждения). Доказано воздействие высоких доз витаминов группы B на регенерацию поврежденных нервов. Бенфотиамин способствует ремиелинизации через активацию фосфолипазы-A, следствием чего является чрезмерный гидролиз эфиров жирных кислот, а также оказание влияния на жидкую субстанцию миелиновых оболочек. Одновременное применение тиамина, пиридоксина и цианокобаламина стимулирует аксоплазматическую часть транспорта структурных элементов мембраны или миелиновой оболочки. Этот эффект нейротропных витаминов особенно важен при радикулопатии, поскольку компрессия корешка нарушает аксоплазматический ток.
Клинический опыт показывает, что парентеральное использование комбинации тиамина, пиридоксина и цианокобаламина хорошо купирует боль, нормализует рефлекторные реакции, устраняет нарушения чувствительности. Проведено более 90 исследований, показавших клиническое улучшение при применении витаминов группы В у пациентов с острыми болями в спине [12–13]. Во многих работах подчеркивается, что как комбинация, так и раздельное применение витаминов В1, В6 и В12 обладает анальгезирующим эффектом. Возможное анальгетическое действие витамины оказывают непосредственно на болевые рецепторы и натриевые каналы поврежденных мембран чувствительных волокон. Российское открытое исследование эффективности комбинированного нейротропного препарата Мильгамма («Вёрваг Фарма», Германия), диклофенака и их комбинации в лечении острых болей в нижней части спины, в том числе обусловленных радикулопатией, показало, что эффект Мильгаммы сопоставим с диклофенаком – «классическим» обезболивающим средством [14].
Следует обратить внимание на другое отечественное исследование эффективности внутримышечных инъекций Мильгаммы (10-дневный курс) с последующим переходом на драже Мильгамма композитум, проведенное на гомогенной группе пациентов с верифицированной дискогенной радикулопатией [15]. С помощью шкалы нейропатической боли показано, что только на фоне комбинированной терапии достоверно уменьшились такие характеристики боли, как интенсивность и острота, улучшилась переносимость боли. Мильгамма композитум может способствовать редукции нейропатического компонента боли не только в краткосрочной, но и в среднесрочной перспективе. Кроме того, при лечении острой радикулярной боли комбинация витаминов группы В с НПВП более эффективна и безопасна, чем монотерапия НПВП. На основании проведенных исследований может быть предложена следующая схема использования комбинации витаминов группы В в комплексном обезболивании при радикулярной боли:
- при острых болях рекомендуются ежедневные внутримышечные инъекции Мильгаммы (2 мл) на протяжении десяти дней;
- в дальнейшем для продолжения лечения следует рекомендовать Мильгамму композитум по 1 драже 3 раза в день ежедневно в течение месяца.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.