Показатели инсулинорезистентности и глюкозотоксичности у пациентов с различной длительностью сахарного диабета 2 типа на инсулинотерапии
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить остаточную секрецию инсулина, показатели инсулинорезистентности и глюкозотоксичности у пациентов с разной длительностью сахарного диабета 2 типа, получавших инсулинотерапию.
Материал и методы. Обследовано 102 лица с сахарным диабетом 2 типа. Их разделили на группы в зависимости от длительности патологии и дозы получаемого инсулина. У всех больных определяли индекс массы тела, уровень гликированного гемоглобина (HbA1c), С-пептида, рассчитывали индекс инсулинорезистентности (НОМА-IR(С-пептид)) и индекс глюкозотоксичности (НОМА-β(С-пептид)).
Результаты. Среди обследованных 77,4% не достигали индивидуальных целевых показателей HbA1c. При длительности сахарного диабета 2 типа менее семи лет суточная доза инсулина была выше, чем при длительности заболевания более 25 лет, – 72 (32–96) и 43 (22–61) ЕД соответственно (р = 0,044). Самый высокий индекс массы тела – 33,5 (30,2–35,9) кг/м2 отмечался у пациентов с длительностью сахарного диабета 2 типа от 7 до 15 лет и суточной дозой инсулина более 80 ЕД. Уровень HbA1c у получавших разные дозы инсулина не различался. Большие значения HOMA-IR(С-пептид) были ассоциированы с более высоким уровнем HbA1c (р = 0,013), молодым возрастом (р = 0,020) и высоким индексом массы тела (р = 0,038).
Выводы. Большая суточная доза инсулина не оказывает значимого влияния на уровень HbA1c, но сопряжена с повышенным индексом массы тела и частотой гипогликемических состояний. У пациентов с большей длительностью сахарного диабета 2 типа уровень С-пептида снижен, отмечается также меньшая суточная доза инсулина и индекс массы тела. Высокие значения НОМА-IR(С-пептид) коррелируют с большим индексом массы тела, уровнем HbA1c и длительностью заболевания от 7 до 15 лет.
Цель – оценить остаточную секрецию инсулина, показатели инсулинорезистентности и глюкозотоксичности у пациентов с разной длительностью сахарного диабета 2 типа, получавших инсулинотерапию.
Материал и методы. Обследовано 102 лица с сахарным диабетом 2 типа. Их разделили на группы в зависимости от длительности патологии и дозы получаемого инсулина. У всех больных определяли индекс массы тела, уровень гликированного гемоглобина (HbA1c), С-пептида, рассчитывали индекс инсулинорезистентности (НОМА-IR(С-пептид)) и индекс глюкозотоксичности (НОМА-β(С-пептид)).
Результаты. Среди обследованных 77,4% не достигали индивидуальных целевых показателей HbA1c. При длительности сахарного диабета 2 типа менее семи лет суточная доза инсулина была выше, чем при длительности заболевания более 25 лет, – 72 (32–96) и 43 (22–61) ЕД соответственно (р = 0,044). Самый высокий индекс массы тела – 33,5 (30,2–35,9) кг/м2 отмечался у пациентов с длительностью сахарного диабета 2 типа от 7 до 15 лет и суточной дозой инсулина более 80 ЕД. Уровень HbA1c у получавших разные дозы инсулина не различался. Большие значения HOMA-IR(С-пептид) были ассоциированы с более высоким уровнем HbA1c (р = 0,013), молодым возрастом (р = 0,020) и высоким индексом массы тела (р = 0,038).
Выводы. Большая суточная доза инсулина не оказывает значимого влияния на уровень HbA1c, но сопряжена с повышенным индексом массы тела и частотой гипогликемических состояний. У пациентов с большей длительностью сахарного диабета 2 типа уровень С-пептида снижен, отмечается также меньшая суточная доза инсулина и индекс массы тела. Высокие значения НОМА-IR(С-пептид) коррелируют с большим индексом массы тела, уровнем HbA1c и длительностью заболевания от 7 до 15 лет.
Введение
Сахарный диабет (СД) 2 типа является широко распространенным заболеванием, в основе развития которого лежит формирование периферической инсулинорезистентности и прогрессирующее снижение функции β-клеток поджелудочной железы [1, 2]. Поэтому для поддержания целевых показателей гликемии многим пациентам помимо пероральных сахароснижающих препаратов требуется инсулин. Инсулинотерапию рекомендуется начинать при превышении индивидуального целевого уровня гликированного гемоглобина (HbA1c) более чем на 2,5% [3]. Поскольку СД 2 типа нередко обнаруживают на несколько лет позже дебюта, некоторым пациентам инсулин может быть показан уже на момент постановки диагноза. Как правило, собственная секреция инсулина у таких больных не нарушена, однако эндогенный инсулин уже не способен компенсировать выраженную инсулинорезистентность [4]. Целью такого лечения является преодоление глюкозотоксичности. В дальнейшем оно может быть отменено. В связи с тем что со временем количество функционирующих β-клеток прогрессивно снижается, исходная гиперинсулинемия сменяется секреторной недостаточностью, и введение инсулина приобретает характер заместительной терапии.
Таким образом, получающие инсулин представляют собой гетерогенную популяцию с различной степенью собственной секреции инсулина, инсулинорезистентности и глюкозотоксичности.
Изучение показателей инсулинорезистентности и секреторной активности β-клеток при различном стаже СД 2 типа необходимо как для уточнения представлений о естественном течении заболевания, так и для персонификации лечебной тактики.
В настоящий момент времени наиболее чувствительным способом оценки инсулинорезистентности считается эугликемический глюкозо-инсулиновый клэмп-тест [5]. Однако его использование затруднено у пациентов с тяжелым течением СД 2 типа и лиц на инсулинотерапии. Известно, что функцию β-клеток в достаточной степени отражает уровень С-пептида [6], поэтому данный показатель можно использовать для косвенной оценки остаточной секреции инсулина, а основанные на нем расчетные показатели – для определения инсулинорезистентности. В частности, одним из таких показателей является рассчитанный по С-пептиду индекс инсулинорезистентности (НОМА-IR).
У пациентов с СД 2 типа также представляется важным изучение секреторной активности β-клеток, прогрессивно снижающейся при длительном течении заболевания [7]. Для этого применяется индекс глюкозотоксичности (НОМА-β). Так, у больных СД 2 типа со стажем заболевания менее года НОМА-β составляет 52% относительно здоровых лиц, более 30 лет – лишь 32% [8]. НОМА-β также можно рассчитывать по уровню С-пептида, что актуально у применяющих инсулинотерапию.
Целью настоящей работы стала оценка остаточной секреции инсулина, показателей инсулинорезистентности и глюкозотоксичности у пациентов с различной длительностью СД 2 типа, получавших инсулинотерапию.
Материал и методы
Исследование проводилось с 2017 по 2020 г. на базе отделения эндокринологии клиники Научно-исследовательского института сердечно-сосудистых заболеваний Первого Санкт-Петербургского государственного медицинского университета им. академика И.П. Павлова. В исследование было включено 102 пациента, из них 68 женщин, с установленным диагнозом «сахарный диабет 2 типа» и находившихся на инсулинотерапии. При поступлении в отделение всем пациентам рассчитывали индекс массы тела (ИМТ), определяли уровень HbA1c, глюкозы плазмы и С-пептида натощак, суммарную суточную дозу инсулина (СДИ). Целевые значения HbA1c и глюкозы устанавливали индивидуально для каждого пациента на основании Алгоритмов специализированной медицинской помощи больным сахарным диабетом [3]. Кроме того, у всех больных исследовали уровень антител к глутаматдекарбоксилазе. Степень инсулинорезистентности рассчитывали по формуле: HOMA-IR(C-пептид) = С-пептид × глюкоза : 22,5, глюкозотоксичности – по формуле: НОМА-β(C-пептид) = 20 × С-пептид : (глюкоза -3,5) [8]. У пациентов, контролировавших гликемию не менее двух раз в день, оценивали количество гипогликемических состояний (гликемия менее 3,9 ммоль/л) за месяц, предшествовавший госпитализации.
Значения представляли в виде медианы и межквартильного размаха, различия считались статистически значимыми при р < 0,05.
Результаты
Средний возраст всех обследованных составил 64,9 ± 8,6 года. Возраст мужчин и женщин не различался. Средний ИМТ составил 32,8 (26,0–38,6) кг/м2. Разницы в значениях ИМТ между мужчинами и женщинами не выявлено. Из 102 пациентов 79 (77,4%) не достигали индивидуальных целевых показателей HbA1c. Средний уровень HbA1c составил 9,8 (7,5–11,9)%, минимальный – 5,3%, максимальный – 17,8%. При этом была выявлена отрицательная корреляция между значениями HbA1c и длительностью СД 2 типа (коэффициент ранговой корреляции Спирмена (rS) составил -0,31; p = 0,020), а также длительностью инсулинотерапии (rS = -0,23; p = 0,013).
У 77 (75%) пациентов при поступлении в отделение гликемия натощак была вне целевых значений – 11,6 ± 2,8 ммоль/л. У троих зафиксирован низконормальный уровень – 3,7–3,9 ммоль/л, не сопровождавшийся симптомами гипогликемии.
Длительность СД 2 типа варьировалась от 2 до 45 лет с медианой 16 (9–24) лет. На момент госпитализации продолжительность инсулинотерапии составила 9 (4–14) лет.
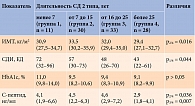
Для дальнейшего анализа данных пациенты были распределены на группы в зависимости от длительности СД 2 типа: менее 7, от 7 до 15, от 16 до 25 и более 25 лет.
При сопоставлении клинико-лабораторных характеристик установлено, что для группы с наименьшей длительностью СД 2 типа были характерны максимальные дозы инсулина (вероятно, для преодоления глюкозотоксичности), значения ИМТ и HbA1c (табл. 1).
Различия между группами в отношении уровня HbA1c оказались статистически незначимыми, несмотря на разные дозы принимаемого инсулина, наиболее высокие из которых были у пациентов с наименьшей длительностью СД 2 типа.
Суммарная суточная доза инсулина, включавшая условно физиологические и максимально высокие дозы, варьировалась от 24 до 186 ЕД. Медиана СДИ составила 68 (42–88) ЕД.
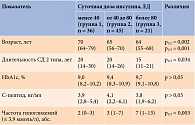
В зависимости от СДИ пациенты были разделены на три группы: менее 40, от 40 до 80 и более 80 ЕД. Клинико-лабораторные показатели указанных групп представлены в табл. 2.
Так, меньшую дозу инсулина получали пациенты более старшего возраста, что может быть связано с низкой комплаентностью лечению и большим риском гипогликемических состояний. Значимых различий по уровню HbA1c между группами не отмечено. Однако частота гликогликемических состояний у получавших инсулин в дозе более 80 ЕД/сут была выше.
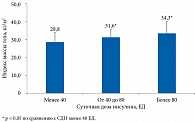
Выявлена значимая корреляционная зависимость СДИ от ИМТ (rS = 0,68; p < 0,001). В частности, ИМТ у применявших инсулин в дозе более 80 ЕД/сут был значимо больше, чем у получавших его в дозе менее 40 ЕД/сут, – 34,3 (32,3–39,8) и 28,8 (26,7–33,3) кг/м2 соответственно (рисунок).
Суточная доза инсулина также коррелировала с длительностью применения инсулина (rS = 0,21; p = 0,028). Полученные данные указывают на интенсификацию инсулинотерапии на догоспитальном этапе, возможно вследствие недостижения целевых показателей глюкозы и гликированного гемоглобина.
Необходимо отметить, что отдельно исследовали пациентов с крайне высокой СДИ (более 150 ЕД). Значимой связи между уровнем HbA1c и СДИ у получавших инсулин в дозе менее 150 ЕД/сут не установлено. У всех применявших инсулин в дозе более 150 ЕД/сут (n = 8) в анамнезе имели место регулярные эпизоды гликемии менее 3,9 ммоль/л. Это не позволяет исключить вклад гипогликемий в фактический уровень HbA1c в данной когорте пациентов.
Для оценки собственной секреции инсулина определяли уровень С-пептида натощак. У всех пациентов его показатели находились в интервале от 0,01 до 13,9 нг/мл. Средний уровень С-пептида составил 4,9 (2,5–8,1) нг/мл. Низкий уровень С-пептида (< 1,1 нг/мл) выявлялся у 12 пациентов, нормальный (1,1–4,4 нг/мл) – у 51, высокий (> 4,4 нг/мл) – у 39 лиц. При этом не было отмечено корреляции между уровнем С-пептида и СДИ. Таким образом, на момент госпитализации суточная доза инсулина не зависела от функциональной активности поджелудочной железы и степени секреторного дефицита. Кроме того, у пациентов без признаков секреторного дефицита (нормальный или повышенный уровень С-пептида) зафиксирована значимая связь между уровнем С-пептида и ИМТ (rS = 0,24; p = 0,032).
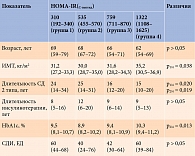
В связи с тем что у пациентов с секреторным дефицитом уровень С-пептида снижен, они не были включены в анализ степени инсулинорезистентности. У лиц с сохранной секреторной активностью поджелудочной железы значения НОМА-IR(С-пептид) находились в диапазоне от 123,8 до 2717,9. В отсутствие данных о референсных значениях НОМА-IR(С-пептид) для дальнейшего анализа 91 пациента разделили на четыре группы в зависимости от величины квартиля. Сравнивали возраст, ИМТ, СДИ, уровень HbA1c, длительность СД 2 типа и инсулинотерапии (табл. 3).
Наименьшая степень инсулинорезистентности зафиксирована у пациентов с наибольшей длительностью заболевания, что может быть связано с постепенным истощением инсулярного аппарата. «Нормальный» уровень С-пептида у обследованных может отражать не адекватную секреторную активность поджелудочной железы, а период постепенного снижения функции β-клеток, в течение которого показатели становятся условно нормальными.
Глюкозотоксичность оценивали с помощью НОМА-β(С-пептид), косвенно отражающего степень нарушения функции β-клеток при гипергликемии. Пациенты с секреторным дефицитом (низким уровнем С-пептида) из данной части исследования исключались. Значения НОМА-β(С-пептид) находились в диапазоне от 572 до 14 392 и составили 3456 (2583–5487).
Корреляции с возрастом, ИМТ, уровнем HbA1c, длительностью СД 2 типа и инсулинотерапии выявлено не было. Кроме того, не было обнаружено связи между СДИ и НОМА-β(С-пептид).
Авторы исследования полагают, что расчет НОМА-β(С-пептид) более целесообразен для оценки эффективности сахароснижающей терапии, чем при проведении поперечного исследования.
Обсуждение результатов
В исследовании проведен косвенный анализ состояния секреторной активности β-клеток и инсулинорезистентности у пациентов с СД 2 типа, находившихся на инсулинотерапии. Естественное течение заболевания предполагает постепенное снижение активности инсулярного аппарата поджелудочной железы в условиях сохраняющейся инсулинорезистентности [9, 10].
Инсулинотерапия у таких больных не всегда успешна и имеет некоторые особенности в зависимости от длительности СД и ИМТ. Так, в анализируемой группе 77,4% пациентов не достигали индивидуальных целевых значений HbA1c.
С клинической точки зрения у страдающих СД 2 типа важно анализировать показатели ИМТ, HbA1c и С-пептида, а также частоту гипогликемических состояний. В обследованной группе пациенты с длительностью заболевания менее 15 лет имели больший ИМТ, СДИ, HOMA-IR(C-пептид) при нормальном или повышенном уровне С-пептида. Каких-либо преимуществ в контроле гликемии на фоне высоких доз инсулина не установлено. Лица с длительностью СД 2 типа более 20 лет были старше. Кроме того, для них были характерны меньший ИМТ, суммарная СДИ, а также показатели С-пептида и HOMA-IR(C-пептид). Вероятно, выявленные закономерности обусловлены снижением секреторной активности β-клеток. Таким пациентам показана заместительная инсулинотерапия. Меньшая длительность СД 2 типа ассоциировалась с выраженной инсулинорезистентностью, адаптивной гиперинсулинемией (у 41,2% пациентов уровень С-пептида был выше нормы) и, как следствие, неоправданно высокими нефизиологическими дозами инсулина.
Таким образом, подбор дозы инсулина и режима его введения должен быть персонифицирован, поскольку избыточная доза инсулина приводит к увеличению массы тела и риска развития гипогликемических состояний.
Выводы
Результаты проведенного исследования позволяют сделать следующие выводы:
- высокая СДИ у пациентов с СД 2 типа не оказывает значимого влияния на уровень HbA1c и сопряжена с повышением ИМТ и частоты гипогликемических состояний;
- у пациентов с длительностью СД 2 типа более 25 лет снижен уровень С-пептида, СДИ и ИМТ, такие больные чаще достигают индивидуальных целевых значений HbA1c;
- высокие значения НОМА-IR(С-пептид) ассоциированы с увеличением ИМТ, уровня HbA1c и характерны для пациентов с длительностью СД от 7 до 15 лет.
A.V. Lisker, G.V. Semikova, V.S. Mozgunova, E.V. Volkova, A.R. Volkova, MD, PhD, Prof.
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Anna R. Volkova, volkovaa@mail.ru
Type 2 diabetes mellitus is a widespread disease, based on peripheral insulin resistance and a progressive decrease of β-cells functions. The majority of patients with type 2 diabetes mellitus do not achieve target glycemic values even with insulin therapy.
Summary: to assess the residual insulin secretion, insulin resistance and glucose toxicity in patients with different duration of type 2 diabetes mellitus on insulin therapy.
Material and methods. 102 patients with type 2 diabetes mellitus on insulin therapy were examined. The patients were divided into groups depending on the duration of type 2 diabetes mellitus and the dose of insulin. In all patients, we determined body mass index, the level of glycated hemoglobin (HbA1c) and C-peptide were measured, the index of insulin resistance (HOMA-IR(C-peptide)) and the index of glucose toxicity (HOMA-β(C-peptide)) were calculated.
Results. Among the patients with type 2 diabetes mellitus on insulin therapy, 77.4% did not achieve the individual target values of HbA1c. The daily dose of insulin in patients with a duration of type 2 diabetes mellitus less than 7 years was higher than in patients with a duration of diabetes mellitus more than 25 years: 72 (32–96) and 43 (22–61) IU, respectively (p = 0.044). The highest body mass index 33.5 (30.2–35.9) kg/m2 was determined in patients with a duration of type 2 diabetes mellitus 7–15 years: and in patients with a daily dose of insulin more than 80 IU. The level of HbA1c in patients did not differ. High value of the HOMA-IR(C-peptide) index was associated with a higher level of HbA1c (p = 0.013), young age of patients (p = 0.020) and the highest body mass index (p = 0.038).
Conclusions. A high daily dose of insulin has no significant effect on the level of HbA1c; it is associated with an increase in body mass index and an indicator of hypoglycemic conditions. Patients with a longer duration of type 2 diabetes mellitus have a lower C-peptide level, a lower daily insulin dose and a lower body mass index. High values of the insulin resistance index HOMA-IR(C-peptide) are associated with an increase in body mass index, HbA1c and are typical for patients with type 2 diabetes mellitus lasting 7–15 years.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.