Состояние скелетных мышц при хронической неспецифической боли в нижней части спины и подходы к терапии
- Аннотация
- Статья
- Ссылки
- English

Эпидемиология и причины неспецифической боли в спине
Проблема распространенности неспецифической боли в спине и поиска эффективных средств ее преодоления, согласно аналитическим данным зарубежных источников, по-прежнему остается одной из ведущих в мире. Метаанализ данных 165 клинических исследований, проведенных в разных странах в период с 1980 по 2009 г., показал, что частота острой скелетно-мышечной боли в спине в популяции составляет в среднем 31%, при этом хронический характер она приобретает у 38% пациентов. Следует отметить, что в 40% случаев не удается купировать хронический болевой синдром [1].
На хронизацию болевого синдрома влияют такие медицинские факторы, как интенсивность и длительность боли, количество источников боли и их распространенность, тяжесть структурных повреждений, нерациональная терапия, отягощенный соматический анамнез пациента, злоупотребление психоактивными средствами, курение, ожирение и инсомния. К социокультурным факторам, способствующим пролонгации болевого синдрома, относятся низкий уровень образования, неудовлетворенность работой и уровнем дохода, низкий уровень социальной поддержки и недостаточная физическая активность. Среди психологических факторов риска перехода острой боли в хроническую – высокий уровень стресса, тревоги и депрессия, неоптимальная стратегия преодоления (избегание) и катастрофизация, а также низкая самооценка [2].
Источником боли в спине может быть любая структура, содержащая ноцицепторы: мышцы, фасции, связки, межпозвонковые суставы, надкостница, внешняя треть фиброзного кольца межпозвонкового диска и др. Установлено, что к наиболее частым причинам боли в спине относятся миогенные нарушения, остеоартроз, дисфункция фасеточных суставов и крестцово-подвздошных сочленений. Только в 5% случаев боль имеет дискогенную природу (без сопутствующей радикулопатии) [2]. Следует отметить, что острая и хроническая боль в спине в этих случаях – «доброкачественное» состояние, не требующее, кроме физикального обследования, дополнительной диагностики и визуализации.
Мышечная боль вследствие чрезмерной физической нагрузки, перерастяжения мышцы при резком неподготовленном движении встречается у трети населения. Такая боль хорошо купируется в течение нескольких дней или недель независимо от применяемого лечения. Однако в ряде случаев продолжительность болевого синдрома превышает сроки восстановления тканей, отмечается вовлечение в патологический процесс других анатомических структур, не только прилегающих к первичному источнику боли, но и отдаленных. Такое течение болевого синдрома свидетельствует о развитии сенситизации как одного из признаков формирования хронического болевого расстройства (при длительности боли свыше 12 недель). В этих случаях боль рассматривается как самостоятельное заболевание – болевое расстройство. Развитие хронической мышечной боли связывают с формированием миофасциального болевого синдрома (МФБС) как основного патогенетического механизма миогенной боли невоспалительного генеза.
В течение многих десятилетий остаются дискуссионными вопросы, касающиеся распространенности, патогенетических механизмов, подходов к терапии МФБС. Следует отметить, что диагностические критерии и их значение претерпевали изменения со временем. Многие авторы считают, что обнаружения одной миофасциальной триггерной точки (МТТ) или более достаточно для постановки диагноза МФБС. Клинически МТТ – обособленный болезненный узелок в напряженной скелетной мышце, определяющийся при физикальном обследовании. Спонтанная боль клинически связана с активной МТТ, она возникает в непосредственно прилегающих или отдаленных регионах и формирует специфический болевой паттерн. Глубокая пальпация активной МТТ усиливает боль, воспроизводя типичный, узнаваемый пациентом болевой паттерн. Выявляемая при осмотре МТТ, не связанная со спонтанной болезненностью, классифицируется как латентная, при этом боль возникает только в проекции узелка. И активные, и латентные МТТ могут быть обусловлены дисфункцией мышцы, мышечной слабостью, ограничением движения. Диагностическая ценность выявления миофасциального триггера как критерия диагноза МФБС подвергается критическому переосмыслению [3].
Патогенетические механизмы миофасциального болевого синдрома
Патогенетические механизмы миогенных болевых синдромов в середине ХХ в. независимо друг от друга активно исследовали сразу несколько ученых: M. Gutstein в Германии, M. Kelly в Австрии, J.H. Kellgren в Великобритании. J.H. Kellgren картировал зону отраженной боли от различных скелетно-мышечных структур, вводя в фасции, сухожилия и мышцы гипертонический раствор. Американские исследователи J. Travell и S. Rinzler предложили термин «миофасциальная триггерная точка», подчеркнув, что патофизиология миофасциального узелка отражает изменения как в мышце, так и в окружающей ее фасции [4]. Монография «Миофасциальные боли и дисфункции: руководство по триггерным точкам», опубликованная J. Travell в соавторстве с D. Simons, – фундаментальный труд, содержащий обобщение клинических исследований и глубокий анализ механизмов МФБС и МТТ.
В настоящее время термин МФБС подразумевает отдельную нозологическую единицу, которая отличается от других заболеваний, связанных с болевым синдромом мягких тканей, таких как фибромиалгия, тендинит или бурсит [5]. МФБС может быть локальным или региональным, иногда сочетаться с зоной отраженной боли. Указанному состоянию часто сопутствует усиление напряжения и снижение эластичности мышцы. МФБС может развиться на фоне других заболеваний или синдромов, ассоциируемых с болью, например ревматических заболеваний и фибромиалгии [6]. МФБС формируется у пациентов с радикулопатией, суставной дисфункцией, патологией межпозвонкового диска, тендинитом, краниомандибулярной дисфункцией, мигренью, головной болью напряжения, синдромом карпального канала, вертеброгенной миелопатией, комплексным региональным болевым синдромом и другими расстройствами [7]. Важное значение имеет факт вовлеченности мышцы и фасции в генез болевого синдрома.
Роль мышц
Каждая скелетная мышца предназначена для выполнения конкретных функций, определенных ее анатомо-топографическим расположением, морфологическими, гистохимическими и биохимическими особенностями [8]. В соответствии с морфофункциональными свойствами волокна, входящие в состав скелетных мышц, принято подразделять на две категории: I и II типа.
Волокна I типа (тонические, медленные оксидативные) имеют относительно небольшую площадь поперечного сечения и содержат большое количество митохондрий. Они имеют большой объем саркоплазмы, в ней в свою очередь находится большое количество миоглобина, кислородсвязывающего белка, что определяет красный цвет этих волокон. Работа волокон I типа связана с непрерывным сокращением, энергия для него выделяется путем окислительного фосфорилирования жирных кислот.
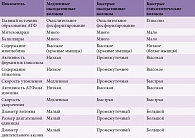
Волокна II типа (быстросокращающиеся фазические) отвечают за быстрое интенсивное, но непродолжительное мышечное сокращение. В них содержится мало миоглобина, что определяет их бледно-розовый цвет. Основным биоэнергетическим процессом в волокнах II типа является гликолиз. В свою очередь быстрые волокна делятся на два типа: быстрые оксидативные волокна (тип IIa) и быстрые гликолитические волокна (тип IIб). Волокна IIa типа по характеристикам занимают промежуточное положение: в них содержится достаточно много миоглобина, а синтез аденозинтрифосфата (АТФ), наряду с окислительным фосфорилированием, происходит в результате процесса окисления глюкозы. Волокна IIa типа имеют большое количество ферментов гликолиза, в них выше, чем в волокнах I типа, содержание гликогена, высокий уровень активности АТФазы, что характеризует физические свойства этого типа волокон: достаточно высокую скорость сокращения и относительно медленную скорость утомления [9]. Сводные характеристики мышечных волокон приведены в таблице [10].
Согласно одной из гипотез формирования МФБС, сформулированной в работе D. Simons, развитие МТТ требует чрезмерного мышечного перенапряжения и перегрузки [11]. Хотя D. Simons в разработке этой гипотезы использовал в качестве экспериментальной модели лабораторных кроликов, выводы были подтверждены в дальнейших клинических исследованиях [12].
«Гипотеза Золушки» предлагает возможное объяснение роли мышц в развитии МТТ [13]. Суть гипотезы состоит в том, что во время субмаксимального уровня напряжения при умеренной и небольшой нагрузке происходит чрезмерное рекрутирование мышечных волокон. Эти виды долгой статической нагрузки специфичны для таких профессиональных групп, как офисные сотрудники, музыканты, стоматологи, часто предъявляющих жалобы на скелетно-мышечные боли [14]. В соответствии с «принципом величины» Э. Хеннемана, во время статической нагрузки меньшие мышечные волокна I типа включаются в работу первыми, а выходят из работы последними. Предполагается, что эти волокна-«золушки» постоянно активированы и метаболически перегружены, в результате чего волокно более подвержено травматизации, происходит дизрегуляция кальция, нарушается механизм мышечной релаксации, что является ключевым фактором в формировании МТТ [15]. «Гипотезу Золушки» подтвердили D. Treaster и соавт., определив формирование МТТ у офисных сотрудников в течение 30 минут низкоинтенсивного продолжительного сокращения мышцы (длительное удержание позы при наборе текста) [14].
В результате длительных низкоинтенсивных сокращений отмечается снижение внутримышечной перфузии. Таким образом, вполне возможно, что ишемия, гипоксия и недостаточный синтез АТФ в волокнах моторных единиц I типа могут запускать механизмы и поддерживать повышенный уровень кислотности, накопления ионов Ca2+, что в последующем формирует контрактуры саркомеров. В свою очередь длительная контрактура саркомера может стать причиной снижения внутримышечной перфузии, соответственно, усиления ишемии и гипоксии. Так образуется порочный круг, который, многократно повторяясь, вероятно, обусловливает развитие МТТ. Формируется несколько сенситизированных структур, ведущих к местным и отраженным болям в дополнение к болезненности мышц, которые являются клиническими маркерами МФБС.
Роль миофасциальной триггерной точки
В настоящий момент общепринятым золотым стандартом диагностики МФБС является физикальное обследование, включающее пальпацию напряженного тяжа, обнаружение в нем отдельного болезненного узелка (MТТ), воспроизведение типичного паттерна боли при усиленном надавливании [11]. Несмотря на вполне четкие критерии, точный диагноз зависит от клинического опыта врача, его мышечной силы, уровня подготовки и навыков пальпации. Таким образом, хотя пальпация и является золотым стандартом, она имеет ряд ограничений из-за низкой специфичности и зависимости от целого ряда субъективных факторов. Зачастую бывает сложно классифицировать боль как типичную, например, пациент не предъявляет жалобы на боль в покое, а при движении испытывает значительный дискомфорт. Необходим достаточный клинический опыт, чтобы выявить МТТ в глубоких мышечных слоях. В целом изучение МТТ связано с серьезными объективными трудностями.
Один из важнейших клинических симптомов, подтверждающий наличие активной МТТ, – это локальная реакция вздрагивания («феномен прыжка»). Короткое отрывистое раздражение напряженного пучка в направлении, перпендикулярном мышечным волокнам, вызывает быстрое сокращение мышечных волокон напряженного пучка, в результате чего палец выталкивается из толщи мышцы, а сам узелок ускользает от пальпации. Происхождение «феномена прыжка» еще не полностью изучено, возможно, такая ответная реакция является следствием нарушения сенсорной обработки на сегментарном спинальном уровне из-за сенситизации периферических механорецепторов [16].
Электромиографические исследования обнаруживают спонтанную электрическую активность, образующуюся в локусе МТТ, которая не определяется в окружающих тканях. Первоначально приписываемая дисфункциональным мышечным веретенам избыточная электрическая активность на электромиограмме позднее была определена как возрастание потенциалов концевой пластинки и чрезмерного вброса ацетилхолина [17]. Однако нейрофизиологи могут по-разному трактовать значение потенциала действия концевой пластинки и «шума концевой пластины», расценивая ее не как аномалию, а как вариант нормы [18]. Трудоемкость метода игольчатой электромиографии при отсутствии специфических для МФБС изменений ограничивает его применение в клинической практике.
A. Stecco и соавт. для объяснения симптомокомплекса и физикальных данных исследовали ближайшее окружение МТТ (окружающую фасцию), где выделили три анатомических слоя: глубокую фасцию, слой рыхлой соединительной ткани (в котором находится самая высокая концентрация гиалуроновой кислоты) и нижележащий слой эпимизия [19]. Авторы акцентировали внимание именно на свойствах гиалуроновой кислоты – анионного несульфатированного гликозаминогликана, одного из основных компонентов внеклеточного матрикса в различных тканях. Гиалуроновая кислота действует как смазка, которая, способствуя скольжению, дает возможность мышечным волокнам и фасциям скользить без трения друг относительно друга. Однако A. Stecco и соавт. предположили, что в результате травмы или физической перегрузки мышцы в скользящих слоях начинается гиперпродукция избыточного количества гиалуроновой кислоты и/или увеличение ее молекулярной массы. Гиалуроновая кислота откладывается в надмолекулярных структурах, изменяя их конфигурацию, упругость и вязкость. Из-за увеличения вязкости гиалуроновая кислота теряет свойства эластичности и перестает функционировать в качестве надежной смазки, увеличивая трение в соприкасающихся слоях [19], вследствие чего уплотняются фасции и нарушается скольжение в мышечных волокнах. Ограничение взаимного скольжения приводит к уменьшению объема движений и растяжимости мышцы, тугоподвижности (ригидности), нарушению паттерна движения. Дальнейшее прогрессирование трения становится причиной гиперстимуляции (возбуждения) нейронов, что в свою очередь сенситизирует механорецепторы и болевые рецепторы, расположенные в уплотняющейся фасции. Сенситизация коррелирует с длительностью болевого синдрома, аллодинией, парестезиями, нарушением проприоцепции и развитием патологического паттерна движения. Низкая воспроизводимость исследований снижает объективность и уровень доказательности, что определяет необходимость дальнейших исследований этой концепции.
J. Quintner и M. Cohen предлагают не рассматривать формирование МТТ в качестве ведущего механизма в патогенезе МФБС, считая эти процессы вторичными на фоне основного заболевания [20]. Они выдвинули концепцию внемышечного формирования МФБС. Поскольку клинические характеристики МФБС ничем не отличаются от периферической невропатической боли, наиболее вероятным объяснением причины МФБС, по мнению ученых, является процесс сенситизации интраневральных волокон (nervi nervorum). Они предположили, что феномен МТТ, который является важнейшим компонентом МФБС, лучше рассматривать как область вторичной гипералгезии периферического неврогенного происхождения. D. Butler поддержал эту идею, предложив концепцию формирования МТТ вследствие эктопической генерации импульсов в периферических сенсорных нервах и последующих сенситизационных процессов [21]. По мнению J. Srbely, включающий в себя локальный мышечный феномен напряженного болезненного узелка МФБС – сложная форма нейромышечной дисфункции, вовлекающая мягкие ткани, чувствительные окончания, периферическую и центральную нервную систему. Возможно, нейрогенное воспаление, включение нейронов широкого динамического диапазона, структуры лимбической системы играют ведущую роль в мышечной сенситизации, хронизации боли, соматовисцеральном взаимодействии, а также в формировании объективных физикальных данных – аллодинии, гипералгезии, иррадиации болевого паттерна [15, 22].
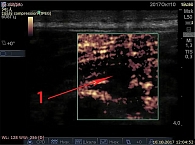
С помощью ультразвуковой диагностики и эластографии S. Sikdar и соавт. впервые продемонстрировали изменение строения мышц, содержащих пальпируемую МТТ [23]. Для исследования механических свойств мышцы при ультразвуковой локации триггера единовременно используется внешний источник вибрации, передающий колебания на мышцу, при этом на экране производится визуализация распределения амплитуд колебаний. При нативном ультразвуковом исследовании триггеры представлены гипоэхогенными образованиями (рис. 1). Показано, что МТТ имеют меньшую амплитуду колебаний от внешней вибрации в участке мышцы, соответствующем локализации пальпируемых тяжей в ткани. Ультразвуковые данные можно использовать для документирования МТТ, отслеживания их эволюции с течением времени, оценивать эффективность лечения. Механические свойства содержащих МТТ мышц количественно оцениваются путем отслеживания скорости распространения внешней вибрации при прохождении через ткани. Этот метод называется эластографией сдвиговой волны. Использование эластографии сдвиговых волн показывает, что пораженные мышцы у больных с активными МТТ более жесткие по сравнению с пальпаторно нормальными мышцами [24]. Цветовое допплеровское картирование и спектральная допплерометрия показывают, что в окружении МТТ имеются признаки ремоделирования сосудов, что особенно выражено у пациентов с острой болью [25]. Полученные данные в полной мере не раскрывают причин и механизмов возникновения МФБС, однако приподнимают завесу тайны над ним, открывая возможности для новых исследований, направленных на выявление этиопатогенетических механизмов прогрессирования и персистирования боли.
Роль боли: периферическая и центральная сенситизация
В настоящий момент наиболее всеобъемлющей является гипотеза D. Simons о периферической сенситизации при МТТ, согласно которой патологическая активность замыкательной пластинки усугубляется локальными изменениями в самой структуре мышцы. D. Simons предложил следующую концепцию: во время патологической активности замыкательной пластинки высвобождается повышенный уровень ацетилхолина, который транспортируется в саркоплазматический ретикулум и открывает кальциевые каналы. Когда кальций связывается с тропонином на мышечных волокнах, последние сокращаются. Чтобы остановить сокращение, необходим АТФ, который изменяет конформацию мышечных волокон и приводит к активному всасыванию кальция обратно в саркоплазматический ретикулум. Таким образом, недостаток АТФ пролонгирует устойчивое сокращение вблизи аномальной замыкательной пластинки, что способствует повышению метаболических потребностей, пережатию капиллярного кровообращения (результатом уменьшения притока крови становится локальная гипоксия) и поляризации мембранного потенциала [12]. Повышенное потребление АТФ при сниженном поступлении ведет к энергетическому кризису, который может вызвать выброс нейроактивных веществ (нейропептидов) и побочных продуктов метаболизма (например, брадикинина, субстанции Р и серотонина), которые могут сенсибилизировать периферические ноцицепторы [26]. Хотя гипотеза D. Simons объясняет, как сенсибилизирующие нейропептиды приводят к ассоциированной с активной МТТ боли, и является на сегодняшний день наиболее достоверной теорией, она остается не более чем догадкой. Удивительно, что ключевые позиции всеобъемлющей гипотезы триггерной точки D. Simons совпадают с самоподдерживающимся циклом «гипотезы Золушки».
Развивая гипотезу D. Simons, исследователи работают над предоставлением объективных доказательств и основополагающей роли периферической и центральной сенситизации с помощью различных исследований, включая гистологический, нейрофизиологический, биохимический и соматосенсорный методы. Например, J.P. Shah и соавт. предположили, что локальная травматизация ткани (с сопутствующим повышением различных воспалительных медиаторов, катехоламинов, нейрогенных пептидов и цитокинов) приводит к сенсибилизации терминали ноцицептора (то есть периферической сенситизации) [27]. Обнаружено, что тонкие немиелинизированные афферентные волокна проявляют ретроградные, нейросекреторные свойства, схожие с симпатическими волокнами, запускающими процесс нейрогенного воспаления (рис. 2) [28]. Таким образом, в условиях стойкой ноцицептивной бомбардировки (например, из активной МТТ) спинномозговой ганглий будет антидромно секретировать в периферическую ткань субстанцию Р и пептид, ассоциированный с геном кальцитонина. Периферическая секреция этих веществ может привести к каскаду реакций, в том числе дегрануляции тучных клеток, локальной вазодилатации, экстравазации плазмы и развитию сенсибилизирующей биохимической смеси, которая может лежать в основе клинических данных активных МТТ [27]. Процесс нейрогенного воспаления является причиной усиленного выброса эндогенных веществ: брадикинина, серотонина, норадреналина, фактора роста нервов и аденозина. Это приводит к локальной аллодинии и гипералгезии, а также усугубляет локальную болезненность ткани, дополнительно активизируя МТТ, чувствительность которой продолжает усиливаться. Непрекращающаяся бомбардировка первичными афферентными стимулами с течением времени может привести к нарушению функции и структурным изменениям в спинномозговом ганглии и нейронах заднего рога. Это состояние получило название центральной сенситизации, и ее клинические проявления включают аллодинию, гипералгезию, временную суммацию боли и расширение рецепторного поля боли [15].
Существует биохимическая основа, объясняющая развитие периферической и центральной сенситизации при мышечной боли. Непрерывная активация мышечных ноцицепторов ведет к сопутствующему высвобождению L-глутамата и субстанции P в пресинаптическом окончании заднего рога. Это приводит к максимальному открытию кальций-зависимых ионных каналов, которые чрезмерно возбуждают ноцицептивные нейроны и вызывают апоптоз тормозных интернейронов [29]. Следовательно, продолжительный патологический шквал от периферии может создать длительные изменения в центральной нервной системе. Метаболический сдвиг и запуск воспалительных изменений, таких как индукция циклооксигеназы 2 в нейронах заднего рога, достигают максимума за несколько часов после первоначальной патологической стимуляции и потенцируют функциональные изменения после травмы периферических тканей [30].
Сенситизация первичных афферентов – причина перехода от нормального к аномальному (дольше патологического периферического стимула) восприятию боли в центральной нервной системе. Иррадиация болевого паттерна, возможно, объясняется увеличением синаптической активности за счет активизации ранее молчавших (неактивных) синапсов в заднем роге. Эта концепция открытия ранее неактивных соединений продемонстрирована в модели миозита на крысах. Экспериментально индуцированным воспалением определены рецепторные поля, удаленные от оригинальных рецепторных полей. Это свидетельствует о том, что задний рог способен образовывать связи за пределами первоначальных нейронов, участвующих в ноцицептивной передаче [31].
Развитию центральной сенситизации также могут способствовать дополнительные ответы от других рецепторных полей в результате конвергенции соматических и висцеральных импульсов в заднем роге через нейроны широкого динамического диапазона [32]. Более того, афферентные волокна имеют способность прорастать в новые спинальные терминали (спраутинг), которые расширяют синаптические контакты в заднем роге и также могут способствовать расширению рецепторных болевых полей. Такой сдвиг функциональных свойств к взаимодействию может произойти в течение нескольких часов еще до метаболических и воспалительных изменений в нейронах заднего рога [33]. После активации нейронов широкого динамического диапазона входные афферентные импульсы из активных МТТ по спиноталамическому тракту достигают высших мозговых центров. В дополнение к активации таламуса мышечные афферентные импульсы преимущественно активируют лимбическую систему (переднюю поясную извилину, островок и миндалевидное тело), которая играет ключевую роль в модуляции мышечной боли и эмоциональном или аффективном компоненте стойкого болевого синдрома [34]. Повышенная активность в лимбической системе приводит к усилению страха, тревоги и стрессу. Например, D.M. Niddam и соавт. продемонстрировали увеличение активности лимбической системы у пациентов с МФБС [35].
Диагностика миофасциального болевого синдрома
В каждом случае обращения пациента с болью в спине следует определить основной патогенетический механизм боли: является ли боль скелетно-мышечной или вызвана какой-либо специфической причиной (травмой, инфекционным заболеванием позвоночника, новообразованием и др.). При первичном осмотре для этого разработана система «красных флажков», определяющих объем дообследования [36].
Симптомами опасности считаются возраст дебюта боли (до 20 и старше 55 лет), онкология, ВИЧ-инфекция, в/в наркомания, прием иммунодепрессантов в анамнезе (например, глюкокортикостероидов), некинезиогенные боли и отсутствие облегчения боли в покое, значимая травма в недавнем анамнезе, беспричинное снижение веса, лихорадка, потливость (особенно ночная), отсутствие улучшения через месяц оптимального лечения, болезненность при пальпации, перкуссии остистых отростков, дефицитарная неврологическая симптоматика (нарушения чувствительности, мышечная слабость, тазовые расстройства, синдром «конского хвоста»). В каждом из вышеперечисленных случаев необходимо проведение тщательного соматического и неврологического дообследования, включая методы нейровизуализации (магнитно-резонансную и компьютерную томографию). В действующих клинических рекомендациях при отсутствии «красных флажков» дообследование не рекомендуется [37].
Эксперты Международной ассоциации по изучению боли (2017) предложили три минимально необходимых (1–3) и шесть дополнительных (4–9) диагностических клинических критериев МФБС [38]:
- наличие пальпируемого «тугого» тяжа в мышце;
- наличие участков повышенной чувствительности в пределах «тугого» тяжа;
- воспроизведение отраженной боли при стимуляции участков повышенной чувствительности;
- локальное мышечное сокращение при прерывистой пальпации или перкуссии мышечного тяжа;
- наличие «симптома прыжка»;
- «узнаваемость» пациентом боли при стимуляции активной МТТ;
- предсказуемый паттерн отраженной боли;
- слабость или напряжение вовлеченных мышц;
- боль при сжатии или растяжении вовлеченных мышц.
Для каждой мышцы описан специфический МФБС с определенной картиной отраженной боли. Вовлекаться могут практически все мышцы, как паравертебральные, так и экстравертебральные (например, грушевидная мышца). Для вовлеченных мышц характерно ограничение объема движений, при этом не наблюдается их атрофия.
Пальпация является золотым стандартом диагностического поиска МТТ, но обладает невысокой чувствительностью и специфичностью. Конституция, выраженная толщина подкожной жировой клетчатки, глубина залегания мышц вызывают особые затруднения в диагностике, в связи с чем достаточно трудно проводить клиническую диагностику и оценивать эффективность терапии. Сенситизация периферической и центральной нервной системы, когда боль иррадиирует в конечности по ходу склеротомов и миотомов, формирует псевдорадикулярную симптоматику. В то же время мышцы участвуют в формировании естественных физиологических тоннелей для сосудисто-нервных пучков, и при стойком спазме возможно развитие миогенных невральных компрессий, например синдрома грушевидной мышцы. Блокады местных анестетиков имеют как диагностическое, так и лечебное значение [39].
В практике помимо физикального осмотра и оценки вертеброневрологического статуса мы используем методы ультразвуковой верификации. Такая методика позволяет визуализировать мышцу, поперечные отростки, дугоотростчатые (фасеточные) суставы. Дополнением служит методика оценки распространения внешней вибрации по тканям. При возникновении сомнений и дифференциальном диагнозе первичного источника боли мы селективно вводим 1–2 мл анестезирующего вещества (новокаин 0,5% или лидокаин 2,0%) либо в мышцу, либо в фасеточный сустав.
На кафедре нервных болезней и нейрохирургии Первого МГМУ им. И.М. Сеченова при участии лаборатории структуры и функции мышечных белков Института теоретической и экспериментальной биофизики РАН и материальной поддержке АНО «Академия интервенционной медицины» проводится исследование надмолекулярной структуры саркомера в норме и при патологии. Целью нашей работы является изучение состояния матричных белков скелетной мышцы у пациентов с МФБС. Топическое расположение МТТ для взятия материала определяется при помощи методики сдвиговой волны на ультразвуковом исследовании. Известно, что мышцы способны перестраиваться, но остается неясным, до какого уровня происходит перестройка саркомера. При МФБС основное значение приобретают хроническая перегрузка и перенапряжение мышцы, что сказывается на состоянии полифункциональных белков, участвующих в поддержании высокоупорядоченной саркомерной структуры и регуляции мышечного сокращения [40].
Нами проведено исследование содержания гигантских белков саркомерного цитоскелета титина и небулина у пациентов, длительно страдающих болью в спине, и пациентов с синдромом «ригидного человека». Титин – гигантский эластичный белок саркомера, являющийся матрицей для правильной сборки белков. Молекулярная масса изоформ титина составляет 3000–3700 кДа. Небулин – нерастяжимый актин-связывающий белок тонких нитей, регулирующий их длину во время сборки саркомера, с молекулярной массой 890 кДа. Снижение содержания титина и небулина в мышце при развитии патологии происходит вследствие увеличения их протеолиза. Тонус мышц повышается как у пациентов с МФБС, так и у больных синдромом «ригидного человека», но происходит это по разным причинам. При синдроме «ригидного человека» отмечается дефицит нисходящих тормозных влияний в сегментарном аппарате спинного мозга и как следствие – растормаживание спинальных мотонейронов. У пациентов с МФБС при проведении ДСН-гель-электрофореза белков скелетной мышцы нами было выявлено снижение (от 20 до 40%) содержания титина и небулина (рис. 3). Интерпретация полученных данных и оценка клинической значимости пластических изменений мышечной ткани будут возможны после завершения набора и статистической обработки материала. Мы рассчитываем на то, что полученные сведения будут полезны в создании алгоритма стратификации диагностики и лечения МФБС.
Лечение миофасциального болевого синдрома
Независимо от этиологических факторов, вызвавших боль в спине, в первую очередь пациенты нуждаются в адекватном обезболивании [41]. Следует учитывать патогенетические механизмы МФБС: воспалительный процесс (в том числе протекающий субклинически), стойкое напряжение мышц и вследствие этого нарушение биомеханики, недостаточность нисходящих антиноцицептивных механизмов и признаки периферической и центральной сенситизации. Эти процессы определяют единый спектр лекарственных средств, используемых для лечения скелетно-мышечной боли независимо от ее этиологии: парацетамол, нестероидные противовоспалительные препараты (НПВП) и средства, снижающие проявления центральной сенситизации, – миорелаксанты, SNEPCO (флупиртин), в крайнем случае трамадол.
Базовым в анальгетической терапии является назначение современных НПВП, блокирующих выработку медиаторов воспаления – простагландинов за счет ингибирования фермента циклооксигеназы. Простагландины сенситизируют (повышают чувствительность к раздражению) или, иначе говоря, снижают порог активации первичных афферентных нейронов. Предполагается, что эффект простагландинов реализуется через воздействие как на пресинаптические, так и на постсинаптические мембраны первичного афферентного синапса желатинозной субстанции спинного мозга. Следует помнить, что НПВП особенно эффективны на ранних стадиях развития боли в спине. Именно на этом раннем этапе с помощью традиционных НПВП можно влиять на выработку периферических медиаторов воспаления.
При включении в процесс центральных патофизиологических механизмов боли монотерапия обычными НПВП, не обладающими центральным действием, перестает быть эффективной. Центральное антиноцицептивное действие НПВП обусловлено подавлением синтеза простагландинов в центральной нервной системе, что подтверждается выраженной диссоциацией между противовоспалительным и антиноцицептивным эффектами. При назначении НПВП следует учитывать возможность проникновения действующего вещества через гематоэнцефалический барьер, которое осуществляется в основном за счет пассивной диффузии молекул НПВП, не связанных с белковыми комплексами плазмы. Этот показатель неодинаков у разных препаратов, но он отвечает за способность подавлять синтез простагландинов в центральной нервной системе и оказывать центральное действие при острых и хронических болевых синдромах [42].
Если монотерапия НПВП не купирует болевой синдром, следует пересмотреть тактику лечения и выяснить причины неэффективности НПВП в каждом конкретном случае [34]. Необходимо учитывать патогенетические механизмы НПВП и воздействовать непосредственно на стойкий спазм мышц. Для этого применяются миорелаксанты (баклосан 10–30 мг/сут, тизанидин 6–12 мг/сут, толперизон 150–450 мг/сут).
Комплексный подход включает подбор фармакологических препаратов, физическую и психологическую реабилитацию с применением когнитивно-поведенческой терапии. Следует выявить представления пациента о причинах болевого синдрома, оценить возможные неадаптивные стратегии преодоления боли, коморбидные психосоциальные нарушения. Из полученных данных формируется индивидуальная программа, проводятся индивидуальные или групповые сеансы. Эффективны различные виды физической реабилитации, способствующей увеличению объема движения, преодолению кинезиофобии.
В случае неэффективности неинвазивных методов лечения боли свыше двух недель возможно применение интервенционных методов лечения боли, таких как локальное введение глюкокортикостероидов в очаг воспаления или устойчивого мышечного спазма (блокада) [41]. Блокады по назначению подразделяют на диагностические, прогностические и лечебные. С помощью диагностических блокад уточняется диагноз ex juvantibus: если блокада визуализированного миофасциального триггера, а не фасеточного сустава позволяет временно купировать болевой синдром, то основной механизм развития неспецифической боли у данного пациента – миофасциальный, а не спондилоартропатический. Соответственно, диагностическая блокада фасеточного сустава или крестцово-подвздошного сочленения раствором местного анестетика позволяет не только определить источник боли в спине, но и предсказать эффективность малоинвазивной нейрохирургической процедуры – высокочастотной денервации сустава [43].
Учитывая большой арсенал средств для проведения лечебных блокад, при выборе препарата, с одной стороны, следует понимать фармакодинамику и механизм его действия, с другой – этиопатогенетические особенности развития боли. Требования к препаратам для интервенционной терапии предъявляются по трем основным характеристикам:
- эффективность (быстрота наступления анальгезии, продолжительность обезболивающего действия, доказанная эффективность локального введения);
- безопасность (отсутствие системных побочных эффектов, серьезно ухудшающих состояние здоровья пациента, локальной нейротоксичности, некроза ткани в месте введения);
- хорошая переносимость процедуры введения препарата (отсутствие непереносимого усиления боли во время и после блокады).
Основа малоинвазивной терапии – местные анестетики, обеспечивающие быстрый анальгетический эффект. Однако продолжительность действия местных анестетиков составляет от нескольких десятков минут до нескольких часов, что не позволяет добиться стойкой ремиссии болевого синдрома. Кроме того, анестетики не обладают противовоспалительной и противоотечной активностью, поэтому дополнительными препаратами, применяющимися для малоинвазивного лечения боли в спине с 1952 г., являются гормональные средства – глюкокортикостероиды. Их использование основано на противовоспалительном, десенсибилизирующем и противоотечном действии как локально в тканях, так и системно в организме [44, 45].
Помимо циклооксигеназного и липооксигеназного путей воспаления рассматривают также влияние окислительного стресса на ткани при хронической боли и воспалении опорно-двигательного аппарата [46]. Поэтому в качестве альтернативы для локальной инъекционной терапии боли с принципиально иным механизмом действия, а также более безопасным профилем применения рассматриваются комбинированные препараты на основе модифицированных солей гиалуроновой кислоты для внесуставного введения (Хондрорепарант® Гиалрипайер®) [47]. Хондрорепаранты имеют две формы выпуска (для внесуставного и внутрисуставного введения) и два варианта состава взаимодополняющего действия: Хондрорепарант® Гиалрипайер®-10 содержит антиоксидантные компоненты аскорбилфосфат, цистеин и глутатион, а Хондрорепарант® Гиалрипайер®-02 состоит из протеиногенных аминокислот пролина, лизина и глицина. Гиалуроновая кислота способствует снижению уровня простагландина Е2, уменьшению экспрессии интерлейкина 1, фактора некроза опухоли альфа, снижению синтеза металлопротеиназ и уровня NO. Антиоксидантные комплексы потенциально способны подавлять оксидативный путь воспаления, облегчая болевой синдром, а протеиногенные аминокислоты могут способствовать восстановлению внесуставных тканей [48].
Описанные выше механизмы формирования МТТ (теория нарушения скольжения нитей, изменение саркомеров, нарушенное типирование мышечных белков) при длительном МФБС приводят к структурным изменениям мышечной ткани, поэтому цель интервенционной терапии – достичь не только противовоспалительного эффекта, но и репаративного действия. В практике для пациентов с интенсивностью острого болевого синдрома (или обострением хронического) 5–6 баллов по Визуальной аналоговой шкале (максимум 8 баллов) мы применяем Гиалрипайер®-10. За счет входящих в состав формулы компонентов блокада оказывает противовоспалительный и анальгетический эффект. При хроническом болевом синдроме, для которого характерна структурная перестройка как мышцы, так и входящих в состав саркомера сократительных белков, и на этапе реабилитации для стимулирования репаративных процессов нашел свое место Хондрорепарант® Гиалрипайер®-02. Хотя использование гиалуроновой кислоты для внесуставного введения патогенетически обосновано, требуются дальнейшие исследования для формирования доказательной базы.
Целесообразность интервенционного лечения боли должен определять лечащий врач для каждого пациента индивидуально. Но окончательное решение о проведении малоинвазивного лечения все равно остается за больным, что подтверждается официально подписанием информированного согласия. Осознанное желание пациента провести блокаду, его убежденность в эффективности и пользе этого метода – немаловажный фактор достижения положительного результата, но при условии, что врач предоставил полную информацию о побочных явлениях. Положительное отношение пациента к проведению инвазивных процедур, особенно если психосоциальные или экономические факторы требуют более быстрого восстановления, оправдывает применение интервенционного лечения.
Заключение
Анализ литературных данных, касающихся диагностики и лечения МФБС, а также собственный клинический опыт показывают, что наибольшей эффективностью в преодолении боли обладает мультидисциплинарный подход, когда методы психотерапии, физической активизации и реабилитации, рационального обезболивания, включая локальные инъекционные способы, назначенные вместе или последовательно в одном комплексе, потенцируют друг друга. Когнитивно-поведенческая психотерапия корригирует неправильные, препятствующие выздоровлению представления пациента о природе заболевания, помогает изменить социальное подкрепление болевого поведения, обучает пациента методам управления болью. Методики лечебной физкультуры (кинезиотерапия) восстанавливают нормальный стереотип движения, оптимизируют идеомоторику, помогают преодолеть кинезиофобию, увеличивают уровень повседневной активности. Фармакотерапия НПВП и миорелаксантами, а также интервенционные методы лечения боли выполняют важную роль – обеспечивают достаточную аналгезию для проведения двигательной реабилитации. Использование препаратов гиалуроновой кислоты для внесуставного введения (Хондрорепарант® Гиалрипайер®), предоставляющих возможность репарации тканей, вероятно, можно рассматривать как новый, патогенетически обоснованный этап в лечении пациентов с хроническими скелетно-мышечными болевыми синдромами. Необходимы дальнейшие качественные исследования патоморфологии МТТ как важного механизма патофизиологии МФБС у пациентов с хронической неспецифической болью в спине.
D.O. Rozhkov, O.Ye. Zinovyeva, A.N. Barinov, I.M. Vikhlyantcev, A.D. Ulanova
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Interregional Association of Specialists in Palliative and Interventional Medicine
Institute of Theoretical and Experimental Biophysics of RAS
Contact person: Aleksey Nikolayevich Barinov, mmom-mc@mail.ru
The article provides the causes and pathogenetic mechanisms of non-specific back pain. Particular emphasis is made: on the role in the development of muscle myofascial pain syndrome, myofascial trigger points, peripheral and central sensitization. Methods of diagnostics and treatment are considered. Noted that in pain overcoming the multidisciplinary approach is the most effective one as the methods of psychotherapy, physical activation and rehabilitation as well as rational anesthesia, including local injection methods, assigned together or consequently in one complex, potentiate each other.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.