Практическая неврология – 2021: вызовы времени. XVII Ежегодная междисциплинарная конференция с международным участием «Вейновские чтения». Сателлитный симпозиум компании «Канонфарма продакшн»
- Аннотация
- Статья
- Ссылки

Кризис «хронической цереброваскулярной ишемии» – взгляд из ХХI в.
Симпозиум открыл профессор кафедры нервных болезней Первого Московского государственного медицинского университета (МГМУ) им. И.М. Сеченова, д.м.н. Владимир Владимирович ЗАХАРОВ. Он отметил, что хроническая ишемия головного мозга (ХИГМ) – самый популярный неврологический диагноз в нашей стране. Согласно данным статистики за 2017 г., на каждые 100 тыс. населения России приходится 5560 пациентов с диагнозом ХИГМ. В общей сложности ХИГМ и заболеваниями нервной системы страдают 6 527 579 человек1.
Под ХИГМ понимают сосудистые события, которые развиваются в головном мозге, имеют разную морфологию, но схожую клиническую картину. На современном этапе клинические и нейрорадиологические методы диагностики позволяют выделить морфологические варианты ХИГМ. При ведении пациентов необходимо учитывать патогенетические основы формирования сосудистого поражения мозга в каждом конкретном случае. Под маской ХИГМ могут скрываться острые нарушения мозгового кровообращения – немые инфаркты, микрокровоизлияния, криблюры. В клинической практике встречаются пациенты с сосудистыми нарушениями, которые можно отнести к истинным ХИГМ. Речь, в частности, идет о лейкоареозе – заболевании головного мозга, развивающемся на фоне хронических процессов ишемии белого вещества.
Докладчик рассмотрел распространенные в реальной практике клинические случаи нарушения мозгового кровообращения.
Клинический случай 1: лакунарная киста моста как случайная находка. Пациент 58 лет обратился в поликлинику по поводу эпизодов головной боли с иррадиацией в левый глаз. Проведен дифференциальный диагноз между мигренью и кластерной головной болью. Ранее при профилактических осмотрах неоднократно отмечалось повышение артериального давления (АД). Лечения не получал. По результатам магнитно-резонансной томографии (МРТ) головного мозга выявлена лакунарная киста в правой половине моста. Легкий лейкоареоз. В неврологическом статусе двигательная или чувствительная симптоматика отсутствует, рефлексы симметричны.
Клинический случай 2: лакунарный инфаркт под маской гипертонического криза. Пациентка 53 лет обратилась к специалистам в связи с приступом выраженной цефалгии, который сопровождался повышением АД до 170/100 мм рт. ст. В неврологическом статусе двигательных или сенсорных нарушений нет, рефлексы симметричны. Состояние расценивалось как гипертонический криз. Назначен Коринфар сублингвально. Однако при проведении МРТ обнаружен свежий лакунарный инфаркт (подострая стадия) в области правого хвостатого ядра. Возможно, прием быстродействующего антигипертензивного препарата спровоцировал развитие инфаркта. Экстренное снижение АД способно усугубить церебральную ишемию.
Немые инфаркты следует дифференцировать с расширением периваскулярных пространств – криблюрами. При нейровизуализации криблюры имеют схожие магнитно-резонансные характеристики и отличить их можно только по локализации.
Клинический случай 3: расширенные периваскулярные пространства на фоне мигрени. Пациентка 34 лет без сосудистого анамнеза обратилась с жалобами на мигрень. МРТ показала расширенные периваскулярные пространства (криблюры).
Мигрень – заболевание, сопровождающееся нейрогенным воспалением и в ряде случаев нарушением гематоэнцефалического барьера (ГЭБ), что может приводить к возникновению расширенных периваскулярных пространств, не имеющих прямого отношения к ХИГМ. Церебральные микрокровоизлияния связаны с повышением проницаемости стенки артериол при гипертензивной васкулопатии, ассоциированы с двукратным увеличением риска ишемического инсульта и пятикратным увеличением риска крупного внутримозгового кровоизлияния. При ведении пациентов с церебральными микрокровоизлияниями могут возникнуть вопросы с назначением терапии. Дело в том, что, с одной стороны, пациентам с сосудистыми факторами риска показана антикоагулянтная или антиагрегантная терапия, с другой – микрокровоизлияния ассоциированы с риском ишемического инсульта. Лейкоареоз – диффузное двустороннее изменение белого вещества полушарий головного мозга. По данным крупных международных метаанализов, распространенность лейкоареоза в старших возрастных группах приближается к 100%.
В исследовании SMART за 575 пациентами (средний возраст – 57 ± 10 лет) наблюдали в течение четырех лет. Им периодически выполняли МРТ с высоким разрешением магнитного поля 1,5 Т, в том числе в перфузионном режиме. Церебральный кровоток рассчитывали по прохождению болюса контраста через 100 мл мозгового вещества. По мнению голландских исследователей, снижение мозгового кровотока не является предиктором развития лейкоареоза. В то же время лейкоареоз можно считать предиктором снижения мозгового кровотока2.
Профессор В.В. Захаров подчеркнул, что расширение периваскулярных пространств, изменения белого вещества полушарий головного мозга не подтверждают наличие у больного сосудистого заболевания мозга.
Безусловно, сосудистые факторы играют определенную роль в развитии лейкоареоза. Как уже отмечалось, лейкоареоз различной степени выраженности имеет место у подавляющего большинства пожилых и старых людей. У одних могут быть бессимптомные точечные поражения – 0–1-я стадия по шкале Fazekas, у других – большие сливающиеся повреждения, сопровождаемые когнитивными расстройствами, сосудистой деменцией, – 3-я стадия. Вариабельность выраженности лейкоареоза зависит прежде всего от наличия/отсутствия гипертензии и других факторов сосудистого риска.
Важный момент: указанные сосудистые изменения и ХИГМ способны регрессировать. Почему это происходит и можно ли этому способствовать, неизвестно. В многочисленных исследованиях установлено, что со временем уменьшается не только выраженность лейкоареоза, но и число немых инфарктов при повторных МРТ-исследованиях. Они могут трансформироваться в лейкоареоз либо, наоборот, лейкоареоз – в инфаркты.
Доказательств, что регресс проявлений ХИГМ имеет клиническое значение, нет. Так, в исследовании в течение более восьми с половиной лет наблюдали за пациентами с ХИГМ. У 23 из 277 пациентов зафиксировано уменьшение сосудистых изменений (лейкоареоза). Между тем когнитивные функции остались на прежнем уровне. На атрофию коркового вещества регресс ХИГМ существенно не повлиял3.
Итак, в понятие ХИГМ входят отдельные болезни, объединенные общей клинической картиной в виде синдрома сосудистых когнитивных расстройств подкоркового типа с преобладанием нарушений внимания, брадифрении и флуктуации при относительной сохранности других когнитивных функций.
Когнитивные функции подразделяют на инструментальные и динамические. Инструментальные когнитивные функции – знания и навыки, приобретаемые в течение жизни (словарный запас, знание грамматических конструкций, семантическая память, пространственные координаты, схема тела, автоматизированные двигательные навыки, автобиографическая память), динамические – возможности к познанию (мотивация, скорость реакции, внимание и концентрация). Сосудистые подкорковые когнитивные расстройства преимущественно снижают динамическую составляющую и не влияют на знания и навыки. О нейродегенеративном процессе говорят в том случае, когда утрачиваются ранее приобретенные знания и навыки. В то же время когнитивные нарушения могут быть обусловлены двумя и более патологическими процессами. У пациентов с когнитивными расстройствами можно предположить не только наличие ХИГМ, но и сочетание нейродегенеративного процесса и сосудистых факторов риска.
В настоящее время появляется все больше данных о влиянии коронавирусной инфекции на возникновение когнитивных нарушений. По мнению ряда авторов, «входными воротами» для нового коронавируса SARS-CoV-2 служат рецепторы ангиотензинпревращающего фермента 2, который экспрессируется как в нейронах, так и в астроцитах и олигодендроцитах.
Показано, что у пациентов с коронавирусной инфекцией возрастает риск острых нарушений мозгового кровообращения. Кроме того, высказываются предположения о прямом влиянии вируса на повреждение головного мозга.
Таким образом, при установлении диагноза ХИГМ в каждом случае необходимо анализировать характеристики конкретного пациента и выявлять мишени терапевтического воздействия. Среди терапевтических мишеней можно выделить метаболические расстройства, сердечно-сосудистые заболевания, тревожно-депрессивные нарушения, нейродегенеративные процессы, цереброваскулярную патологию, здоровый образ жизни и социализацию.
Как известно, важным начальным этапом сосудистого повреждения мозга является перекисное окисление липидов, которое приводит к эндотелиальной дисфункции, способствующей развитию атеросклероза, липогиалиноза и повреждению ГЭБ. Не случайно оправданным и целесообразным методом лечения при сосудистом повреждении мозга считается использование антиоксидантов.
Этилметилгидроксипиридина сукцинат (ЭМГПС) – классический антиоксидант, синтезированный учеными и выпускаемый в разных лекарственных формах. МексиВ 6 – комбинированный препарат, в котором сочетаются ЭМГПС, витамин В6 и магния лактат (как дополнительный компонент). Фиксированная комбинация препарата позволяет уменьшить число принимаемых таблеток во избежание полипрагмазии.
Антиоксидант и антигипоксант ЭМГПС препятствует окислению при окислительном стрессе, нейтрализует потенциальное негативное воздействие оксидантов, способствует обновлению и оздоровлению клеток организма человека. Витамин В6 (пиридоксин) – метаболик, который катализирует обмен аминокислот и синтез большинства нейромедиаторов нервной системы, улучшает процессы метаболизма в тканях мозга. Дополнительный компонент магния лактат является катализатором нейротрансмиссии. Он необходим для нормального обмена нейромедиаторов, регулирует глутаматергический синапс, способствует уменьшению эксайтотоксичности глутамата. Уникальное сочетание компонентов в препарате МексиВ 6 обусловливает его антиоксидантные и мембранопротективные свойства. Препарат МексиВ 6 может с успехом применяться у пациентов с ХИГМ.
Еще одна уникальная фиксированная комбинация – препарат Винпотропил. В его состав входят винпоцетин и пирацетам, которые давно используются в клинической практике. Доказано, что винпоцетин и пирацетам не просто дополняют, а взаимно усиливают действие друг друга. Причины синергических эффектов Винпотропила обусловлены схожими точками влияния его компонентов на кальциевый сигнальный путь, путь регуляции дофаминергического синапса, сигнальный путь циклического аденозинмонофосфата.
В клиническом исследовании с участием 90 пациентов с ишемическим инсультом в восстановительном периоде сравнивали эффективность монотерапии винпоцетином и пирацетамом с эффективностью терапии фиксированной комбинацией Винпотропил. Лечение Винпотропилом сопровождалось значительным регрессом субъективных жалоб. В группах монотерапии динамика была существенно менее выражена, и только в группе Винпотропила результаты были достоверными. Кроме того, на фоне лечения Винпотропилом отмечалось статистически значимое улучшение показателей церебрального кровотока. Таким образом, комбинированная терапия имеет преимущества перед монотерапией у пациентов с сосудистыми заболеваниями мозга, в частности в улучшении когнитивных функций, внимания и памяти4.
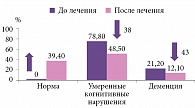
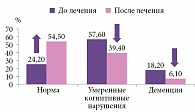
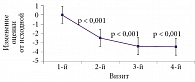
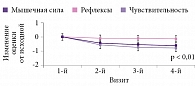
Российские исследователи под руководством профессора А.Н. Боголеповой оценивали совместное применение препаратов МексиВ 6 и Винпотропил (100/800) у пациентов с ХИГМ 1–2-й стадии5. Пациентам с ХИГМ вначале назначали препарат МексиВ 6 в качестве предварительной антиоксидантной терапии для снижения проявлений эндотелиальной дисфункции, затем добавляли Винпотропил с целью воздействия на церебральную микроциркуляцию и метаболические процессы. При использовании МексиВ 6 у больных наблюдался значительный регресс симптомов ХИГМ. Пациенты отмечали положительную динамику состояния: улучшение самочувствия, когнитивных функций, снижение уровня астении и тревожно-депрессивных расстройств (рис. 1)5. После добавления к схеме лечения препарата Винпотропил большинство больных сообщали о значительном улучшении самочувствия (рис. 2)5. Результаты проведенного исследования показали, что предложенная схема терапии эффективна и безопасна.
Подводя итог, профессор В.В. Захаров подчеркнул, что термин ХИГМ объединяет различные по патогенезу, клиническим проявлениям, морфологии и подходам к терапии цереброваскулярные заболевания. Основным клиническим симптомом ХИГМ являются сосудистые когнитивные нарушения. Важное место в схеме патогенетической терапии хронического прогрессирующего поражения головного мозга занимают антиоксидантные, нейрометаболические и эндотелиопротективные препараты.
Медикаментозная терапия постинсультных когнитивных нарушений в современных условиях
Как отметила профессор кафедры неврологии, нейрохирургии и медицинской генетики Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, руководитель отдела когнитивных нарушений Федерального центра мозга и нейротехнологий, д.м.н. Анна Николаевна БОГОЛЕПОВА, цереброваскулярные заболевания относятся к одной из ведущих причин летальности и инвалидизации неврологических больных.
В нашей стране регистрируется свыше 400 тыс. случаев инсульта ежегодно. Несмотря на современные методы диагностики и лечения, более 150 тыс. человек умирают от инсульта в течение одного года. Только у 8–10% пациентов, переживших инсульт, нарушенные функции восстанавливаются в первые три недели заболевания.
Пандемия COVID-19 внесла существенные коррективы в работу системы здравоохранения всех стран. Неврологическая практика не стала исключением. По данным на 31 января 2021 г., коронавирус SARS-CoV-2 поразил 102 млн человек и стал причиной более 2,2 млн смертей в мире. Установлено, что инсульт развивается примерно у 1–3% госпитализированных пациентов и 6% пациентов в отделении интенсивной терапии6. Инсульт представляет собой одно из серьезных неврологических осложнений COVID-19. Патогенетические механизмы COVID-19-индуцированных инсультов во многом отличаются от традиционных механизмов развития ишемического инсульта. Однако важно понимать, что те факторы риска, которые обусловливают наиболее тяжелое течение COVID-19, по сути являются факторами риска развития острого нарушения мозгового кровообращения. Прежде всего это артериальная гипертензия, сахарный диабет, ишемическая болезнь сердца, хроническая дыхательная недостаточность. Сегодня нельзя однозначно сказать, что COVID-19 – независимая причина развития инсульта или некий дополнительный триггер, запускающий необратимый патологический каскад, приводящий к церебральной катастрофе.
Последние данные подтверждают, что значение COVID-19 как триггера инсульта очень высоко: вероятность цереброваскулярных осложнений на фоне инфекции SARS-CoV-2 увеличивается почти в восемь раз по сравнению с таковой при тяжелом течении гриппа7.
Исходы инсультов, связанных с COVID-19, значительно хуже исходов инсультов, не связанных с данной инфекцией8.
Когнитивные нарушения возникают после любого инсульта, независимо от того, связан он с COVID-19 или нет. Постинсультные когнитивные нарушения вносят весомый вклад в инвалидизацию больных. Вместе с тем лечению когнитивных нарушений после инсульта часто не уделяется должного внимания по сравнению с другими неврологическими нарушениями, например сенсорными или моторными. При этом 83% выживших после инсульта имеют нарушения по крайней мере в одной из когнитивных сфер, 50% – в нескольких (более трех). Перенесенный инсульт почти в пять раз увеличивает риск развития деменции. Заболеваемость ею у пожилых пациентов, перенесших инсульт, увеличивается по сравнению с популяцией без инсульта, а также с течением времени. Если через год после перенесенного инсульта частота развития деменции составляет 10%, то через пять лет – 32%9.
Анализ публикаций трех электронных баз данных, размещенных до июня 2016 г., продемонстрировал, что основными факторами постинсультного когнитивного снижения являются аффективные нарушения (депрессия), пожилой возраст, преморбидный когнитивный статус, локализация инсульта и наличие инсультов в анамнезе10.
Среди факторов риска развития постинсультных когнитивных нарушений, непосредственно связанных с сосудистым поражением головного мозга, выделяют прежде всего инсульт в стратегически важной зоне, атрофию медиальной височной доли, общий объем ткани головного мозга и объем очага. Важным фактором считается гиперинтенсивность белого вещества – лейкоареоз. Повреждения белого вещества, предшествовавшие инсульту или развившиеся после перенесенной церебральной катастрофы, приводят к формированию так называемого феномена разобщения, при котором нарушается интегративная деятельность больших полушарий мозга. В результате возникают когнитивные расстройства.
В настоящее время обсуждается вклад морфологических изменений, таких как микрокровоизлияния и расширенные периваскулярные пространства, в развитие нарушений когнитивной деятельности.
Когнитивный дефицит приводит прежде всего к снижению памяти, речевой активности, нарушению внимания, аграмматизму и другим состояниям. На фоне когнитивных расстройств нарушается повседневная деятельность (ограничение мобильности, сложности с выполнением повседневных дел, зависимость от родственников). Имеют место функциональные нарушения, снижение социальной удовлетворенности, сужение круга интересов, утрата работоспособности, самостоятельности. Кроме того, когнитивный дефицит часто сопряжен с эмоциональными и поведенческими нарушениями: сменой настроения, повышенной тревожностью, депрессией или эйфорией, апатией или расторможенностью.
Когнитивные нарушения – дополнительный независимый фактор риска развития инсульта. Доказано, что перенесенный инсульт с глобальным когнитивным снижением повышает риск развития повторного инсульта. Не случайно лечение когнитивных нарушений считается одним из важных компонентов вторичной профилактики инсульта.
Постинсультная деменция связана с повышенным риском развития повторного инсульта. При этом у пациентов с первым инсультом подобный риск еще выше11.
С целью коррекции постинсультных когнитивных нарушений в клинической практике используют препараты с нейропротективным и антиоксидантным мультитаргетным эффектами. Один из хорошо изученных препаратов нейропротективного действия – цитиколин (Цересил Канон).
Цересил Канон – предшественник ключевых ультраструктурных компонентов клеточной мембраны, преимущественно фосфолипидов, характеризуется широким спектром действия. Он способствует восстановлению поврежденных мембран клеток, ингибирует действие фосфолипаз, препятствует избыточному образованию свободных радикалов, предотвращает прогрессирование и развитие апоптоза. В экспериментальных исследованиях показано снижение активности участвующих в апоптозе нейронов каспаз и прокаспаз при введении цитиколина.
Эффективность цитиколина в отношении терапии когнитивных и поведенческих расстройств подтверждена результатами ряда метаанализов. Так, Кокрейновский обзор 14 рандомизированных плацебоконтролируемых исследований с участием 1336 пожилых пациентов с хронической цереброваскулярной патологией продемонстрировал, что цитиколин в средней дозе 1000 мг/сут в течение трех месяцев позитивно влияет на показатели памяти, поведенческие функции12.
Показаниями к назначению российского препарата Цересил Канон являются острый период ишемического инсульта, восстановительный период ишемического и геморрагического инсультов, черепно-мозговая травма, когнитивные и поведенческие нарушения при дегенеративных и сосудистых заболеваниях головного мозга. Рекомендованный курс лечения – не менее шести недель. Препарат выпускается в двух формах – инъекционной в ампулах и пероральной в виде раствора с ароматом банана. Наличие пероральной формы выпуска расширяет возможности назначения препарата Цересил Канон и способствует повышению приверженности больных лечению.
Эффективность и безопасность препарата Цересил Канон оценивали в наблюдательном исследовании с участием пациентов с постинсультными когнитивными нарушениями. В исследование были включены 33 пациента, перенесших первичный полушарный ишемический инсульт. Медиана возраста больных составила 67,0 года. У всех пациентов имела место легкая степень тяжести инсульта по Шкале инсульта Национального института здоровья (NIHSS – National Institutes of Health Stroke Scale). Диагноз устанавливали на основании результатов исследований (компьютерная томография (КТ), МРТ) головного мозга13.
Больным назначали препарат Цересил Канон 1000 мг/сут перорально. Общий курс лечения составил три месяца. Дизайн исследования подразумевал три визита: первый – до лечения, второй – через две недели после начала лечения, третий – через три месяца от начала терапии.
При использовании препарата Цересил Канон улучшение когнитивных функций по Монреальской шкале оценки когнитивных функций (MoCA – Montreal Cognitive Assessment) отмечалось почти у 84,8% пациентов. Полное восстановление когнитивных функций через три месяца терапии зарегистрировано в 39,4% случаев. Кроме того, после лечения цитиколином количество пациентов с дементными расстройствами снизилось на 43% (рис. 3).
Схожие результаты были получены при оценке по Краткой шкале оценки психического статуса (MMSE – Mini-Mental State Examination). На фоне приема цитиколина (Цересил Канон) увеличение баллов по шкале MMSE зарегистрировано у 87,9% пациентов. У четырех (12,1%) больных когнитивные функции сохранились на прежнем уровне, отрицательной динамики не зафиксировано. Из 19 пациентов, изначально имевших умеренное когнитивное нарушение, у десяти наблюдалось полное восстановление когнитивных функций по шкале MMSE (рис. 4).
В качестве дополнительного положительного эффекта терапии отмечалась значимая положительная динамика эмоциональных нарушений на фоне терапии препаратом Цересил Канон. У 77,8% пациентов с депрессией зафиксировано улучшение в виде снижения балла по Госпитальной шкале тревоги и депрессии (HADS – Hospital Anxiety and Depression Scale). Безусловно, регресс аффективных нарушений способствовал лучшему восстановлению пациентов и более активному включению в повседневную активность и реабилитационный процесс.
На фоне терапии цитиколином имела место выраженная положительная динамика такого показателя, как субъективная оценка пациентом общего самочувствия. После прохождения полного курса лечения препаратом Цересил Канон 81,8% пациентов назвали терапию эффективной. При этом 66,7% больных отметили преимущество перорального приема раствора перед внутривенным или внутримышечным введением. Использование пероральных форм препаратов в условиях пандемии приобретает особую актуальность, поскольку у пациентов пожилого возраста возникают сложности с посещением медицинских учреждений.
Еще одним препаратом, который может быть рекомендован для коррекции когнитивных нарушений, является холина альфосцерат (Холитилин). Холин – предшественник ацетилхолина, незаменимое вещество, практически не синтезирующееся в организме. Его дефицит стремительно развивается при избыточном потреблении в состоянии гипоксиишемии. Холина альфосцерат свободно проходит через ГЭБ. Препарат оказывает дозозависимое стимулирующее действие в отношении выделения из пресинаптической щели нейромедиатора ацетилхолина, демонстрируя фармакологический эффект центрального холиномиметика. Он влияет на холинергическую нейротрансмиссию, как донатор ацетилхолина восстанавливает связи между нейронами, оказывает побуждающий эффект – повышает уровень сознания, оказывает стимулирующее действие.
Эффективность холина альфосцерата у пациентов после острых церебральных катастроф доказана в ряде исследований.
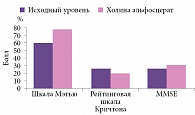
Применение холина альфосцерата у больных с неврологическим дефицитом после острых нарушений мозгового кровообращения и транзиторных ишемических атак ассоциируется с выраженным регрессом неврологического дефицита, достоверным уменьшением функционального ограничения повседневной деятельности, улучшением когнитивных функций (рис. 5). Переносимость препарата хорошая14.
Таким образом, Холитилин (холина альфосцерат) содействует повышению продукции ацетилхолина, стимулирует выделение ацетилхолина из терминалей в ответ на введение препарата. Цересил Канон (цитиколин) способствует прямой репарации нейрональных мембран, уменьшает дегенерацию свободных жирных кислот, улучшает межнейрональную проводимость. Холина альфосцерат и цитиколин не только оказывают нейропротективное действие, но и обладают взаимодополняющим эффектом. Препараты Холитилин и Цересил Канон целесообразно назначать пациентам, перенесшим инсульт, для восстановления когнитивных функций.
Когнитивные нарушения у пациентов с болезнью малых сосудов
Профессор кафедры неврологии, нейрохирургии и медицинской генетики лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н. Павел Рудольфович КАМЧАТНОВ в начале своего выступления отметил, что определение «болезнь малых сосудов» достаточно условно. Это обобщающий термин для обозначения различных патологических состояний и механизмов, которые приводят к поражению мелких сосудов вещества головного мозга. Нельзя говорить о болезни малых сосудов как о нозологической общности. Болезнь малых сосудов обусловлена поражением артерий малого калибра, артериол, капилляров, венул независимо от нозологической принадлежности.
Выраженность симптоматики при болезнях малых сосудов может быть незначительной и сложна для прижизненной диагностики. Возможна оценка ее морфологических последствий (по данным МРТ) в виде малых инфарктов, расширения периваскулярных пространств, микрокровоизлияний, гиперинтенсивности белого вещества, атрофии мозгового вещества.
К настоящему моменту разработаны схемы и стандарты диагностики болезни малых сосудов с помощью нейровизуализации. Такие методы позволяют обнаруживать острые малые лакунарные инфаркты, постинфарктные лакуны, оценивать выраженность гиперинтенсивности белого вещества, расширение периваскулярных пространств и выявлять церебральные микрокровоизлияния.
Проявления болезни малых сосудов разнообразны и могут сочетаться друг с другом. Встречается симметричное расширение периваскулярных пространств, которые нередко достигают объемов настоящих криблюр. В ряде случаев лакунарные инфаркты сочетаются с явлениями гиперинтенсивности белого вещества. При этом наблюдается и наружная, и внутренняя атрофия. Связать такой выраженный диффузный атрофический процесс исключительно с цереброваскулярной патологией сложно. Скорее всего в подобных ситуациях включаются механизмы, которые инициируются ишемическим поражением.
Один из наиболее частых вариантов поражения головного мозга при болезни малых сосудов – лакунарные инфаркты, которые определяются как мелкие глубокие инфаркты головного мозга, локализующиеся в базальных ганглиях, таламусе, мосте или белом веществе полушарий головного мозга. Существуют различные варианты трансформации очага ишемического некроза. В ряде случаев наблюдаются полный регресс и полная компенсация функционально-морфологического очага. Накопление очагов может быть одной из причин формирования гиперинтенсивности белого вещества. Не исключено и формирование кисты или, точнее, псевдокисты, поскольку она не имеет мембраны, способной продуцировать новую цереброспинальную жидкость с повышением давления. Возможна связь с клиническим течением инфаркта. Увидеть полную картину лакунарного инфаркта можно при использовании различных модальностей МРТ15.
Исследователи обнаружили, что при отсутствии острых эпизодов церебральной ишемии или острых геморрагических нарушений мозгового кровообращения имеет место абсолютно четкое нарастание как внутренней, так и наружной гидроцефалии. Выявлена прогрессирующая атрофия мозгового вещества в отсутствие инфарктов мозга16. В связи с этим возникает вопрос о наличии промежуточных, сочетанных форм дегенерации мозгового вещества, которые обусловлены как истинным дегенеративным процессом, так и сосудистым поражением головного мозга. Причем на разных этапах развития заболевания могут преобладать сосудистые или дегенеративные факторы.
Способность мозга ответить на ишемическое поражение дегенерацией или, наоборот, усилением репаративного потенциала во многом связана с генетическими особенностями индивидуума. Доказано, что полиморфизм ряда генов связан с определенной степенью риска развития и прогрессирования нейродегенеративного процесса в веществе головного мозга17.
Как уже отмечалось, нарушение ГЭБ – один из компонентов формирования хронического поражения головного мозга. По данным исследований, проницаемость ГЭБ в зонах гиперинтенсивности белого вещества повышается. Получается, что гиперинтенсивность не просто отражение патологии белого вещества, но показатель изменения его функциональных свойств, в частности утраты барьерных свойств18.
В настоящее время известен механизм повреждения ГЭБ в условиях ишемического повреждения головного мозга. Неактивная резидентная матриксная металлопротеиназа (ММР) активируется тримолекулярным комплексом, связанной с мембраной ММР и ингибитором ММР в присутствии фурина. При этом разрушается базальная пластина, открывая ворота для прохождения не только молекул, но и клеток, в частности при диабетической энцефалопатии.
Существует множество механизмов повреждения головного мозга. Безусловно, ишемическое поражение неразрывно связано с метаболическими и иммунными нарушениями. Это фоновые заболевания, которые инициируют каскад повреждений мозгового вещества, снижение церебральной перфузии. Ряд механизмов характеризуются как повреждающим, так и стимулирующим репарацию действием. При этом интенсивность таких процессов в разных отделах мозга может отличаться.
Системный воспалительный процесс, такой как CОVID-19, способен модифицировать течение указанных процессов в головном мозге. По словам докладчика, сегодня активно изучаются вопросы формирования механизмов поражения нервной системы при коронавирусной инфекции. Наблюдений, которые подтверждали бы повреждение мозговой ткани вирусом SARS-CoV-2, крайне мало. Расстройства гемодинамики и микроциркуляции в мозге и других органах скорее всего обусловлены не самим возбудителем, а тяжестью органных поражений, которые он вызывает. В связи с этим интерес представляют результаты исследования, опубликованные в текущем году. Ученые обнаружили скопления мегакариоцитов – клеток крови, отвечающих за производство тромбоцитов, в капиллярах мозга пациентов, умерших от COVID-19. Скопление мегакариоцитов нехарактерно для других цереброваскулярных расстройств. При COVID-19 они выявляются не только в мозге, но и других органах19. Как известно, наличие мегакариоцитов способно индуцировать ишемическое повреждение и усугубить течение ишемии мозга.
Среди наиболее распространенных неврологических проявлений COVID-19 – аффективные/когнитивные нарушения. Они обусловлены реакцией на перенесенное тяжелое соматическое заболевание, исходным состоянием пациента, изменением характера социального функционирования, поведения, общения.
Астенические расстройства наряду с нарушением слуха и поражением органов дыхания доминируют в клинической картине у пациентов, перенесших коронавирусную инфекцию.
Кроме того, когнитивные нарушения значительно осложняют течение коронавирусной инфекции и в ряде случаев приводят к госпитализации пожилых пациентов даже с умеренной патологией органов дыхания20.
По данным метаанализа, у больных COVID-19 широко распространены депрессивные и тревожные расстройства. К слову сказать, женщины в отношении тревоги и депрессии более уязвимы, чем представители мужского пола21.
В другом исследовании убедительно продемонстрировано влияние COVID-19 на развитие и течение умеренных когнитивных расстройств. Ученые установили 20-кратное увеличение числа случаев прогрессирования предшествующих когнитивных нарушений на фоне коронавирусной инфекции22.
Конкретный механизм развития когнитивного дефицита на фоне COVID-19 пока неизвестен. Только накопление клинических данных и дальнейшие исследования в этой области смогут ответить на поставленный вопрос, позволят определить механизмы, приводящие к когнитивным нарушениям на фоне коронавирусной инфекции. После этого можно будет говорить об аргументированных методах контроля состояния, которые будут работать в условиях реальной практики. Сегодня лечение когнитивных нарушений у пациентов с коронавирусной инфекцией назначается эмпирически, на основании результатов исследования, полученных при наблюдении за другими группами пациентов.
В период пандемии основными направлениями лечения пациентов с когнитивными нарушениями остаются возмещение дефицита холинергической и ГАМКергической нейротрансмиссии, применение нейротрофической и симптоматической терапии.
Одним из препаратов, воздействующих на патогенетические звенья повреждения головного мозга в условиях коронавирусной инфекции, является холина альфосцерат (Холитилин). Холитилин не только устраняет дефицит ацетилхолина, но и оказывает мощное воздействие на мембрану нейронов и глиальных клеток. Доказано, что так называемое старение глиальных клеток – один из путей старения головного мозга.
Таким образом, Холитилин усиливает церебральные метаболические процессы, оказывает нейропротективное действие. Эффективность Холитилина в лечении ХИГМ и коррекции когнитивных расстройств доказана в многочисленных исследованиях. На фоне трехмесячной терапии холина альфосцератом у пациентов снижались неврологическая симптоматика, выраженность когнитивных нарушений, проявления тревоги и депрессии. Исследователи подчеркивают, что для достижения продолжительного эффекта терапия должна быть более длительной. Для коррекции умеренных когнитивных расстройств Холитилин применяют в стандартной суточной дозе 1200 мг в три приема. Его можно назначать пациентам (в том числе пожилого возраста), перенесшим коронавирусную инфекцию.
Мемантин (Мемантин Канон) – препарат с доказанной эффективностью при мягких и умеренно тяжелых когнитивных нарушениях и деменции, имеет высочайший уровень доказательности. Его отличает хорошая переносимость и безопасность23.
Мемантин Канон можно рекомендовать в комплексной терапии деменции смешанного типа пациентам после перенесенной коронавирусной инфекции.
На фоне применения мемантина значительно улучшаются когнитивные функции, мышление, двигательные функции, социальное поведение, повышается повседневная активность пациентов с деменцией разной степени выраженности. Кроме того, показана эффективность долговременного лечения мемантином24.
Одним из преимуществ препарата Мемантин Канон является удобство применения. Препарат выпускается в виде таблеток в дозах 10 и 20 мг, а также в виде наборов с разной дозой: 5, 10, 15 и 20 мг (по семь таблеток каждой дозы), что позволяет подбирать индивидуальную дозу с помощью титрования.
В заключение эксперт подчеркнул целесообразность включения в состав комбинированной мультимодальной терапии пациентов с деменцией препарата Мемантин Канон, который способствует замедлению прогрессирования дементных или преддементных нарушений и улучшает качество жизни больных.
Диабетическая полиневропатия: спектр автономных нарушений
Симпозиум продолжил доцент кафедры нервных болезней Первого МГМУ им. И.М. Сеченова, к.м.н. Игорь Алексеевич СТРОКОВ сообщением об автономных нарушениях нервной системы при диабетической полиневропатии (ДПН). Он отметил, что поражение периферических нервов является частым осложнением сахарного диабета (СД). Число больных СД в мире продолжает стремительно увеличиваться. Согласно результатам эпидемиологических исследований, в России с 2003 до 2016 г. количество больных СД возросло на 2,3 млн человек. В конце 2016 г. насчитывалось 4 348 422 заболевших (3% населения РФ)25.
Одним из наиболее распространенных неврологических осложнений СД является ДПН. При ДПН могут поражаться соматические (двигательные и чувствительные), а также автономные нервные волокна.
P. Dyck и соавт. выделяют три формы течения ДПН: легкую, среднетяжелую и тяжелую и три стадии заболевания. Субклиническая стадия (N1) определяется только по данным электрофизиологического обследования. Симптомная невропатия характеризуется позитивной невропатической симптоматикой и неврологическим дефицитом без мышечной слабости (N2а) или с мышечной слабостью (N2b). Стадия инвалидизации (N3) свидетельствует о нарушении трудоспособности и социальной адаптации26.
Симптомы ДПН оценивают по шкале TSS (Total Symptom Score – общая оценка симптомов). Она позволяет контролировать интенсивность и частоту позитивных невропатических проявлений (стреляющая боль, жжение, онемение и парестезии) в течение последних 24 часов.
Кроме того, диагностика ДПН включает оценку неврологического дефицита по NIS-LL (Neuropathy Impairment Score Low Limbs) – мышечной силы, рефлексов, чувствительности нижних конечностей.
Для объективного подтверждения ДПН используют электронейромиографию. С помощью этого метода тестируют функцию толстых миелинизированных волокон. Тонкие волокна этим методом не оцениваются.
Методом количественного сенсорного тестирования определяют пороги возбуждения тонких волокон, проводящих боль, и температуру. Для оценки автономной невропатии исследуют вариабельность сердечного ритма в покое и при глубоком дыхании.
Для диагностики кардиальной автономной невропатии применяют разные диагностические тесты, но основой диагностики является изучение вариабельности сердечного ритма в покое и при глубоком дыхании.
При СД в первую очередь страдают тонкие нервные волокна. Половина всех случаев невропатии тонких волокон приходится на пациентов с нарушением углеводного обмена и больных СД27.
Клиническая картина невропатии тонких волокон, помимо сенсорных проявлений и спонтанной боли, включает автономную симптоматику – тахикардию в покое, ортостатическую артериальную гипотонию, гастроинтестинальную и сексуальную дисфункцию, синдром сухих глаз и рта, гипогидроз. Данная симптоматика может уходить на второй план по отношению к боли или, наоборот, преобладать в клинической картине. Стандартной клинической картины невропатии тонких волокон не существует, она меняется в зависимости от начальных проявлений, спектра возникающих симптомов и скорости прогрессирования заболевания.
Автономная симптоматика при СД обусловлена поражением как симпатической, так и парасимпатической системы. Внутренние органы и множество различных структур имеют автономную иннервацию, что и определяет широкий спектр клинических нарушений при автономной невропатии: отсутствие миотической реакции зрачка на свет с сохранением миотической реакции на ближайший стимул (синдром Аргайла Робертсона), нарушение реакции зрачка при затемнении, бессимптомная гипогликемия и др. Как правило, больной ощущает гипогликемию. Но при патологии автономных нервных волокон он утрачивает эту способность. Подобное состояние опасно развитием гипогликемической комы.
Клиника автономной невропатии включает также сердечно-сосудистые нарушения. Наиболее типичное и раннее из них – тахикардия в покое. Кроме того, встречаются нарушения толерантности к физическим нагрузкам, «денервация» сердца, ортостатическая гипотензия, непереносимость тепловых нагрузок, инверсия циркадной ритмики АД.
Среди нейроваскулярных нарушений, характерных для автономной невропатии, – ангидроз, синдром сухого рта, гипергидроз, пищевое потоотделение.
При автономной невропатии наблюдаются желудочно-кишечные нарушения: дисфункция пищевода, гастропарез, запор, диарея, слабость сфинктеров. Автономная невропатия сопровождается урогенитальными нарушениями, такими как эректильная дисфункция, ретроградная эякуляция, цистопатия, неврогенный мочевой пузырь, сухость влагалища.
Автономные нарушения у больных ДПН возникают на ранних этапах заболевания. Уже на стадии субклинической невропатии в отсутствие проявлений соматической невропатии обнаруживаются автономные нарушения. На третьей стадии ДПН более чем у 80% больных отмечаются автономные нарушения, и они часто доминируют в клинической картине28.
В основе патогенеза диабетической невропатии лежит прогрессирующая гибель нервных волокон. Метаболические нарушения, окислительный стресс, нарушения митохондриальной ДНК, активация различных полимераз – механизмы, определяющие клеточную гибель. Другой патогенетический механизм развития диабетической невропатии связан с сосудистыми нарушениями. По мере развития патологии сосудов в периферических нервных структурах возникают гипоксия и ишемия. Важно, что компенсация СД 2-го типа – достижение нормогликемии – не уменьшает риск развития автономной невропатии.
Наиболее перспективным и широко применяемым средством при ДПН является альфа-липоевая кислота (АЛК). Препараты альфа-липоевой (тиоктовой) кислоты выпускаются как отечественными, так и зарубежными производителями.
В настоящее время на российском фармацевтическом рынке представлен отечественный препарат АЛК – Тиолепта. При сравнительном анализе с препаратами АЛК немецких производителей препарат Тиолепта продемонстрировал идентичную максимальную концентрацию, биодоступность и скорость абсорбции.
Альфа-липоевая кислота – мощный естественный липофильный антиоксидант. АЛК уменьшает окислительный стресс, улучшает эндоневральный кровоток, усиливает энергетический метаболизм, аксональный транспорт, стимулирует синтез фактора роста нервов, а также увеличивает активность транспорта глюкозы в клетку.
Результаты немецкого исследования ALADIN29 – первого рандомизированного двойного слепого плацебоконтролируемого исследования эффективности АЛК при ДПН продемонстрировали, что на фоне внутривенного введения 600 мг АЛК один раз в день в течение трех недель больным СД существенно уменьшается выраженность симптомов периферической невропатии. При этом значительные нежелательные реакции отсутствуют. Показана дозозависимая эффективность АЛК, причем доза 600 мг признана оптимальной.
В 1999 г. были опубликованы первые российские данные об эффективности АЛК при ДПН. В рандомизированном клиническом исследовании АЛК (внутривенное введение) продемонстрировала эффективность в снижении невропатической симптоматики и неврологического дефицита у больных ДПН30.
Метаанализ четырех исследований показал, что при ДПН внутривенное введение АЛК в течение трех недель способствует значительному улучшению балла по шкале TSS по сравнению с плацебо31.
В ряде исследований анализировали целесообразность назначения таблетированной формы препаратов АЛК пациентам с ДПН. Так, в исследовании ORPIL сравнивали эффективность трехнедельного применения пероральной формы АЛК у больных СД 2-го типа с ДПН и плацебо. Показано достоверное снижение балла по шкале TSS в группе больных, получавших АЛК в таблетках32.
Результаты исследования SYDNEY II также подтвердили эффективность трехнедельного применения АЛК в форме таблеток у больных СД 1-го и 2-го типов с ДПН в уменьшении невропатической симптоматики33.
Как внутривенное, так и пероральное введение АЛК значительно уменьшает симптомы невропатии и неврологический дефицит. Подтверждение тому – метаанализ с участием 1258 пациентов с ДПН34.
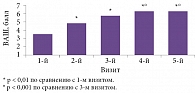
В российском исследовании «ЭТИКА» оценивали клиническую эффективность и безопасность препарата Тиолепта при дистальной симметричной сенсорно-моторной ДПН. В исследовании участвовали 93 врача из 12 городов России и 205 больных СД 1-го и 2-го типов. Основным показателем выраженности симптомов при ДПН служила оценка по шкале TSS. Для оценки выраженности неврологического дефицита применяли шкалу NIS-LL. Пациенты в течение четырех недель получали препарат Тиолепта 600 мг ежедневно утром. Уже после месяца приема препарата отмечалось уменьшение невропатической симптоматики по шкалам TSS и NIS-LL. Причем эффект от проведенного лечения сохранялся на протяжении трех месяцев (рис. 6 и 7)35.
Интерес представляют работы, посвященные оценке эффективности АЛК при кардиальной автономной невропатии. В четырехмесячном двойном слепом плацебоконтролируемом исследовании АЛК имела преимущество перед плацебо в отношении влияния на вариабельность сердечного ритма у пациентов с кардиальной автономной невропатией36.
Результаты отечественного исследования подтверждают эффективность АЛК при диабетической автономной невропатии. Так, на фоне терапии АЛК уменьшается окислительный стресс, снижается вариабельность сердечного ритма, улучшаются показатели мочеиспускания37.
Завершая выступление, профессор И.А. Строков подчеркнул, что применение патогенетической терапии при ДПН уменьшает не только симптоматику, связанную с поражением соматических нервных волокон, но и выраженность симптомов автономной невропатии.
Заключение
В неврологической практике широко используются препараты для симптоматической и патогенетической терапии. Сегодня на фармацевтическом рынке представлена линейка лекарственных препаратов с доказанной эффективностью, отвечающих современным стандартам качества, российской компании «Канонфарма продакшн».
При невропатии различного генеза применяют МексиВ 6 – антиоксидантный препарат, регулирующий метаболические процессы в миокарде и сосудистой стенке. Механизм действия препарата обусловлен антиоксидантным и мембранопротективным свойствами его компонентов – ЭМГПС, пиридоксина и магния лактата. МексиВ 6 подавляет перекисное окисление липидов, повышает активность супероксидазы, влияет на физико-химические свойства мембраны. На фоне приема препарата улучшаются метаболизм и кровоснабжение головного мозга, микроциркуляция и реологические свойства крови, уменьшается агрегация тромбоцитов у пациентов с неврологическими нарушениями (дисциркуляторная энцефалопатия, синдром вегетативной дистонии, тревожные состояния при невротических и неврозоподобных состояниях, абстинентный синдром при алкоголизме с преобладанием неврозоподобных и вегетативно-сосудистых расстройств, ишемическая болезнь сердца, состояния после острой интоксикации антипсихотическими средствами, астенические состояния и др.).
В состав препарата Винпотропил входит фиксированная комбинация препаратов винпоцетина и пирацетама. Они являются одними из самых назначаемых в группах вазоактивных и ноотропных препаратов. Данные исследований и опыт практического применения Винпотропила свидетельствуют о его высокой эффективности в уменьшении неврологических симптомов, в частности когнитивных расстройств. На фоне применения комбинированного препарата Винпотропил отмечаются увеличение активности когнитивных процессов, улучшение общего самочувствия и качества жизни пациентов. Препарат показан для симптоматической терапии интеллектуально-мнестических нарушений, последствий ишемического инсульта, сосудистой вертебробазилярной недостаточности, сосудистой деменции, атеросклероза сосудов головного мозга, посттравматической гипертонической энцефалопатии. Винпотропил обладает выраженным эффектом в отношении симптомов начальных проявлений когнитивных нарушений у больных пожилого и старческого возраста.
Пациентам с деменцией умеренной и тяжелой степени назначают препарат Мемантин Канон. В его состав входит мемантин, который блокирует эффекты глутамата и в патологически повышенной концентрации приводит к дисфункции нейронов. В ряде исследований доказана эффективность Мемантина Канон при различных органических заболеваниях нервной системы, сопровождающихся когнитивными нарушениями.
Ноотропный препарат Цересил Канон (цитиколин) характеризуется широким спектром действия. Он способствует восстановлению поврежденных мембран клеток, ингибирует действие фосфолипаз, препятствует избыточному образованию свободных радикалов, а также предотвращает гибель клеток, воздействуя на механизмы апоптоза. Цересил Канон зарекомендовал себя как эффективное средство в составе комплексной терапии в остром периоде ишемического инсульта, восстановительном периоде ишемического и геморрагического инсультов, при черепно-мозговой травме, когнитивных и поведенческих нарушениях при дегенеративных и сосудистых заболеваниях головного мозга.
Не менее эффективным ноотропным препаратом признан Холитилин (холина альфосцерата гидрат). Препарат обеспечивает синтез ацетилхолина и фосфатидилхолина в нейрональных мембранах, улучшает кровоток и усиливает метаболические процессы в нервной системе. Холитилин способствует нормализации активности мозга, регрессу очаговых неврологических симптомов, положительно влияет на познавательные и поведенческие реакции пациентов с сосудистыми заболеваниями головного мозга. Показан при черепно-мозговой травме с преимущественно стволовым уровнем поражения в остром периоде, цереброваскулярной недостаточности, психоорганическом синдроме на фоне дегенеративных заболеваний и инволюционных процессов головного мозга, а также мультиинфарктной деменции.
При тяжелом неврологическом осложнении СД диабетической полиневропатии применяют антиоксидантную терапию. Тиолепта – препарат альфа-липоевой кислоты, который способствует уменьшению позитивной и негативной невропатической симптоматики у пациентов с ДПН, снижает выраженность болевого синдрома. Препарат хорошо переносится и характеризуется благоприятным профилем безопасности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.