количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Практические аспекты таргетной терапии метастатического почечно-клеточного рака
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
В клинических исследованиях доказаны эффективность и управляемый профиль безопасности препаратов для лечения метастатического рака почки. Эффективность таргетной терапии должна оцениваться по стандартным критериям.
При отсутствии эффекта или развитии резистентности к препарату в процессе лечения необходима смена таргетного препарата. Возможные осложнения лечения требуют своевременной и адекватной коррекции.
Метастатический рак почки продолжает оставаться серьезной проблемой онкоурологии. Достижения молекулярной биологии позволили изучить основные патогенетические пути развития почечно-клеточного рака, что способствовало созданию новых таргетных препаратов – ингибиторов тирозинкиназы.
В клинических исследованиях доказаны эффективность и управляемый профиль безопасности препаратов для лечения метастатического рака почки. Эффективность таргетной терапии должна оцениваться по стандартным критериям.
При отсутствии эффекта или развитии резистентности к препарату в процессе лечения необходима смена таргетного препарата. Возможные осложнения лечения требуют своевременной и адекватной коррекции.
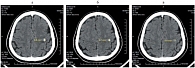
Рис. 1. Метастаз левой теменной области головного мозга: а – до лечения; б – через 2 месяца; в – через 4–12 месяцев лечения
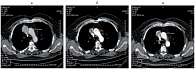
Рис. 2. Метастаз средостения: а – до лечения; б – через 2 месяца; в – через 4–12 месяцев лечения
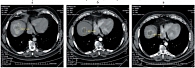
Рис. 3. Метастаз печени: а – до лечения; б – через 2 месяца; в – через 4–12 месяцев лечения
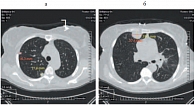
Таблица 1. Осложнения таргетной терапии рака почки
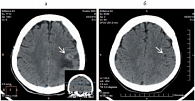
Рис. 4. Метастазы легких до лечения: а – левое легкое; б – правое легкое
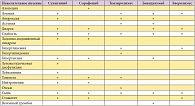
Рис. 5. Метастаз левой теменной области головного мозга: а – до лечения; б – через 2–12 месяцев лечения
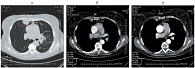
Рис. 6. Метастаз правого легкого: а – до лечения; б – через 2 месяца; в – через 4–12 месяцев лечения
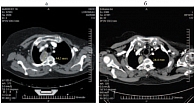
Рис. 7. Метастаз верхнего средостения: а – до лечения; б – через 36 месяцев лечения
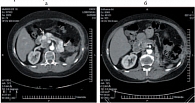
Рис. 8. Метастазы поджелудочной железы: а – до лечения; б – через 36 месяцев лечения метастазы не определяются
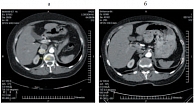
Рис. 9. Метастаз правого надпочечника: а – до лечения; б – через 36 месяцев лечения метастаз не определяется
Существует несколько гистологических типов рака почки: наиболее частым является светлоклеточный рак (80–85%), из несветлоклеточных форм наиболее часто встречаются хромофобный и папиллярный типы.
У 28–30% больных при первичной диагностике опухоли выявляются метастазы – вторичные опухолевые очаги в органах и мягких тканях, которые по своему строению соответствуют первичной опухоли в почке и свидетельствуют о распространении болезни. Метастазирование происходит несколькими путями: гематогенным (с током крови по кровеносным сосудам), лимфогенным (по лимфатическим сосудам), а также имплантационным (с полостной жидкостью по ходу серозных полостей – брюшной и грудной). В 95% случаев обнаруживаются множественные метастазы, когда поражено несколько органов. Не более 23% пациентов с метастазами живут дольше 5 лет. У 30–35% больных, у которых на момент удаления опухоли почки не были обнаружены метастазы, они могут появиться в течение трех лет после операции [5, 6]. Единственным радикальным методом лечения рака почки на сегодняшний день является хирургическое удаление опухолевой массы из организма. Однако при множественных метастазах оперативное вмешательство нецелесообразно. Какие же существуют нехирургические способы лечения больных раком почки?
Многолетние исследования показали, что рак почки и его метастазы практически нечувствительны к лучевой и химиотерапии. Не было получено эффекта и от гормональной терапии. Несколько десятилетий (до появления таргетной терапии) основным способом противоопухолевой терапии рака почки была иммунотерапия. Иммунотерапия стимулирует противоопухолевый иммунитет – систему защитных иммунных клеток, которые распознают и убивают опухолевые клетки. Для иммунотерапии рака почки применяли интерферон-α (INF-α) и интерлейкин-2 (IL-2). На сегодняшний день иммунотерапию рекомендуется использовать у отдельных пациентов с хорошим прогнозом жизни. Распределение больных раком почки по прогностическим группам производится на основании модели, разработанной в Мемориальном онкологическом центре Слоуна и Кеттеринга – MSKCC (Memorial Sloan-Kettering Cancer Center) [5]. Выделяют несколько факторов прогноза, негативно влияющих на продолжительность жизни:
- высокий уровень лактатдегидрогеназы крови (превышающий в 1,5 раза верхнюю границу нормы);
- высокий уровень кальция крови (> 10 мг/дл, или 2,5 ммоль/л);
- анемия;
- время с момента постановки диагноза до появления метастазов менее года;
- плохой клинический статус пациента, связанный с опухолевым заболеванием и сопутствующей патологией.
Сегодня приоритетным лечением метастатического рака почки, доказавшим свою эффективность в серьезных международных клинических исследованиях, является таргетная терапия (от англ. target – «мишень»). Первый таргетный препарат для лечения метастатического рака почки был зарегистрирован в США в 2005 г., а в России – в 2007 г.
Для роста опухоли, как и любой ткани, необходимо питание, которое поступает из крови, распространяющейся в опухоли по кровеносным сосудам. Опухолевая клетка вырабатывает специальные ростовые сосудистые факторы, стимулирующие ангиогенез. Ингибиторы ангиогенеза связываются с опухолевыми факторами-мишенями роста сосудов, блокируют их, тем самым останавливая рост сосудов. Опухоль, не получающая питания, не может метастазировать, погибает или не развивается. Другой мишенью таргетных препаратов является фактор деления опухолевых клеток, воздействие на который приводит к снижению или прекращению наращивания опухолевой клеточной массы. Оценка эффективности противо-опухолевой терапии проводится на основе комплекса международных правил, включающих в себя определенные критерии эффективности (RECIST 1.1) [8].
Согласно этим критериям результат лечения можно определить следующим образом: «частичный или полный ответ» на лечение (улучшение), «стабилизация болезни» (болезнь без изменений), «прогрессирование» (ухудшение). Основным показателем результата лечения является изменение размеров опухолевых очагов и их суммарного размера, определяемых по данным компьютерной или магнитно-резонансной томографии. Уменьшение очагов более чем на 30% («частичный ответ» на лечение), отсутствие значимого роста очагов («стабилизация болезни») определяют клиническую эффективность терапии, которой удается достичь у 80–85% пациентов. Увеличение очагов более чем на 20% в сравнении с наименьшим размером, достигнутым в результате лечения, или появление новых метастазов («прогрессия») свидетельствуют о неэффективности лечения, это может произойти как в самом начале лечения, так и в процессе терапии.
Прогрессирование болезни указывает на развитие резистентности к данному противоопухолевому препарату. К сожалению, предсказать длительность положительного клинического ответа на таргетную терапию метастатического почечно-клеточного рака у каждого конкретного больного на сегодняшний день невозможно [4, 5]. Несмотря на высокую эффективность таргетных препаратов по сравнению с иммунотерапией, полное излечение (исчезновение метастазов) встречается редко. Сохранение метастатических очагов в разные сроки приведет к развитию резистентности опухолевой ткани к данному препарату и неэффективности терапии. Следовательно, возникнет необходимость назначения других противоопухолевых препаратов (второй линии терапии) [9, 10].
Существующие стандарты лечения метастатических форм рака почки основаны на результатах преимущественно многоцентровых доказательных исследований, в которых препараты, показавшие свою эффективность, отнесены к приоритетной линии терапии, препараты с более низким уровнем доказанной эффективности – к альтернативной линии терапии [7]. На сегодняшний день в нашей стране разрешены к применению в терапии рака почки несколько таргетных препаратов, которые воздействуют на различные мишени (звенья), участвующие в механизме формирования опухолевой клетки и самой опухоли. К таргетным препаратам первой линии, зарегистрированным в РФ, относятся:
- сунитиниб и сорафениб (Нексавар) – VEGF-блокаторы. Эффективность первого доказана у больных, не получавших ранее никакой терапии [11, 12], второго – у пациентов, получавших ранее иммунотерапию [13–15];
- темзиролимус – блокатор mTOR. Эффективность доказана у пациентов с неблагоприятным прогнозом и при несветлоклеточном раке [16, 17];
- бевацизумаб – атитело к VEGF. Эффективность бевацизумаба в сочетании с интерфероном доказана у больных, не получавших ранее лечения [18–20].
Осложнения таргетной терапии рака почки перечислены в сводной таблице 1. Для профилактики и лечения осложнений необходим постоянный контроль врача, имеющего опыт применения таргетной терапии у больных с раком почки. При осложнениях слабой степени выраженности коррекция, как правило, не требуется, так как многие осложнения отмечаются на начальных этапах лечения и носят временный характер. При более тяжелых осложнениях (III–IV степени) может потребоваться снижение дозы препарата или временная его отмена (до 4 недель) [24, 25]. Несмотря на достаточно большое количество и разнообразие осложнений таргетной терапии, прекращение лечения вследствие осложнений имело место только в 8–12% случаев [11–23].
В нашей клинике таргетная терапия VEGF-блокаторами была проведена 30 больным метастатическим раком почки. Оценка исходных данных и динамики опухолевого процесса проводится на основе критериев RECIST 1.1 по данным спиральной компьютерной или магнитно-резонансной томографии. У всех больных диагностировали множественные метастазы с поражением 2–3 органов. Метастазы легких отмечены у 57% больных, лимфоузлов – у 62%, печени – у 20%, поджелудочной железы – у 17%, костные метастазы – у 10%, единственной почки – у 10%, метастазы мозга – у 6%. 5 пациентов ранее перенесли от одной до трех операций удаления метастазов. Только у 2 больных (6,7%) не было ответа на таргетную терапию, в обоих случаях отмечалось массивное и множественное поражение органов метастазами. Ответ на лечение получен в 93,3% случаев. Стабилизация заболевания (отсутствие роста очагов) отмечена у 64% из них, у 28% произошло уменьшение очагов (частичная регрессия) и у 2 больных – полная регрессия очагов. Средняя длительность ответа на лечение (без прогрессирования заболевания) составляла 11 месяцев (от 4 до 38 месяцев).
В настоящее время 17 пациентов продолжают эффективную терапию со сроками лечения от 10 до 38 месяцев. Среди осложнений таргетной терапии отмечались: артериальная гипертензия, ладонно-подошвенный синдром, алопеция, снижение аппетита, тошнота, боли в животе, панкреатит, эрозивный гастрит, диарея, осиплость голоса. В большинстве случаев осложнения носили легкий характер, только в 2 случаях потребовалось временное снижение дозы, а в одном – временная отмена препарата. Прекращения лечения из-за осложнений не было. В качестве иллюстрации наших данных приводим некоторые примеры эффективной таргетной терапии.
Клинический случай 1
Больной Ф., 67 лет.
Анамнез заболевания: 30.08.2005 пациенту была выполнена радикальная нефрэктомия слева по поводу рака почки в стадии T3аN0M0 (светлоклеточный тип), G1.
Сопутствующие заболевания: ишемическая болезнь сердца, хроническая сердечная недостаточность IIA (ФК II). Гипертоническая болезнь II ст., риск II. Данные спиральной компьютерной томографии от 25.03.2010 (4 года 5 месяцев после операции):
На фоне таргетной терапии (Нексавар) в течение 12 месяцев наблюдалась редукция таргетных очагов 104 мм (30%), то есть получен частичный ответ на терапию. Больной продолжает лечение и наблюдение (до июня 2011 г.).
Клинический случай 2
Больная Б., 57 лет.
Анамнез заболевания: 19.11.2010 выполнена радикальная нефрэктомия слева по поводу почечно-клеточного рака (опухоль 204 × 145 × 132 мм) в стадии T3аN1M1 (светлоклеточный тип), G2. 16.12.2010 – экстирпация матки с левым придатком по поводу мультинодулярной лейомиомы и метастаза почечно-клеточного рака в левый яичник. Сопутствующие заболевания: варикозная болезнь обеих нижних конечностей ХВН II, гипертоническая болезнь II ст., риск II. Данные спиральной компьютерной томографии от 23.03.2010 (3,5 месяца после операции):
На фоне таргетной терапии (Нексавар) в течение 12 месяцев редукция таргетных очагов составила 124 мм (80%). Лечение и наблюдение продолжаются (до июня 2011 г.).
Клинический случай 3
Больная Л., 63 года.
Анамнез заболевания: в мае 1998 г. – радикальная нефрэктомия слева по поводу рака почки в стадии T3аNхM0 (светлоклеточный тип), G2.
В сентябре 2003 г. – нижняя лобэктомия справа по поводу метастаза рака почки в нижнюю долю левого легкого.
24.03.2007 – удаление рецидивной опухоли ложа левой почки. Данные спиральной компьютерной томографии от 26.04.2008:
Динамика изменения размеров таргетных очагов (36 месяцев терапии) верхнего средостения, поджелудочной железы, правого надпочечника показана на рисунках 7–9.
На фоне таргетной терапии в течение 36 месяцев наблюдалась редукция таргетных очагов 93 мм (44%). Лечение продолжается (до июня 2011 г.).
Таким образом, таргетная терапия является эффективным и малотоксичным лечением метастатического почечно-клеточного рака. Сочетание качественной хирургии и таргетной терапии определяет перспективы улучшения канцероспецифической выживаемости больных метастатическим почечно-клеточным раком.
Клинический случай 1
Больной Ф., 67 лет.
Анамнез заболевания: 30.08.2005 пациенту была выполнена радикальная нефрэктомия слева по поводу рака почки в стадии T3аN0M0 (светлоклеточный тип), G1.
Сопутствующие заболевания: ишемическая болезнь сердца, хроническая сердечная недостаточность IIA (ФК II). Гипертоническая болезнь II ст., риск II. Данные спиральной компьютерной томографии от 25.03.2010 (4 года 5 месяцев после операции):
- метастаз левой теменной области головного мозга;
- множественные метастазы легких;
- метастаз средостения;
- множественные метастазы печени;
- опухолевый очаг единственной правой почки;
- метастазы забрюшинных лимфоузлов;
- рецидивная опухоль в ложе удаленной левой почки.
На фоне таргетной терапии (Нексавар) в течение 12 месяцев наблюдалась редукция таргетных очагов 104 мм (30%), то есть получен частичный ответ на терапию. Больной продолжает лечение и наблюдение (до июня 2011 г.).
Клинический случай 2
Больная Б., 57 лет.
Анамнез заболевания: 19.11.2010 выполнена радикальная нефрэктомия слева по поводу почечно-клеточного рака (опухоль 204 × 145 × 132 мм) в стадии T3аN1M1 (светлоклеточный тип), G2. 16.12.2010 – экстирпация матки с левым придатком по поводу мультинодулярной лейомиомы и метастаза почечно-клеточного рака в левый яичник. Сопутствующие заболевания: варикозная болезнь обеих нижних конечностей ХВН II, гипертоническая болезнь II ст., риск II. Данные спиральной компьютерной томографии от 23.03.2010 (3,5 месяца после операции):
- метастаз левой теменной области головного мозга;
- множественные метастазы легких (рис. 4);
- рецидивная опухоль в ложе удаленной левой почки. Сумма таргетных очагов – 155 мм.
На фоне таргетной терапии (Нексавар) в течение 12 месяцев редукция таргетных очагов составила 124 мм (80%). Лечение и наблюдение продолжаются (до июня 2011 г.).
Клинический случай 3
Больная Л., 63 года.
Анамнез заболевания: в мае 1998 г. – радикальная нефрэктомия слева по поводу рака почки в стадии T3аNхM0 (светлоклеточный тип), G2.
В сентябре 2003 г. – нижняя лобэктомия справа по поводу метастаза рака почки в нижнюю долю левого легкого.
24.03.2007 – удаление рецидивной опухоли ложа левой почки. Данные спиральной компьютерной томографии от 26.04.2008:
- множественные метастазы легких;
- метастаз верхнего средостения;
- множественные метастазы поджелудочной железы;
- метастаз правого надпочечника;
- метастазы забрюшинных лимфоузлов.
Динамика изменения размеров таргетных очагов (36 месяцев терапии) верхнего средостения, поджелудочной железы, правого надпочечника показана на рисунках 7–9.
На фоне таргетной терапии в течение 36 месяцев наблюдалась редукция таргетных очагов 93 мм (44%). Лечение продолжается (до июня 2011 г.).
Таким образом, таргетная терапия является эффективным и малотоксичным лечением метастатического почечно-клеточного рака. Сочетание качественной хирургии и таргетной терапии определяет перспективы улучшения канцероспецифической выживаемости больных метастатическим почечно-клеточным раком.
1. Gupta K., Miller J.D., Li J.Z. et al. Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): a literature review // Cancer Treat. Rev. 2008. Vol. 34. P. 193–205.
2. Jemal A., Siegel R., Ward E. et al. Cancer statistics 2009 // CA Cancer J. Clin. 2009. Vol. 59. P. 225–249.
3. Ferlay J., Autier P., Boniol M. et al. Estimates of the cancer incidence and mortality in Europe in 2006 // Ann. Oncol. 2007. Vol. 18. P. 581–592.
4. Алексеев Б.Я., Калпинский А.С. Применение таргетных препаратов в лечении метастатического рака почки: последовательное назначение или комбинация // Онкоурология. 2010. № 4. С. 16–22.
5. Motzer R.J., Bacik J., Schwartz L.H. et al. Prognostic factors for survival in previously treated patients with metastatic renal cell carcinoma // Clin. Oncol. 2004. Vol. 22. P. 454–463.
6. Leibovich B.C., Blute M.L., Cheville J.C. et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials // Cancer. 2003. Vol. 97. P. 1663–1671.
7. National Comprehensive Cancer Network. NCCN Clinical practice guidelines in oncology: kidney cancer. 2010. URL:http://www.nccn.org/professionals/physician_gls/PDF/kidney.pdf. Accessed February 2010.
8. Eisenhauer E.A., Therasse P., Bogaerts J. et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) // European Journal of Cancer. 2009. Vol. 45. P. 228–247.
9. Motzer R.J., Bukowski R.M. Targeted therapy for metastatic renal cell carcinoma // Clin. Oncol. 2006. Vol. 24. P. 5601–5608.
10. Porta C., Szczylik C. Tolerability of first-line therapy for metastatic renal cell carcinoma // Cancer. Treat. Rev. 2009. Vol. 35. P. 297–307.
11. Motzer R.J., Rini B.I., Bukowski R.M. et al. Sunitinib in patients with metastatic renal cell carcinoma // JAMA. 2006. Vol. 295. P. 2516–2524.
12. Motzer R.J., Hutson T.E., Tomczak P. et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma // Clin. Oncol. 2009. Vol. 27. P. 3584–3590.
13. Ratain M.G., Eisen T., Stadler W.M. et al. Phase II placebo-controlled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma // Clin. Oncol. 2006. Vol. 24. P. 2505–2512.
14. Escudier B., Eisen T., Stadler W.M. et al. Sorafenib in advanced clear-cell renal-cell carcinoma // N. Engl. J. Med. 2007. Vol. 356. P. 125–134.
15. Escudier B., Eisen T., Stadler W.M. et al. Sorafenib for treatment of renal cell carcinoma: final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial // Clin. Oncol. 2009. Vol. 27. P. 3312–3318.
16. Rini B.I. Temsirolomus, an inhibitor of mammalian target of rapamycin // Clin. Cancer. Res. 2008. Vol. 14. P. 1286–1290.
17. Hudes G., Carducci M., Tomczak P. et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma // N. Engl. J. Med. 2007. Vol. 356. P. 2271–2281.
18. Yang J.C., Haworth L., Sherry R.M. et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer // N. Engl. J. Med. 2003. Vol. 349. P. 427–434.
19. Rini B.I., Halabi S., Taylor J. et al. Cancer and Leukemia Group B 90206: a randomized phase III trial of interferon-alpha or interferon-alpha plus anti-vascular endothelial growth factor antibody (bevacizumab) in metastatic renal cell carcinoma // Clin. Cancer Res. 2004. Vol. 10. P. 2584–2586.
20. Escudier B., Pluzanska A., Koralewski P. et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial // Lancet. 2007. Vol. 370. P. 2103–2111.
21. Алексеев Б.Я., Калпинский А.С. Эверолимус в лечении метастатического рака почки // Онкоурология. № 3. 2010. С. 19–24.
22. Motzer R.J., Escudier B., Oudard S. et al. Еfficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomized, placebo-controlled phase III trial // Lancet. 2008. Vol. 372. P. 449–456.
23. Everolimus in treating patients with kidney cancer who have undergone surgery. US National Institutes of Health Web site: http://clinicaltrials.gov/ct2/show/NCT01120249?term=EVEREST&rank=7.
24. Гуторов С.Л., Борисова Е.И. Практические рекомендации по предотвращению и коррекции побочных эффектов сунитиниба // Онкоурология. 2010. № 2. С. 8–13.
25. Schmidinger M., Zielinski C.C., Vogl U.M. et al. Cardiac toxicity of sunitinib and sorafenib in patients with metastatic renal cell carcinoma // Clin. Oncol. 2008. Vol. 26. P. 5204–5212.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.