количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Внутрипузырная химиотерапия после ТУР поверхностного рака мочевого пузыря
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
Выявлено, что применение немедленной (в течение 6 часов) внутрипузырной химиотерапии после ТУР немышечно-инвазивного рака мочевого пузыря ведет к значительному снижению количества рецидивов и риска прогрессии опухоли мочевого пузыря, а использование для внутрипузырной химиотерапии цисплатина наряду с митомицином обеспечивает лучшие результаты в сравнении с доксорубицином.
Проведен анализ результатов лечения 77 пациентов с немышечно-инвазивным раком мочевого пузыря, подвергнутых ТУР и внутрипузырной химиотерапии. Рецидив опухоли определен после проведения внутрипузырной химиотерапии у 10,4% больных при временном диапазоне его возникновения в среднем 23,1 месяца. В 6,5% случаев отмечена прогрессия опухоли.
Выявлено, что применение немедленной (в течение 6 часов) внутрипузырной химиотерапии после ТУР немышечно-инвазивного рака мочевого пузыря ведет к значительному снижению количества рецидивов и риска прогрессии опухоли мочевого пузыря, а использование для внутрипузырной химиотерапии цисплатина наряду с митомицином обеспечивает лучшие результаты в сравнении с доксорубицином.
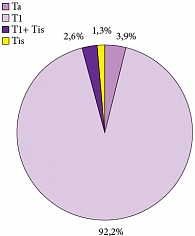
Рис. 1. Стадия опухоли
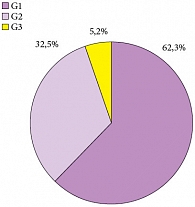
Рис. 2. Дифференцировка опухоли
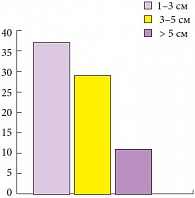
Рис. 3. Размеры опухоли
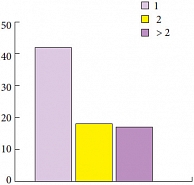
Рис. 4. Количество опухолей
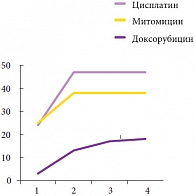
Рис. 5. Количество рецидивов опухоли
Рак мочевого пузыря является вторым по распространенности злокачественным заболеванием мочеполовой системы и второй наиболее распространенной причиной смерти среди мочеполовых опухолей. Примерно 75% новых случаев рака мочевого пузыря в США и Европе ограничиваются слизистой оболочкой и/или собственной пластинкой, тогда как в России данный показатель составляет всего 20–30%. Лечение немышечно-инвазивного рака мочевого пузыря представляет для врача и пациента значительные сложности. До 80% пациентов с немышечно-инвазивным раком мочевого пузыря требуется лечение путем трансуретральной резекции (ТУР) с внутрипузырной химио- или иммунотерапией [1]. Риск рецидива немышечно-инвазивного рака мочевого пузыря приближается к 80%. Относительное значение клинических и патологических факторов течения опухолевого процесса зависит от вида адъювантной внутрипузырной терапии.
Адъювантная внутрипузырная БЦЖ-терапия снижает риски рецидива опухоли на 30% по сравнению только с ТУР [2, 3] и продлевает время до прогрессии заболевания [3, 4]. Большинство исследователей придерживаются мнения, что для снижения риска рецидива и прогрессии немышечно-инвазивного рака мочевого пузыря необходимо проводить внутрипузырную химиотерапию непосредственно после ТУР опухоли мочевого пузыря. Риск рецидивирования опухоли статистически значимо снижается (до 16–50%) по сравнению с больными, не получавшими внутрипузырную химиотерапию (32–34%), прогрессия отмечена в 8–17% и 11–63% случаев соответственно [5–7]. Эффективность внутрипузырной химиотерапии после ТУР мочевого пузыря при немышечноинвазивном раке мочевого пузыря остается неоднозначной. В связи с этим нами был проведен анализ результатов лечения у пациентов с немышечноинвазивным раком мочевого пузыря, у которых после ТУР мо+чевого пузыря проводилась внутрипузырная химиотерапия.
Материалы и методы
В исследование включены 77 пациентов с немышечноинвазивным раком мочевого пузыря, подвергнутых ТУР и внутрипузырной химиотерапии с 2003 по 2008 г. Всем больным выполняли ТУР опухолей мочевого пузыря по стандартной методике до глубокого мышечного слоя с непосредственным внутрипузырным введением после нее химиопрепарата. В 74% случаев использовали цисплатин в дозе 50 мг с экспозицией 60 минут, в 15,6% – митомицин в дозе 40 мг, в 10,4% – доксорубицин 50 мг с аналогичной экспозицией. Степень дифференцировки оценивали по классификации ВОЗ 1973 г. Патологическую стадию устанавливали в соответствии с системой TNM. Наличие рака in situ (Tis) определяли как наличие Tis в сочетании с другими патологическими категориями либо в моноформе.
Наблюдение больных после ТУР с внутрипузырной химиотерапией проводили в соответствии с существующими протоколами послеоперационного наблюдения: РеТУР производили в сроки 4–6 недель после первичного лечения, контрольные цистоскопии для исключения или подтверждения рецидива опухоли и/или ее прогрессии выполняли 3–4 раза в течение первого года, раз в полгода в течение второго года, а затем ежегодно. Статистический анализ осуществлен при помощи программы Statistica 6.0. Различия в распределениях по нескольким градациям признаков оценивали по критериям Фишера и хиквадрат, используя абсолютные значения частот, в модуле непараметрической статистики. Кроме того, сравнение альтернативных показателей, представленных в виде процентов, проводили по t-критерию Стьюдента – с помощью дифференцировочного теста в модуле описательной статистики. Во всех случаях сравнения результаты различий считали статистически достоверными при вероятности ошибки менее 5% (р < 0,05).
Результаты
Средний возраст больных составил 58 лет (18–78 лет), 88,7% из них были мужчины. Медиана наблюдения за пациентами составила 29,2 месяца (6–72 месяца). Преобладающей была стадия рТ1 – 71 больной (92,2%). Tis в моноформе встретился в единичном случае (1,3%) (рис. 1). Высокодифференцированные (G1) опухоли доминировали в структуре всех опухолей и обнаруживались у 48 больных (62,3%), тогда как умеренно-дифференцированные (G2) и низкодифференцированные (G3) встречены в 25 (32,5%) и 4 (5,2%) случаях соответственно (рис. 2). Размеры опухолей и количество опухолей в мочевом пузыре показаны на рисунках 3, 4. Размеры опухолей составили от 1 до 6 см, при этом опухоли размерами 1–3 см преобладали у 37 (48,1%) больных, тогда как опухоли > 3 см определены у 40 (51,9%) больных, опухоли > 5 см удалены у 11 (14,3%) пациентов.
Клинически значимых осложнений после интравезикальной химиотерапии у больных выявлено не было, за исключением поллакиурии, отмеченной в 1 случае. Рецидив опухоли определен при использовании всех 3 химиопрепаратов у 8 больных (10,4%). Причем развитие рецидива выявлено достоверно чаще при внутрипузырной инстилляции доксорубицина – 4 случая (50% от случаев с доксорубицином), тогда как при использовании митомицина и цисплатина рецидив отмечен в 2 (16,6% и 3,5%) случаях соответственно (р < 0,05). Време ной диапазон возникновения рецидива опухоли в среднем составил 23,1 месяца (3–38 месяцев). Случаи рецидива опухоли по времени при применении различных химиопрепаратов указаны на рисунке 5.
Более быстрое возникновение рецидива опухоли имело место в группе больных с интравезикальными инстилляциями доксорубицина, и более поздний рецидив рака мочевого пузыря – в группе с интравезикальным введением цисплатина. Группа больных с введением митомицина занимает промежуточное положение по возникновению рецидивов опухоли. При этом необходимо отметить, что в 92% случаев рецидивы возникали при размерах опухолей более 3 см и наличии умеренной или низкой дифференцировки опухолей по данным гистологического исследования после ТУР. Кроме этого, в 5 случаях (6,5%) отмечена прогрессия опухоли, потребовавшая выполнения радикальной цистэктомии, в 3 случаях из которых определялся Tis как наряду с папиллярной опухолью мочевого пузыря, так и в моноформе, что указывает на необходимость учитывать данный фактор как фактор риска прогрессии опу оли мочевого пузыря.
Обсуждение
Стандартом лечения немышечноинвазивного рака мочевого пузыря остается выполнение ТУР опухоли мочевого пузыря с адъювантной внутрипузырной химиотерапией [8]. Однако, по последним данным, только 4% урологов США используют непосредственное введение химиопрепарата после ТУР опухоли, что свидетельствует о снижении результативности данной терапии [9, 10]. По данным недавних исследований, риск развития рецидива рака мочевого пузыря при монотерапии путем ТУР составляет до 75%, а прогрессия опухоли отмечается в 11–63% случаев [3, 5–7].
В нашем исследовании был отмечен значительно меньший процент развития рецидивирования рака мочевого пузыря после ТУР с непосредственной внутрипузырной химиотерапией – 10,4% при медиане наблюдения 29 месяцев. При этом рецидив развивается достоверно реже при внутрипузырной химиотерапии цисплатином в дозе 50 мг с экспозицией в мочевом пузыре 60 минут. Время до возникновения рецидива опухоли увеличивается при применении митомицина и цисплатина в сравнении с докмногочисленным исследованиям по оценке эффективности митомицина и доксорубицина для внутрипузырной химиотерапии [10–12]. Прогрессия опухоли в когорте наших больных отмечена только в 6,5% случаев, тогда как некоторые зарубежные исследования указывают на отсутствие влияния внутрипузырной химиотерапии на снижение прогрессии немышечно-инвазивного рака мочевого пузыря [11, 13].
Рецидив и прогрессия опухоли зависят от патогистологических характеристик: так, количество рецидивов опухоли возрастает при опухолях больших размеров, умеренно- и низкодифференцированных, а также при наличии Tis. Указанные факторы являются определяющими, по данным некоторых исследований, для развития рецидива и прогрессии немышечно-инвазивного рака мочевого пузыря [5, 12, 14]. Таким образом, применение внутрипузырной химиотерапии ведет к улучшению результатов лечения немышечно-инвазивного рака мочевого пузыря, однако требуется продолжение изучения специализированных молекулярных и генетических маркеров, опреде яющих эффективность ответа проводимой терапии.
Выводы
Применение немедленной (в течение 6 часов) внутрипузырной химиотерапии после ТУР немышечно-инвазивного рака мочевого пузыря ведет к значительному снижению количества рецидивов и риска прогрессии опухоли мочевого пузыря. Использование для внутрипузырной химиотерапии цисплатина наряду с митомицином обеспечивает лучшие результаты в сравнении с доксорубицином. Для полноты оценки эффективности внутрипузырной химиотерапии и оценки прогноза рецидива и прогрессии рака мочевого пузыря необходимы дальнейшие ретро- и проспективные исследования в многочисленных специализированных центрах.
1. Heney N.M. Natural history of superficial bladder cancer. Prognostic features and long-term disease course // Urol. Clin. North. Am. 1992. Vol. 19. P. 429–433.
2. Shelley M.D., Court J.B., Kynaston H. et al. Intravesical bacillus Calmette-Guerin versus mitomycin C for Ta and T1 bladder cancer // Cochrane Database Syst. Rev. 2003. Vol. 3. CD003231.
3. Huncharek M., Kupelnick B. The influence of intravesical therapy on progression of superficial transitional cell carcinoma of the bladder: a metaanalytic comparison of chemotherapy versus bacilli Calmette-Guerin immunotherapy // Am. J. Clin. Oncol. 2004. Vol. 27. P. 522–528.
4. Shahin O., Thalmann G.N., Rentsch C. et al. A retrospective analysis of 153 patients treated with or without intravesical bacillus Calmette-Guerin for primary stage T1 grade 3 bladder cancer: recurrence, progression and survival // J. Urol. 2003. Vol. 169. P. 96–100.
5. Nieder A.M., Brausi M., Lamm D. et al. Management of stage T1 tumors of the bladder: international consensus panel // J. Urol. 2005. Vol. 66. P. 108–125.
6. Solsona E., Iborra I., Ricos J.V. et al. Effectiveness of a single immediate mitomycin C instillation in patients with low risk superficial bladder cancer: short and long-term followup // J. Urol. 1999. Vol. 161. P. 1120–1123.
7. Sylvester R.J., van der Meijden A.P., Oosterlinck W. et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials // Eur. Urol. 2006. Vol. 49. P. 466–465.
8. Клинические рекомендации Европейской ассоциации урологов, 2010. URL: http://www.roou.ru/expert/eau/
9. Clarke N.S., Basu S., Prescott S., Puri R. Chemo-prevention in superficial bladder cancer using mitomycin C: a survey of the practice patterns of British urologists // BJU Int. 2006. Vol. 97. P. 716–719.
10. Madeb R., Golijanin D., Noyes K. et al. Treatment of nonmuscle invading bladder cancer: do physicians in the US practice evidence based medicine? The use and economic implications of intravesical chemotherapy after transurethral resection of bladder tumors // Cancer. 2009. Vol. 115 (12). P. 2660–2670.
11. Tolley D.A., Parmar M.K., Grigor K.M. et al. The effect of intravesical mitomycin C on recurrence of newly diagnosed superficial bladder cancer: a further reportwith 7 years of follow-up // J. Urol. 1996. Vol. 155. P. 1223–1228.
12. Smith J.A., Labasky R.F., Cockett A.T. et al. Bladder cancer clinical guidelines panel summary report on the management of nonmuscle invasive bladder cancer (stages Ta, T1 and Tis). American Urological Association // J. Urol. 1999. Vol. 162. P. 1697.
13. Solsona E., Iborra I., Ricós J.V. Effectiveness of a single immediate mitomycin C instillation in patients with low risk superficial bladder cancer: short and longterm followup // J. Urol. 1999. Vol. 161. P. 1120–1123.
14. Herr H.W. Tumor progression and survival in patients with T1G3 bladder tumours: 15-year outcome // Br. J. Urol. 1997. Vol. 80. P. 762.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.