количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Анальгетическая терапия невоспалительной формы синдрома хронической тазовой боли при патологии простаты
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №5
- Аннотация
- Статья
- Ссылки
Ведущим симптомом урологического синдрома хронической тазовой боли, ассоциированного с патологией простаты, является боль, этиология которой на сегодняшний день точно не ясна, соответственно, нет и значимых успехов в терапии синдрома. По литературным данным, результативность лечения не превышает 45–53%.
В работе представлен сравнительный анализ эффективности и безопасности применения нестероидных противовоспалительных средств и медикаментов с центральным механизмом блокирования болевого импульса при невоспалительной форме синдрома хронической тазовой боли.
Ведущим симптомом урологического синдрома хронической тазовой боли, ассоциированного с патологией простаты, является боль, этиология которой на сегодняшний день точно не ясна, соответственно, нет и значимых успехов в терапии синдрома. По литературным данным, результативность лечения не превышает 45–53%.
В работе представлен сравнительный анализ эффективности и безопасности применения нестероидных противовоспалительных средств и медикаментов с центральным механизмом блокирования болевого импульса при невоспалительной форме синдрома хронической тазовой боли.
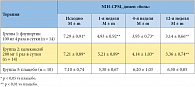
Таблица 1. Оценка индекса боли в группах на фоне проводимого лечения

Таблица 2. Оценка симптомов нарушенного мочеиспускания в группах на фоне проводимого лечения
Введение
Боль является наиболее частым симптомом, возникающим при любом заболевании и определяемым как неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения [1]. Боль может быть острой и хронической. Острая боль возникает внезапно вследствие повреждения тканей или при остром повреждении нерва и длится около недели. Хроническая боль длится как минимум в течение 3 месяцев и возникает при изменениях в центральной нервной системе, в результате чего и при отсутствии острого повреждения могут появляться неприятные ощущения. Хроническая боль подавляет иные виды чувствительности, эмоции, мыслительные процессы и реакции, что приводит к снижению качества жизни пациента и нарушению его социальной адаптации.
Боль – субъективное ощущение, следовательно, степень данного ощущения также субъективна, однако оценить ее крайне важно, для того чтобы знать исходный статус пациента, назначать адекватное лечение и проводить дальнейший мониторинг. Наиболее надежным, точным и простым методом определения степени боли является метод оценки болевого ощущения посредством количественной шкалы оценки боли – визуальной аналоговой шкалы боли, когда значению «0 баллов» соответствует отсутствие болевого ощущения, а значению «10 баллов» – крайняя степень боли. Получила распространение и числовая шкала оценки боли, представляющая собой линию длиной 10 см, где полярно указаны крайние характеристики боли (значение 1 соответствует «нет боли», 5 – «средняя боль», 10 – «тяжелейшая боль»). В практической деятельности также используется и словесная оценочная шкала, по которой выделяется четыре степени боли: отсутствие боли, легкая боль, не сильно выраженная боль, сильная боль. Существуют и более сложные инструменты оценки. Например, опросник «краткая оценка боли» содержит четыре десятибалльные количественные шкалы оценки боли, позволяющие определить степень болевого ощущения непосредственно в момент осмотра и выявить время возникновения болей. Кроме этого, в его состав включены семь шкал для оценки влияния болевого синдрома на качество жизни пациента [2].
Боль является ведущим симптомом урологического синдрома хронической тазовой боли (СХТБ), ассоциированного с патологией простаты, подразделяющегося на воспалительную (СХТБ IIIA) и невоспалительную (СХТБ IIIБ) формы. Формы СХТБ не имеют специфичных симптомов и различаются по наличию лейкоцитов в секрете предстательной железы. Диагноз СХТБ является симптоматическим и устанавливается при наличии болей в тазу, длящихся не менее 3 месяцев при отсутствии какой-либо патологии нижних мочевых путей. Определение тяжести заболевания, степени его прогрессирования и эффекта от проводимого лечения осуществляется путем специальных утвержденных методов оценки [3]. Необходимо также учитывать качество жизни пациента, так как при этом заболевании оно может быть таким же низким, как и при остром инфаркте миокарда, нестабильной стенокардии или болезни Крона [4]. Общепринятым инструментом, позволяющим при анализе симптомов наиболее точно определить тяжесть заболевания и степень нарушения качества жизни пациента, является опросник NIH-CPSI (индекс симптомов хронического простатита Национального института здравоохранения США) [5]. Данный субъективный метод оценки, одобренный урологическим сообществом Европы, США и многих других стран, рекомендуется применять с целью оценки исходного статуса пациента и динамики развития болезни.
Для успешного ведения пациента с болью в тазу врач должен определить этиологию боли. В то же время лечение должно быть направлено на облегчение боли, даже когда возможность устранения истинной причины боли отсутствует. В связи с тем что этиология СХТБ на настоящее время не установлена, большинство схем лечения проводится на основании ведущего симптома. Определенных успехов удалось достичь в ведении больных с воспалительной формой СХТБ. Но определенной и эффективной схемы терапии СХТБ IIIБ на современном этапе не выработано. Наиболее часто рекомендуются к применению следующие лекарственные средства.
- Альфа-адреноблокаторы. Их использование приводит к снижению частоты возникновения и выраженности симптомов, характерных для нарушения мочеиспускания и выраженности болевого синдрома. В 50–60% случаев удается уменьшить тяжесть и частоту появления некоторых симптомов, однако не удается снизить выраженность боли [6].
- Антибактериальная терапия (фторхинолоны). Применяется достаточно часто, так как на фоне ее проведения состояние некоторых пациентов улучшается [7]. Несмотря на это, эффективность антибиотикотерапии при лечении простатического болевого синдрома не доказана, и при отсутствии эффекта от лечения в течение 2 недель следует прибегать к иным методам лечения [8].
- Анальгетики. Некоторые пациенты отмечают улучшение самочувствия при назначении нестероидных противовоспалительных препаратов, однако пока нет достаточного количества данных, доказывающих их эффективность [9]. Относительно новым направлением является применение селективных блокаторов в терапии СХТБ фермента циклооксигеназы 2 типа. Наряду с применением НПВС некоторыми авторами обсуждалась возможность применения опиоидных анальгетиков в ведении резистентной формы СХТБ. Однако риск развития привыкания и гиперальгезии при применении этих препаратов сдерживает их широкое использование [10].
- Миорелаксанты. Эффективны лишь при доказанной миопатии диафрагмы таза или спастичности сфинктера мочеиспускательного канала [11]. Недавно проведенное клиническое исследование продемонстрировало эффективность сочетанной терапии СХТБ миорелаксантом, нестероидным анальгетиком и альфа-адреноблокатором. Однако исключение из лечения нестероидного анальгетика привело к снижению положительного эффекта [12].
- Ингибиторы 5-альфа-редуктазы. Установлено, что финастерид способен улучшать состояние пациентов, облегчать боль и выраженность симптомов нарушения мочеиспускания [13]. Тем не менее при проведении шестимесячного рандомизированного плацебоконтролируемого исследования эффективность применения финастерида не была доказана [14].
- Крестцовая нейромодуляция как метод лечения синдрома тазовой боли является довольно эффективным методом у пациентов с рефрактерным СХТБ [15, 16]. Однако сообщения единичны и противоречивы.
- Фитотерапия. Данные об эффективности этого метода лечения противоречивы. С одной стороны, отмечен выраженный позитивный клинический эффект экстракта пыльцы растений [17], с другой стороны, лишь незначительное – на 36% – улучшение состояния пациентов в сравнении с плацебо [18].
-
Поддерживающая терапия. Мониторирование состояния больного и проведение лечебной физкультуры с целью снижения тонуса мышц, акупунктура, мануальная терапия, хиропрактика или медитация способствуют некоторому улучшению состояния пациентов [19]. Доказана определенная эффективность и электромагнитной терапии [20]. Тем не менее методы не получили широкого применения.
- Хирургические методы лечения (трансуретральная инцизия шейки мочевого пузыря, радикальная трансуретральная резекция простаты, радикальная простатэктомия). Показания к проведению хирургических методов лечения очень ограничены и специфичны, поэтому данные виды терапии выполняются крайне редко [21]. Таким образом, используемые на сегодня средства ведения пациентов с СХТБ IIIБ с целью коррекции болевого синдрома обладают различным уровнем эффективности при неодинаковых финансовых затратах. Наиболее изученными в отношении «эффективность – безопасность» и часто применяемыми являются лекарственные средства группы НПВС. Однако в последнее время в терапии боли различной локализации получили распространение препараты с центральным механизмом действия, не являющиеся опиоидными анальгетиками.
Материалы и методы
Нами проведено сравнительное рандомизированное плацебоконтролируемое исследование эффективности и безопасности применения анальгетических препаратов различного механизма действия в терапии СХТБ IIIБ. В исследование включены 38 пациентов (от 23 до 43 лет, средний возраст 35,5 лет) с установленным стандартными методами оценки диагнозом СХТБ IIIБ. Длительность болезни – от 5 до 14 лет. Ведущим симптомом у всех участников являлась боль. Пациенты были рандомизированы на две группы. Группа 1 (n = 14) получала флупиртин, неопиоидный анальгетик центрального действия, не вызывающий зависимости и привыкания, в дозе 100 мг 4 раза в сутки. Пациенты группы 2 (n = 14) принимали целекоксиб, нестероидное противовоспалительное средство и селективный ингибитор ЦОГ-2, в дозе 200 мг 1 раз в сутки. Всем была назначена средняя терапевтическая доза препаратов. Антиангинальные эффекты оценивали на 1, 4 и 12-й неделях терапии посредством опросника NIH-CPSI. Детализацию симптомов проводили по трем доменам опросника NIH-CPSI: индексу боли, мочевым симптомам и оценке качества жизни. Полученные результаты сравнивали с группой 3 (n = 10), принимавшей плацебо.
Результаты
В ходе проведенного исследования нами получены следующие данные.
-
I. Домен «боль» (от 0 до 21 баллов). Интенсивность боли к концу первой недели достоверно снизилась с 7,29 ± 0,91 баллов до 4,93 ± 0,92 баллов в группе 1, с 7,21 ± 0,89 баллов до 5,21 ± 0,89 баллов во группе 2 и с 7,10 ± 0,74 баллов до 5,30 ± 0,67 баллов в группе 3. После 4 недель терапии в группах 1 и 2 индекс боли достоверно снизился еще на 1,00 и 1,07 баллов соответственно, но повысился на 0,9 баллов в группе 3. После курса терапии (12-я неделя) индекс боли достоверно снизился и составил 3,14 ± 0,66 баллов в группе 1 и 3,36 ± 0,74 баллов в группе 2, в то время как в группе 3 индекс боли повысился до 6,50 ± 0,85 баллов (достоверности эти данные не имели). Таким образом, снижение интенсивности боли в группах 1, 2 и 3 к концу лечения составило 56,9%, 53,4% и 8,5% соответственно (табл. 1).
-
II. Домен «мочевые симптомы» (от 0 до 10 баллов). К 1-й неделе наблюдения в группах 1, 2 и 3 тяжесть мочевых симптомов уменьшилась на 6,9%, 6,8% и 5,0% соответственно. К 4-й неделе снижение достигло 15,7% и 15,5% в группах 1 и 2. В группе 3, наоборот, тяжесть мочевых симптомов повысилась на 2,5% в сравнении c исходными данными. К 12-й неделе счет мочевых симптомов в группах в сравнении с данными 4-й недели повысился на 6,1%, 6,0% и 2,4% соответственно. В целом на фоне лечения тяжесть мочевых симптомов в группах 1 и 2 снизилась на 10,6% и 10,4% соответственно. В это же время в группе 3 произошло усиление симптоматики на 5% от исходного уровня. Достоверности при внутригрупповом и межгрупповом анализе эти данные не имели (табл. 2).
-
III. Домен «качество жизни» (от 0 до 12 баллов). Качество жизни пациентов достоверно улучшилось на фоне приема обоих препаратов в сравнении с плацебо. Достоверно более выраженное удовлетворение от лечения достигнуто пациентами группы 1 в сравнении с группами 2 и 3: 52,1% против 41,6% и 3,8% соответственно (табл. 3).
Заключение
Целекоксиб – нестероидное противовоспалительное средство, которое селективно ингибирует циклооксигеназу 2 типа, тем самым блокируя образование провоспалительных простагландинов. Однако целекоксиб не влияет на продукцию простагландинов, регулирующих почечный кровоток и целостность слизистой оболочки ЖКТ. Препарат широко применяется в клинической практике благодаря выраженным анальгетическим свойствам [22]. Тем не менее, несмотря на клиническую эффективность, даже кратковременный прием препарата может приводить к развитию побочных реакций со стороны желудочнокишечного тракта, представляющих серьезную угрозу для здоровья пациентов [23].
Флупиртин представляет собой анальгетик центрального действия из группы селективных активаторов нейрональных калиевых каналов, препарат не относится к опиоидам, не вызывает зависимости и привыкания, обладает сочетанием болеутоляющих и миорелаксирующих свойств. Как экспериментальные, так и клинические исследования показали, что флупиртин наряду с антиангинальной активностью обладает способностью снимать болезненный мышечный спазм и имеет нейропротективное действие [24]. Полученные нами данные о большей клинической эффективности флупиртина в сравнении с целекоксибом при СХТБ IIIБ могут быть объяснены множественными фармакологическими эффектами препарата. При схожем профиле безопасности исследуемых препаратов это может обусловливать преимущества применения флупиртина.
1. Foley K.M., Posner J.B. Pain and its management // Cecil Textbook of Medicine. 18th edn. Philadelphia: WB Saunders, 1988. P. 104–112.
2. Tan G., Jensen M., Thornby J. et al. Validation of the Brief Pain Inventory for chronic nonmalignant pain // J. Pain. 2004. Vol. 5. № 2. P. 133–137.
3. Nickel J.C. Effective office management of chronic prostatitis // Urol. Clin. North. Am. 1998. Vol. 25. № 4. P. 677–684.
4. McNaughton Collins M., Pontari M.A., O’Leary M.P. et al. Chronic Prostatitis Collaborative Research Network. Quality of life is impaired in men with chronic prostatitis: the Chronic Prostatitis Collaborative Research Network // J. Gen. Intern. Med. 2001. Vol. 16. № 10. P. 656–662.
5. Litwin M.S., McNaughton-Collins M., Fowler F.J. et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. Chronic Prostatitis Collaborative Research Network // J. Urol. 1999. Vol. 162. № 2. P. 369–375.
6. Yang G., Wei Q., Li H. et al. The effect of alpha-adrenergic antagonists in chronic prostatitis/chronic pelvic pain syndrome: a meta-analysis of randomized controlled trials // J. Androl. 2006. Vol. 27. № 6. P. 847–852.
7. Nickel J.C., Downey J., Johnston B. et al.; Canadian Prostatitis Research Group. Predictors of patient response to antibiotic therapy for the chronic prostatitis/chronic pelvic pain syndrome: a prospective multicenter clinical trial // J. Urol. 2001. Vol. 165. № 5. P. 1539–1544.
8. Lee J., Muller C., Rothman I. et al. Prostate biopsy culture findings of men with chronic pelvic pain syndrome do not differ from those of healthy controls // J. Urol. 2003. Vol. 169. № 2. P. 584–587.
9. Canale D., Scaricabarozzi I., Giorgi P. et al. Use of a novel nonsteroidal anti-inflammatory drug, nimesulide, in the treatment of abacterial prostatovesiculitis // Andrologia. 1993. Vol. 25. № 3. P. 163–166.
10. Nickel J.C. Opioids for chronic prostatitis and interstitial cystitis: lessons learned from the 11th World Congress on Pain // J. Urol. 2006. Vol. 68. № 4. P. 697–701.
11. Osborn D.E., George N.J., Rao P.N. et al. Prostatodynia – physiological characteristics and rational management with muscle relaxants // Br. J. Urol. 1981. Vol. 53. № 6. P. 621–623.
12. Tugcu V., Tasci A., Fazlioglu С. et al. A placebo-controlled comparison of the efficiency of triple- and monotherapy in category III B chronic pelvic pain syndrome (CPPS) // Eur. Urol. 2007. Vol. 51. № 4. P. 1113–1117.
13. Olavi L., Make L., Imo M. Effects of finasteride in patients with chronic idiopathic prostatitis: a double-blind, placebo-controlled pilot study // Eur. Urol. 1998. Vol. 33. Suppl. 1. P. 24.
14. Kaplan S.A., Volpe M.A., Te A.E. A prospective, 1-year trial using saw palmetto versus finasteride in the treatment of category III prostatitis/chronic pelvic pain syndrome // J. Urol. 2004. Vol. 171. № 1. P. 284–288.
15. Edlund C., Hellstrom M., Peeker R. et al. First Scandinavian experience of electrical sacral nerve stimulation in the treatment of the overactive bladder // Scand. J. Urol. Nephrol. 2000. Vol. 34. № 6. P. 366–376.
16. Paszkiewicz E.J., Siegel S.W., Kirkpatrick C. et al. Sacral nerve stimulation in patients with chronic, intractable pelvic pain // J. Urol. 2001. Vol. 57. № 6. Suppl. 1. P. 124.
17. Rugendorff E.W., Weidner W., Ebeling L. et al. Results of treatment with pollen extract (Cernilton N) in chronic prostatitis and prostatodynia // Br. J. Urol. 1993. Vol. 71. № 4. P. 433–438.
18. Elist J. Effects of pollen extract preparation Prostat/Poltit on lower urinary tract symptoms in patients with chronic nonbacterial prostatitis/chronic pelvic pain syndrome: a randomized, double-blind, placebo-controlled study // J. Urol. 2006. Vol. 67. № 1. P. 60–63.
19. Nickel J.C., Weidner W. Chronic prostatitis: current concepts and antimicrobial therapy // Infect. Urol. 2000. Vol. 13. P. S22–S28.
20. Rowe E., Smith C., Laverick L. et al. A prospective, randomized, placebo, controlled, double-blind study of pelvic electromagnetic therapy for the treatment of chronic pelvic pain syndrome with 1 year of followup-// J. Urol. 2005. Vol. 173. № 6. P. 2044–2047.
21. Nickel J.C. Prostatitis: evolving management strategies // Urol. Clin. North. Am. 1999. Vol. 26. №. 4. P. 737–751.
22. Masferrer J.L., Zweifel B.S., Seibert K. et al. Selective regulation of cellular cyclooxygenase by dexamethasone and endotoxin in mice // J. Clin. Invest. 1990. Vol. 86. № 4. P. 1375–1379.
23. Wolfe M., Lichtenstein D.R., Sinhg G. Gastrointestinal toxicity of nonsteroidal anti-inflammatory drugs // N. Engl. J. Med. 1999. Vol. 340. № 24. P. 1888–1899.
24. Mueller-Schwefe G. Flupirtine in acute and chronic pain associated with muscle tenseness. Results of a postmarket surveillance study // Fortschr. Med. 2003. Vol. 121. № 1. P. 11–18.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Ведущим симптомом урологического синдрома хронической тазовой боли, ассоциированного с патологией простаты, является боль, этиология которой на сегодняшний день точно не ясна, соответственно, нет и значимых успехов в терапии синдрома. По литературным данным, результативность лечения не превышает 45–53%.
В работе представлен сравнительный анализ эффективности и безопасности применения нестероидных противовоспалительных средств и медикаментов с центральным механизмом блокирования болевого импульса при невоспалительной форме синдрома хронической тазовой боли.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
