Препараты сульфонилмочевины в современной клинической практике
- Аннотация
- Статья
- Ссылки
В Российской Федерации, как и во всех странах мира, повсеместно отмечается рост заболеваемости СД 2 (1, 2).
В Российской Федерации, как и во всех странах мира, повсеместно отмечается рост заболеваемости СД 2 (1, 2).


Масштабность проблемы тем более значительна, ведь наряду с официально зарегистрированными случаями СД 2, у значительной части населения диагноз не установлен, и наблюдается нарушенная толерантность к глюкозе (НТГ) или нарушение гликемии натощак. Ежегодно примерно у 1,5-7,3% лиц с НТГ развивается СД 2 (14). Следовательно, фактическая распространенность СД 2 в несколько раз превышает официально зарегистрированную распространенность. Необходимо особо подчеркнуть, что наибольшее количество пациентов с НТГ или с СД 2 – это люди активного трудоспособного возраста.
Медицинская и социальная значимость СД 2 определяется прежде всего его тяжелыми осложнениями, которые приводят к ранней инвалидизации и высокой смертности, сокращению продолжительности и ухудшению качества жизни пациентов. Развитие осложнений связывают в первую очередь с хронической гипергликемией, что было убедительно доказано в ходе длительных крупномасштабных исследований (7, 12).
СД 2 – это хроническое заболевание, развивающееся в результате сочетанного воздействия генетических и средовых факторов (5). Для СД 2 к настоящему времени принята концепция полигенного наследования. В развитии заболевания имеют значение два фундаментальных патофизиологических механизма: прогрессирующее нарушение функции β-клеток поджелудочной железы и различной степени выраженности инсулинорезистентность (ИР). При манифестации СД 2 секреция инсулина в среднем снижается на 50%, а чувствительность к инсулину – на 70% (5). В дальнейшем функция β-клеток ухудшается примерно со скоростью 4-5% в год от момента установления диагноза.
ИР, как наиболее раннее нарушение, намного опережает клиническую манифестацию СД 2. Это состояние, характеризующееся недостаточным биологическим ответом организма на физиологические концентрации инсулина. Основными внешними факторами, способствующими реализации ИР, является увеличение потребления высококалорийной пищи, недостаточная физическая активность и избыточная масса тела. В условиях ИР, которая во многом обусловлена нарушением действия инсулина на пострецепторном уровне, происходит снижение утилизации глюкозы мышечной и жировой тканью. ИР печени сопровождается снижением синтеза гликогена, активизацией глюконеогенеза и гликогенолиза. Длительное время ИР компенсируется нефизиологической гиперинсулинемией, способствующей поддержанию нормогликемии на этом этапе заболевания.
У здоровых людей секреция инсулина в ответ на прием пищи имеет 2 фазы. Одним из ранних патофизиологических дефектов секреторной функции β-клеток при СД 2 является именно нарушение ранней фазы секреции инсулина, в норме ограничивающей нефизиологический подъем гликемии в постпрандиальный период (5). Ранняя фаза прандиального ответа, составляющая около 10% от всего за сутки секретируемого инсулина, вызывает подавление эндогенной продукции глюкозы печенью, подавляет секрецию глюкагона и липолиз, повышает чувствительность периферических тканей к действию инсулина, способствуя утилизации ими глюкозы. Другими особенностями нарушенной секреторной функции β-клеток являются сниженный и отсроченный во времени ответ на прием смешанной пищи, повышение концентрации проинсулина, нарушение пульсативной секреции инсулина.
В дальнейшем механизм компенсаторной гиперинсулинемии утрачивается и секреция инсулина становится недостаточной по отношению к нарастающей гипергликемии. В этих условиях печень избыточно продуцирует глюкозу, что приводит к гипергликемии натощак. Кроме того, гепатическая продукция глюкозы продолжается несмотря на пищевую нагрузку и в сочетании с относительной недостаточностью выброса инсулина также приводит к постпрандиальной гипергликемии. При СД 2 наибольшая диспропорция между секрецией инсулина и потребностью в нем возникает именно после приема пищи.
По результатам крупных эпидемиологических и обсервационных исследований в области диабета были получены убедительные доказательства наличия тесной связи между эволюцией СД 2, нарушениями углеводного обмена и возрастающим риском микро- и макрососудистых осложнений заболевания (4, 12). Так, в исследовании UKPDS были продемонстрированы достоверные преимущества интенсивного контроля гликемии СД 2 (11): снижение уровня HbA1c на 0,9% при длительности наблюдения до 10 лет уменьшает риск смерти на 21%, острого инфаркта миокарда на 14%, микрососудистых осложнений на 37% и заболеваний периферических сосудов на 43%. Важно отметить, что при впервые диагностированном СД 2 осложнения наблюдаются практически у 50% больных (8). Так, согласно данным исследования CODE-2 (Cost of Diabetes in Europe – Type 2), изучавшего распространенность различных хронических осложнений у больных СД, различные осложнения имели 59% обследованных, причем у 23% было два, а у 3% – три осложнения и более (7).
В связи с вышесказанным оптимизация подходов к терапии у пациентов с СД 2 является приоритетной проблемой современной медицины, а лечебная стратегия должна прежде всего предупреждать и сводить к минимуму риск развития хронических осложнений заболевания. Очевидно, что в настоящий момент требуется изменение подходов к лечению СД 2 для достижения более эффективного контроля над этим заболеванием. Это интенсивная стратегия лечения, направленная против хронической гипергликемии на стойкое достижение компенсации углеводного обмена сразу с момента диагностики СД 2. С этой целью многие национальные и международные диабетологические ассоциации четко определили целевой показатель важнейшего параметра метаболического контроля – гликированного гемоглобина (HbA1c): ADA/EASD: < 7%, IDF: ≤ 6,5%. В настоящее время в Российской Федерации основной целью лечения СД 2 является снижение HbA1c до уровня < 7% (таблица 1).
Прежде чем переходить к вопросам фармакотерапии СД 2, следует отметить важность немедикаментозных подходов к лечению заболевания и обязательного проведения самоконтроля гликемии, без которых любая фармакотерапия будет недостаточна. Современные рекомендации по диетотерапии СД 2 включают в себя следующие принципы: энергетическая ценность пищи, поддерживающая массу тела близкой к идеальной, а в случае избыточного веса – низкокалорийное питание.
Большинству больных СД 2 следует придерживаться дробного питания (5-6 раз в день небольшими порциями), что позволяет не только избежать сильного чувства голода при уменьшении суточной калорийности объема порций, но и препятствует постпищевой гипергликемии. Рекомендуемое содержание углеводов – 50-60%, белков не более 15% от общей калорийности суточного рациона; предусматривается максимальное ограничение или исключение легкоусвояемых и преимущественное потребление сложных углеводов. Доля жиров в суточном рационе не должна превышать 30%, насыщенные жиры должны составлять не более 10% от всего потребляемого жира. Предусматривается включение полиненасыщенных жиров в качестве противоатерогенного средства, необходимо снижение потребления холестерина (менее 300 мг в день) и повышение употребление продуктов с высоким содержанием пищевых волокон, сокращение приема алкоголя (менее 30 г в день).
Одновременно с изменением питания должны проводиться мероприятия, направленные на повышение двигательной активности. Хороший эффект оказывает рациональная физическая нагрузка, безопасная и эффективная с учетом индивидуальных особенностей каждого пациента: например, пешие прогулки, плавание продолжительностью 30-45 мин. 3-5 раз в неделю или любой посильный комплекс физических упражнений. Физические нагрузки как уменьшают выраженность ИР, так и стимулируют утилизацию глюкозы инсулиннезависимыми тканями, в которых индуцированное упражнениями увеличение потребления глюкозы не зависит от действия инсулина. Во время физических нагрузок происходит уменьшение выраженности гиперинсулинемии, а потребление глюкозы мышцами увеличивается несмотря на снижение уровня инсулина. Необходимо добиваться снижения веса при его избытке и предупреждения дальнейшего накопления; наиболее безопасным и надежным является темп похудения на 0,5-1 кг в неделю. Процесс снижения массы тела должен контролироваться врачом, что особенно актуально для пожилых пациентов.
Пероральные сахароснижающие средства включают несколько основных групп: препараты сульфонилмочевины (ПСМ), бигуаниды, тиазолидиндионы, ингибиторы α-глюкозидазы, но в последнее время появились и новые группы этих средств (инкретиномиметики, ингибиторы дипептидилпептидазы IV типа). Исходный выбор препаратов остается важной задачей, в решении которой помогает анализ сравнительной эффективности пероральных сахароснижающих препаратов (ПССП) (таблица 2).
Одним из наиболее известных и широко применяемых препаратов в терапии СД 2 являются ПСМ. Интересна история их создания: ПСМ были разработаны после того, как в 1940-х при изучении антибактериальной активности сульфаниламидов было случайно обнаружено их побочное действие в виде гипогликемии у лабораторных животных (1). Широкое клиническое применение данного класса лекарственных средств началось еще в 50-х годах прошлого столетия.
Механизм действия этих препаратов – класса секретогогов – связан главным образом со стимуляцией β-клеток поджелудочной железы, сопровождающейся мобилизацией и усилением эндогенной секреции инсулина, особенно в присутствии глюкозы (1, 4, 6). Наличие в островках Лангерганса функционально-активных β-клеток является основой для проявления эффекта этих сахароснижающих препаратов. Периферическое (экстрапанкреатическое) действие, по-видимому, вторично и обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает угнетение гепатической продукции глюкозы и улучшение ее утилизации периферическими тканями; собственные экстрапанкретические эффекты убедительно не доказаны (1).
Инсулин секретируется β-клетками в ответ на различные стимулы, каждый из которых вносит свой вклад в функционирование этих клеток. ПСМ связываются со специфическими белками-рецепторами на клеточной мембране β-клеток – SUR-1, представляющими собой белки АТФ-зависимых К+-каналов клеточной мембраны (9). В настоящее время роль АТФ-зависимых К+-каналов в процессе регуляции секреции инсулина считается ключевой (3, 10). После взаимодействия ПСМ с рецептором развивается цепь последовательных событий: закрытие АТФ-зависимых К+-каналов транспорта ионов калия, прекращение трансмембранного потока ионов калия и деполяризация мембраны. В дальнейшем деполяризация мембраны активирует кальциевые каналы, и значительно увеличивается приток кальция внутрь β-клеток. Повышение концентрации ионов кальция внутри β-клеток способствует движению гранул, содержащих инсулин, через их мембрану и секреции инсулина в кровоток. При низком уровне глюкозы в крови и при низкой концентрации АТФ внутри β-клеток канал транспорта ионов калия открыт, и за счет его функционирования создается мембранный потенциал, который препятствует проникновению внутрь β-клеток ионов кальция, необходимых для движения гранул, содержащих инсулин, через мембрану β-клеток и секреции гормона в кровоток. Следовательно, ПСМ активируют физиологический механизм, посредством которого глюкоза стимулирует продукцию инсулина.
Принципиальный подход к выбору того или иного ПСМ основывается на оценке баланса эффективности, безопасности и доступности для пациента. Неодинаковая аффинность ПСМ к специфическим рецепторам β-клеток поджелудочной железы обусловливает их различную сахароснижающую активность (6, 4). Чем выше сродство препарата к рецептору, тем будет дольше его подавляющее влияние на АТФ-зависимые К+-каналы, а значит, тем сильнее будет стимулироваться эндогенная секреция инсулина за счет поступления в β-клетки ионов кальция. Среди ПСМ наиболее выраженным сахароснижающим эффектом обладает глибенкламид, поскольку препарат характеризуется максимальным сродством к АТФ-зависимым K+-каналам β-клеток. Более того, высокая сахароснижающая активность препарата объясняется и особенностями химической структуры – наличием не только сульфонилмочевинной, но и бензамидной группировки (рисунок 1). Итак, взаимодействуя с двумя связывающими местами рецепторов β-клеток поджелудочной железы, глибенкламид наиболее быстро и сильно способствует закрытию АТФ-зависимых К+-каналов, стимулирует деполяризацию мембраны, повышение внутриклеточного Са2+ и, следовательно, секрецию эндогенного инсулина.
В настоящее время глибенкламид – это единственный ПСМ, терапия которым доказано снижает риск развития хронических осложнений СД 2. Существенным является, что по данным исследования URPDS лечение глибенкламидом позволило снизить риск развития микрососудистых осложнений на 30% (р = 0,015), включая ретинопатию, требующую фотокоагуляции – на 33% (р = 0,008). Проблема макрососудистых осложнений СД 2 представляется еще более серьезной: глибенкламид значительно уменьшал частоту инфаркта – на 22% (р = 0,056). Благодаря столь выраженному сахароснижающему действию, задокументированному в URPDS длительному опыту применения, отличающему глибенкламид от всех других ПСМ, этот препарат по-прежнему остается золотым стандартом пероральной сахароснижающей терапии и наиболее часто используемым ПСМ (13).
В Российской Федерации применяется как традиционная форма глибенкламида (немикронизированная, 5 мг), так и микронизированные формы препарата. Ввиду особенностей фармакокинетики и фармакодинамики микронизированные формы глибенкламида (препарат Манинил®, компания «Берлин-Хеми АГ/Менарини Групп», Германия) (1,75/3,5 мг) назначаются в настоящее время шире, чем немикронизированная. Большим достоинством микронизированной формы глибенкламида является быстрая абсорбция (полное высвобождение действующего вещества в течение 5 мин. после растворения) и соответственно полная биодоступность (100%), благодаря чему суточная доза глибенкламида снижается на 30-40% в отличие от традиционной формы глибенкламида 5 мг. Терапевтическая концентрация препарата Манинил® в крови достигается быстро, в течение 15-30 мин. Период полувыведения микронизированной формы глибенкламида составляет 1,5-3,5 ч; длительность сахароснижающего действия, однако, не соответствует этому периоду и составляет сутки. Благодаря этим фармакокинетическим характеристикам микронизированные формы глибенкламида можно принимать 1-2 раза в сутки, что удобно для пациентов, а плавное достижение максимальной концентрации через 2,5 часа – на подъеме постпрандиальной гипергликемии – позволяет избежать риска гипогликемий между приемами пищи, что, без сомнения, важно для пожилых пациентов.
Начальная доза микронизированной формы глибенкламида обычно составляет 1,75-3,5 мг в день, Манинил® необходимо принимать непосредственно перед приемом пищи. Доза препарата постепенно титруется до достижения необходимого терапевтического эффекта – целевых показателей гликемии – не быстрее чем каждые 5-7 дней; если суточная доза составляет 50% от максимальной терапевтической дозы (14 мг/сут.), то рекомендуется 2-кратный прием Манинила.
Глибенкламид метаболизируется с образованием неактивных и активных оксиметаболитов и характеризуется двойным путем выведения: 50% через почки, столько же с желчью. При хронической почечной недостаточности выведение глибенкламида не меняется, однако снижается связывание с белками, вследствие чего возрастает свободная фракция Манинила и риск развития гипогликемии (1).
Всегда следует помнить о возможном риске развития гипогликемических состояний, особенно опасных в пожилом возрасте, на фоне сахароснижающей терапии. Одной из частых причин гипогликемий является быстрое увеличение суточной дозы или неправильно подобранные дозы Манинила, а также нарушение режима питания (резкое ограничение сложных углеводов, пропуск очередного приема пищи) и нерациональная физическая нагрузка.
Пациенты с СД 2 часто имеют различную сопутствующую патологию, поэтому в клинической практике необходимо принимать во внимание и проблему лекарственного взаимодействия. Так, при назначении целого ряда препаратов за счет различных механизмов может наблюдаться как усиление, так и ослабление действия глибенкламида, как и других ПСМ: снижают сахароснижающую активность глюкокортикоиды, барбитураты, фенотиазины, тиазидные диуретики, тиреоидные гормоны (супрессивная терапия), эстрогены, гестагены, адреномиметики, производные никотиновой кислоты, рифампицин. Напротив, следующие препараты усиливают сахароснижающее действие: салицилаты, сульфаниламиды, анаболические стероиды, пентоксифиллин, аллопуринол, хлорамфеникол, пиразолоновые производные, клофибрат, безафибрат, ингибиторы моноаминоксидазы, непрямые антикоагулянты, противогрибковые средства системного действия, спиртсодержащие лекарственные средства.
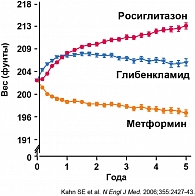
Известно, что 85-90% больных с СД 2 имеют избыточную массу тела или ожирение. Нежелательным побочным эффектом глибенкламида, как и других ПСМ, в ряде случаев может быть прогрессирование ожирения (рисунок 2), что можно уменьшить или предотвратить соблюдением врачебных рекомендаций по питанию и физическим нагрузкам, что часто не претворяется активно на практике пациентами.
Не возможно обойти вниманием такой важный вопрос, как доступность терапии, в связи как с хроническим характером течения заболевания и необходимостью длительной сахароснижающей терапии, так и с огромным, постоянно растущим количеством больных СД 2 и непростой экономической ситуацией, сложившейся в нашей стране. В этом плане наиболее выгодным является применение Манинила с учетом высокой эффективности, длительного опыта применения и наличия современной микронизированной формы препарата. Высокую социальную значимость глибенкламида подчеркивают и эксперты ВОЗ, включив его в очередной раз в перечень Основных лекарственных средств – наиболее эффективных, безопасных и выгодных с фармако-экономической точки зрения средств для лечения социально значимых заболеваний; глибенкламид является единственным представителем ПСМ в данном списке (15).
Противопоказаниями к назначению Манинила являются: СД типа 1, диабет после панкреатэктомии, кетоацидоз, хирургические вмешательства (большие операции), тяжелые инфекции и травмы, аллергии на ПСМ или сходные с ними препараты в анамнезе, тяжелые нарушения функции почек и печени. Следует воздержаться от назначения препарата в период беременности и лактации.
У большинства больных СД 2 монотерапия ПССП не обеспечивает долгосрочного эффективного гликемического контроля: по результатам исследования UKPDS монотерапия одним из пероральных сахароснижающих препаратов через 3 года от начала лечения была эффективной только у половины пациентов, а через 9 лет – лишь у 25%; это приводит к необходимости назначения комбинированной терапии (11). Дальнейшее поддержание компенсации углеводного обмена может быть достигнуто при использовании комбинации из двух-трех ПССП с разным механизмом действия или при добавлении к лечению базального инсулина. Манинил® может эффективно использоваться в комбинированной терапии как с метформином, тиазолидиндионами, миметиками инкретина, так и с инсулином (4, 6).
В заключение следует отметить, что при назначении сахароснижающей терапии не нужно пренебрегать ПСМ – основой фармакотерапии заболевания – Манинилом с длительным опытом клинического применения и доказанной эффективностью, что позволит задержать или отсрочить время появления осложнений заболевания, улучшить прогноз и повысить качество жизни пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.