Практика сахароснижающей фармакотерапии: выбор оптимальной фиксированной комбинации
- Аннотация
- Статья
- Ссылки
- English
Современная стратегия терапии СД 2 типа направлена на достижение целевой гликемии, предупреждение развития и прогрессирования диабетических осложнений. Сложные патогенетические механизмы являются обоснованием проведения такой фармакотерапии, которая бы одновременно воздействовала на различные нарушения, обеспечивала эффективный сахароснижающий контроль и поддержание целевой гликемии по мере прогрессирования заболевания.
При неудовлетворительном контроле на фоне проводимой сахароснижающей терапии ее интенсификация осуществляется с помощью назначения рациональных комбинаций.
В статье рассматриваются преимущества фиксированных комбинаций. Обсуждаются возможности патогенетической терапии, связанные с применением фиксированных комбинаций метформина и производных сульфонилмочевины.
Современная стратегия терапии СД 2 типа направлена на достижение целевой гликемии, предупреждение развития и прогрессирования диабетических осложнений. Сложные патогенетические механизмы являются обоснованием проведения такой фармакотерапии, которая бы одновременно воздействовала на различные нарушения, обеспечивала эффективный сахароснижающий контроль и поддержание целевой гликемии по мере прогрессирования заболевания.
При неудовлетворительном контроле на фоне проводимой сахароснижающей терапии ее интенсификация осуществляется с помощью назначения рациональных комбинаций.
В статье рассматриваются преимущества фиксированных комбинаций. Обсуждаются возможности патогенетической терапии, связанные с применением фиксированных комбинаций метформина и производных сульфонилмочевины.


Введение
Сахарный диабет (СД) относится к категории социально значимых неинфекционных заболеваний. При этом лидирует численность пациентов с СД 2 типа, что подтверждает необходимость поиска более эффективных стратегий его профилактики и лечения [1–3]. Помимо стремительного роста заболеваемости актуальность проблемы обусловлена поздней диагностикой СД 2 типа, который долгое время может протекать бессимптомно. У многих пациентов ранние нарушения углеводного обмена, как правило, имеют место за 10–12 лет до установления клинического диагноза [4, 5]. В течение этого периода времени гипергликемия и сопутствующие факторы сердечно-сосудистого риска (избыточный вес, артериальная гипертензия, дислипидемия) способствуют повышению бремени осложнений [6–8].
В связи с высокой смертностью среди пациентов, главным образом вследствие сердечно-сосудистых заболеваний (ССЗ), большим количеством осложнений, преждевременной инвалидизацией СД 2 типа также представляет серьезную социально-экономическую проблему [7–9]. Наличие СД 2 типа влечет за собой снижение качества жизни, необходимость пожизненной фармакотерапии и постоянного контроля гликемии. В настоящее время не менее 12% общемировых затрат на здравоохранение приходятся на долю СД [10, 11]. Стоимость лечения заболевания повышается в среднем в три – десять раз при присоединении диабетических осложнений [12], которые, однако, можно предотвратить при помощи надлежащего гликемического контроля [3, 13]. Поэтому недуг является тяжелым экономическим бременем как для самих пациентов с СД, так и для системы здравоохранения и государства и одним из серьезных препятствий на пути устойчивого экономического развития страны [14, 15].
Современная стратегия лечения СД 2 типа направлена на достижение целевой гликемии, предупреждение развития и прогрессирования его осложнений – основной причины ранней инвалидизации, снижения качества жизни и высокой смертности [3, 16, 17].
Хроническая гипергликемия, как ведущий фактор развития диабетических осложнений, требует эффективного контроля с достижением целевых метаболических показателей уже с момента диагностики заболевания.
Достигнутые успехи в области диабетологии в значительной мере обусловлены внедрением в клиническую практику современных алгоритмов ведения пациентов с СД 2 типа, в которых приоритетом при выборе терапевтических средств являются их эффективность, безопасность, способность влиять на клинические исходы, массу тела, а также стоимость и предпочтения пациента [3, 5, 16, 17].
В действующих российских клинических рекомендациях подчеркивается важность выбора индивидуальных целей лечения в зависимости от возраста пациента, ожидаемой продолжительности жизни, функциональной зависимости, наличия атеросклеротических сердечно-сосудистых заболеваний (АССЗ) и риска тяжелой гипогликемии (табл. 1) [16].
Стратегия сахароснижающей терапии с акцентом на персонифицированном подходе
Сложные патогенетические механизмы СД 2 типа являются обоснованием фармакотерапии с одновременным воздействием на различные нарушения, что обеспечит больший сахароснижающий потенциал и поддержание эффективного контроля гликемии по мере прогрессирования процесса [3, 5, 18]. Так, в дополнение к основным ключевым дефектам (резистентности к инсулину, дисфункции β-клеток) СД 2 типа присущи нарушение функции α-клеток, дефицит продукции и/или резистентность к инкретинам, вырабатываемым в желудочно-кишечном тракте (ЖКТ), ускоренный липолиз в жировой ткани, повышение реабсорбции глюкозы в почках и резистентность к инсулину в мозге, нарушение кишечной микробиоты, хроническое воспаление (рис. 1) [18].
В настоящее время у клиницистов есть широкий выбор сахароснижающих препаратов (ССП) с доказанной эффективностью и хорошей переносимостью. ССП представлены несколькими основными группами: пероральные – бигуаниды (метформин (МЕТ)), производные сульфонилмочевины (ПСМ), тиазолидиндионы, глиниды (ГЛН), ингибиторы дипептидилпептидазы 4 (иДПП-4), ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2), инъекционные – агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1), инсулин. Однако многие из них, по-видимому, не способны замедлить прогрессирующую потерю функции β-клеток [19].
При инициации лечения может быть выбрана монотерапия, если значения гликированного гемоглобина (HbA1c) находятся в целевом диапазоне или превышают его менее чем на 1,0% [16].
Ввиду прогрессирующего характера течения СД 2 типа поддержание целевых показателей гликемии с помощью монотерапии возможно только в течение нескольких лет, после чего требуется назначение комбинированной терапии.
Однако многим пациентам сразу необходимо назначать комбинированную терапию. Комбинация двух препаратов на старте сахароснижающей терапии рекомендуется, если уровень HbA1c превышает целевой на 1,0–2,5%. При превышении исходного значения HbA1c на 2,5% лечение необходимо начинать с комбинации двух или даже трех препаратов. Инсулинотерапия показана при выраженных симптомах декомпенсации СД 2 с возможностью отмены в дальнейшем [16].
В современных алгоритмах лечения СД 2 типа основной акцент делается на назначении приоритетных ССП с доказанными кардио- и ренопротективными эффектами – иНГЛТ-2 и арГПП-1 [16, 17]. При наличии противопоказаний или при плохой их переносимости, а также при необходимости интенсификации лечения из-за неудовлетворительного контроля гликемии возможно применение других препаратов с учетом безопасности/нейтральности в отношении доминирующей клинической проблемы. В частности, при выборе ССП в зависимости от доминирующей клинической проблемы необходимо помнить, что применение ПСМ безопасно (нейтрально) при высоком риске развития АССЗ (возраст ≥ 55 лет с наличием стеноза коронарных, каротидных артерий или артерий нижних конечностей или гипертрофии левого желудочка), при наличии АССЗ (не рекомендован глибенкламид), хронической болезни почек (ХБП) (до ХБП С4 включительно, глибенкламид не рекомендован при скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м²). В случае хронической сердечной недостаточности ПСМ назначают с осторожностью (не рекомендован глибенкламид) [16].
При неудовлетворительном контроле на фоне проводимой сахароснижающей терапии интенсификация осуществляется путем выбора рациональных комбинаций.
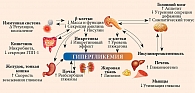
Согласно анализу структуры терапии СД 2 типа в РФ [1], преобладало назначение ССП – у 76,2% пациентов, при этом преимущественно в виде монотерапии – 44,1%. Комбинацию двух ССП получали 28,9%, трех СПП – 3,2% (рис. 2). Наиболее частыми двойными комбинациями были «МЕТ + ПСМ» (82,9%), «МЕТ + иДПП-4» (11,7%). На другие комбинации приходилась небольшая доля случаев: на «МЕТ + иНГЛТ-2» – 2,7%, на «ПСМ + иДПП-4» – 1,8%, на «МЕТ + арГПП-1» – 0,1%. Доля новых классов препаратов возросла в составе тройных комбинаций, при этом преимущественно с ПСМ и МЕТ: «МЕТ + ПСМ + иДПП-4» – 63,7%, «МЕТ + ПСМ + иНГЛТ-2» – 23,5%, «МЕТ + иДПП-4 + иНГЛТ-2» – 6,3%.
Вопросы приверженности терапии и возможности ее повышения
Несмотря на широкий выбор сахароснижающих препаратов, на практике компенсация углеводного обмена представляет значительную проблему.
Многие пациенты с СД 2 типа не достигают целевого уровня HbA1c. Среди причин неудовлетворительного контроля заболевания следует отметить клиническую инертность, несвоевременную интенсификацию фармакотерапии, использование сложных схем лечения и др. [20, 21]. Полипрагмазия также способствует снижению комплаентности больных СД 2 типа. Нередко сопутствующая патология (артериальная гипертензия, ишемическая болезнь сердца, дислипидемия, гиперурикемия и др.) обусловливает необходимость использования препаратов разных фармакологических групп. Все это побуждает искать новые и оптимизировать существующие фармакологические подходы для улучшения результатов терапии СД 2 типа, клинических исходов.
Напрямую с клиническими исходами заболевания связана приверженность лечению, которая зависит от многих факторов, ассоциированных как с самим пациентом, так и с врачом, организацией системы здравоохранения, лекарственными средствами [20–22]. Среди факторов, негативно влияющих на приверженность лечению больных СД 2 типа, наибольшее значение придается высокой стоимости лечения (20,5%), сложности терапии или режиму приема препаратов (15,8%) [23]. Низкая приверженность пациентов терапии препятствует достижению целевой гликемии, приводит к прогрессированию заболевания, развитию осложнений, повышению частоты госпитализаций и ухудшению исходов [22, 24, 25].
В российском исследовании ФОРСАЙТ-СД 2 с участием 2014 больных СД 2 типа ведущим барьером на пути выполнения рекомендаций врача была высокая стоимость лечения (24,2%). На втором месте стояли пропуск приема препарата в связи с развитием нежелательных явлений (20,9%) и забывчивость (20,5%) [26]. На сложность терапии или режима приема препаратов указали около 16% пациентов. Фармакоэпидемиологический анализ приема препаратов показал, что ежедневно больные должны были принимать в среднем четыре препарата. Это позволило авторам считать, что коморбидность и необходимость постоянного приема различных препаратов относятся к наиболее значимым барьерам на пути достижения приверженности лечению.
В связи со сказанным ранее важнейшим этапом на пути совершенствования стратегии фармакотерапии СД 2 типа стало создание фиксированных комбинаций (ФК) ССП, значительно улучшающих приверженность пациентов и эффективность контроля гликемии. Эта опция может быть особенно полезна у пациентов, принимающих несколько лекарственных средств [27–29].
Потенцирование фармакологических эффектов за счет воздействия компонентов ФК на разные патогенетические механизмы СД 2 типа приводит к усилению клинико-фармакологических эффектов и, соответственно, к улучшению клинических исходов [29–30].
Наряду с повышением терапевтического эффекта применение ФК позволяет до минимума снизить побочное действие ее компонентов за счет использования их в меньших дозах.
Нельзя не отметить и важные фармакоэкономические преимущества ФК – уменьшение стоимости лечения [27].
Как следствие, на сегодняшний день ФК получают все более широкое распространение в клинической практике. При этом наиболее популярной и часто назначаемой является комбинация на основе МЕТ и ПСМ, которые долгое время используются в лечении СД 2 типа и хорошо известны практическим врачам [31, 32].
Фиксированные комбинации метформина и производных сульфонилмочевины
Применение комбинации МЕТ и ПСМ обосновано не только с точки зрения воздействия на фундаментальные механизмы развития СД 2 типа [31]. Данные препараты остаются одними из высокоэффективных сахароснижающих средств: снижают HbA1c на 1,0–2,0%, вариабельность снижения определяется его уровнем до начала лечения [16, 32].
Целесообразность применения комбинации МЕТ и ПСМ продемонстрирована во многих клинических исследованиях, результаты которых также позволили выявить ряд ее преимуществ [13, 32, 33].
В настоящее время в отношении ФК низкодозированных глибенкламида и метформина собрана достаточная доказательная база [31, 32–35]. Они представляют собой оптимальное сочетание ССП, обеспечивающих патогенетический подход к лечению СД 2 типа.
Применение ФК «глибенкламид + метформин» способствует улучшению терапевтических результатов, ассоциируется с лучшей приверженностью и удовлетворенностью лечением, низкой стоимостью лечения, в том числе благодаря эффективности в более низких дозах по сравнению с их нефиксированными комбинациями [32, 36, 37]. На фоне терапии ФК «глибенкламид + метформин» при более высоком исходном уровне HbA1c отмечено и его большее снижение – от 1,3 до 2,4% [38, 39].
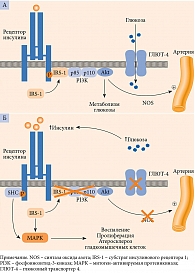
Фармакологические эффекты МЕТ обусловлены несколькими механизмами, не связанными со стимуляцией секреции инсулина β-клетками и направленными на улучшение чувствительности органов и тканей к инсулину, что позволяет устранить отрицательные последствия инсулинорезистентности (рис. 3) [35, 40]. Благодаря значимым преимуществам МЕТ остается одним из приоритетных препаратов в терапии СД 2 типа при условии отсутствия противопоказаний к его приему (табл. 2).
Ингибирование продукции глюкозы в печени за счет повышения чувствительности печени к инсулину – ключевой механизм, с помощью которого метформин снижает уровень глюкозы в крови [3, 16]. Препарат ингибирует комплекс I дыхательной цепи митохондрий гепатоцитов, что приводит к активации аденозинмонофосфат-протеинкиназы и в последующем к подавлению экспрессии аденозинмонофосфат-стимулированных генов основных ферментов глюконеогенеза. В результате реализуются другие не менее важные метаболические эффекты – снижение синтеза триглицеридов из жирных кислот, угнетение β-окисления в митохондриях, уменьшение экспрессии фактора некроза опухоли α (ФНО-α) и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А [35, 41]. Как следствие, метформин не только повышает чувствительность тканей к инсулину, но и уменьшает эффекты липотоксичности на всех уровнях, включая печень, жировую и мышечную ткани, островки Лангерганса [35, 40, 42].
Действуя на уровне ЖКТ, метформин замедляет скорость всасывания углеводов, а также влияет на гомеостаз глюкозы посредством повышения концентрации ГПП-1, что, по-видимому, обусловлено активацией Wnt-сигнальных путей в L-клетках ЖКТ, стимуляцией экспрессии генов, кодирующих рецепторы ГПП-1, и увеличением экспрессии генов белков-предшественников – пре- и проглюкагона [35, 41].
Инсулинорезистентность не только отличительный признак СД 2 типа, но и независимый фактор сердечно-сосудистого риска [4, 5, 40], что представлено на рис. 4. Метформин препятствует развитию резистентности к инсулину и, следовательно, уменьшает выраженность атерогенных эффектов инсулинорезистентности.
Накапливается все больше данных и о других механизмах кардиопротекции метформина. Речь, в частности, идет о влиянии на метаболизм липидов, систему гемостаза, реологию крови, функцию эндотелия, кардиомиоцитов и гладкомышечных клеток сосудов. Длительное лечение препаратом связано со значительным снижением риска развития сердечно-сосудистой патологии [35, 43, 44]. Подобные эффекты очень важны для улучшения клинических исходов у больных СД 2 типа.
Следует также учитывать, что назначение метформина безопасно у пациентов с хронической сердечной недостаточностью при стабильной расчетной СКФ > 30 мл/мин/1,73 м² [16].
Эффекты метформина усиливает глибенкламид. ПСМ сохранили свои позиции в международных алгоритмах лечения благодаря высокой эффективности, быстрому достижению сахароснижающего эффекта, невысокой цене, определяющей доступность препаратов данной группы [31, 34, 41, 45]. Эффективность и безопасность ПСМ продемонстрированы в многочисленных клинических исследованиях, в частности UKPDS (десятилетний период наблюдения), ADOPT и LAMBDA [34, 46, 47].
Высокая сахароснижающая активность глибенкламида объясняется особенностями химической структуры: наличие не только сульфонилмочевинной, но и бензамидной групп. Поэтому, взаимодействуя с двумя связывающими местами β-клеточных рецепторов, глибенкламид способствует быстрому закрытию АТФ-зависимых К+-каналов, стимулирует деполяризацию мембраны, активирует Ca-каналы. В результате увеличивается приток Ca внутрь β-клеток, концентрация внутриклеточного Са2+ и, следовательно, секреция эндогенного инсулина, особенно в присутствии глюкозы. Периферическое (экстрапанкреатическое) действие препарата, по-видимому, вторично и обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает угнетение гепатической продукции глюкозы и улучшение ее утилизации периферическими тканями, однако собственные экстрапанкретические эффекты убедительно не доказаны [34, 44].
К основным недостаткам ПСМ относят способность вызывать гипогликемии и прибавку массы тела [3, 31, 34]. В связи с этим вопросы безопасности терапии ПСМ остаются злободневными.
При применении любого ПСМ существует меньший или больший риск развития гипогликемий, связанных с нарушением режима питания, нефизиологическими ограничениями в питании, чрезмерной физической нагрузкой.
Применение низких доз глибенкламида в ФК минимизирует риск развития нежелательных эффектов, что позволяет достигать более эффективного контроля гликемии при меньшем риске гипогликемий. Это также повышает экономическую эффективность лечения [3, 31, 48, 49].
Препарат Глибомет компании «Берлин-Хеми/А. Менарини» представляет собой комбинацию метформина в дозе 400 мг и глибенкламида в дозе 2,5 мг в одной таблетке.
Начальная доза препарата, как правило, составляет одну-две таблетки в день. При необходимости дозу корригируют каждые одну-две недели после начала лечения в зависимости от уровня глюкозы. Оптимальным считается прием два раза в день (утром и вечером) во время еды.
Противопоказание метформина и глибенкламида является также противопоказанием для назначения их фиксированной комбинации.
Заключение
Одной из стратегий сахароснижающей терапии, направленной на улучшение приверженности пациентов лечению и повышение терапевтической эффективности, признается использование ФК.
Применение ФК МЕТ и ПСМ в реальной клинической практике может обеспечить хороший гликемический контроль и дополнительное фармакоэкономическое преимущество в виде уменьшения стоимости лечения.
Ye.V. Biryukova, MD, PhD, Prof., Yu.A. Shishkova, PhD, M.V. Shinkin
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Yelena V. Biryukova, lena@obsudim.ru
Type 2 diabetes mellitus is a global medical and social problem, associated not only with epidemic rates of morbidity growth, but also with the development of chronic complications leading to early disability and the unfavorable prognosis. The presence of type 2 diabetes entails the decrease in the quality of life, the need for lifelong pharmacotherapy and constant monitoring of glycemia. The addition of diabetic complications significantly increases the cost of treatment.
The current strategy for the treatment of type 2 diabetes is aimed at achieving the target glycemia, preventing the development and progression of diabetic complications. Complex pathogenetic mechanisms of the disease are the rationale for conducting such pharmacotherapy, which would simultaneously affect various disorders, provide effective hypoglycemic control and maintenance of target glycemia as the process progresses.
With unsatisfactory control of pathology against the background of ongoing hypoglycemic therapy, its intensification is carried out by prescribing rational combinations.
The article discusses the advantages of fixed combinations. The possibilities of pathogenetic therapy associated with the use of fixed combinations of metformin and sulfonylurea derivatives are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.