Предиабет – актуальная медико-социальная проблема современности
- Аннотация
- Статья
- Ссылки
- English
В статье обсуждаются факторы риска развития нарушений углеводного обмена. Актуализируется проблема ожирения, вклад нарушения адипогенеза в формирование инсулинорезистентности. Рассматриваются вопросы патогенеза, скрининга и терапии предиабета.
Основная цель лечения предиабета заключается в профилактике развития СД 2 типа и сердечно-сосудистых осложнений. Для этого у пациентов с ранними нарушениями углеводного обмена применяются немедикаментозные и медикаментозные методы терапии. К медикаментозным методам прежде всего следует отнести метформин. Механизм действия метформина включает снижение продукции глюкозы печенью, увеличение чувствительности периферических тканей к инсулину, утилизации глюкозы периферическими тканями, уменьшение окисления жирных кислот и всасывания углеводов в кишечнике.
В статье обсуждаются факторы риска развития нарушений углеводного обмена. Актуализируется проблема ожирения, вклад нарушения адипогенеза в формирование инсулинорезистентности. Рассматриваются вопросы патогенеза, скрининга и терапии предиабета.
Основная цель лечения предиабета заключается в профилактике развития СД 2 типа и сердечно-сосудистых осложнений. Для этого у пациентов с ранними нарушениями углеводного обмена применяются немедикаментозные и медикаментозные методы терапии. К медикаментозным методам прежде всего следует отнести метформин. Механизм действия метформина включает снижение продукции глюкозы печенью, увеличение чувствительности периферических тканей к инсулину, утилизации глюкозы периферическими тканями, уменьшение окисления жирных кислот и всасывания углеводов в кишечнике.




Нарушения углеводного обмена, спектр которых включает нарушенную толерантность к глюкозе (НТГ), нарушение гликемии натощак (НГН) или их сочетание, сахарный диабет (СД) 2 типа, привлекают все больше внимания клиницистов.
Любое из ранних нарушений гликемии обозначают термином «предиабет».
Число лиц с ранними нарушениями значительно превышает число больных СД 2 типа [1]. Ежегодно у 4–9% пациентов НТГ переходит в СД 2 типа [2]. Примерно у 25% лиц с предиабетом в течение трех – пяти лет, а у 70% – в течение жизни разовьется СД 2 типа [3, 4]. Результаты исследования NATION продемонстрировали, что почти у одной пятой населения России имеет место предиабет (19,3% участников (5128/26 620; 95%-ный доверительный интервал (ДИ) 18,8–19,7%)) [5]. Высокая распространенность предиабета в России создает предпосылки для дальнейшего роста заболеваемости СД 2 типа и сердечно-сосудистой патологией. Необходимо отметить, что вклад предиабета в развитие сердечно-сосудистых заболеваний пока остается недооцененным.
Предиабет повышает риск развития многих патологий, ассоциированных с хронической гипергликемией, таких как диабетическая ретинопатия, нейропатия, нефропатия и макрососудистые осложнения. Роль гипергликемии в инициировании повреждения сосудистой стенки и прогрессировании сердечно-сосудистых заболеваний имеет обширную доказательную базу [6–8]. В частности, анализ результатов 53 проспективных когортных исследований (n = 1 611 339, медиана наблюдения – 9,5 года) выявил, что предиабет связан со значимым возрастанием риска развития сердечно-сосудистых заболеваний в целом (отношение шансов (ОШ) 1,13–1,30), ишемической болезни сердца (ОШ 1,10–1,20), инсульта (ОШ 1,06–1,20) и общей смертности (ОШ 1,13–1,32) по сравнению с нормогликемией [6]. В исследовании MESA десятилетний период наблюдения за 6000 участниками показал, что предиабет сопровождается трехкратным увеличением риска развития инфаркта миокарда по сравнению с нормогликемией [8].
К сожалению, 90% лиц с предиабетом не знают о наличии у себя патологии.
В настоящее время установлены как модифицируемые, так и немодифицируемые факторы риска развития предиабета и СД 2 типа [9]:
- возраст ≥ 45 лет;
- избыточная масса тела и ожирение (индекс массы тела (ИМТ) ≥ 25 кг/м2);
- отягощенный семейный анамнез – родители или сибсы с СД 2 типа;
- привычно низкая физическая активность;
- НГН или НТГ в анамнезе;
- гестационный СД или рождение крупного плода в анамнезе;
- артериальная гипертензия (≥ 140/90 мм рт. ст. или медикаментозная антигипертензивная терапия);
- уровень холестерина липопротеинов высокой плотности ≤ 0,9 ммоль/л и/или уровень триглицеридов ≥ 2,82 ммоль/л;
- синдром поликистозных яичников;
- наличие сердечно-сосудистых заболеваний.
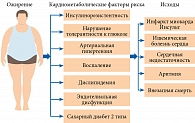
Ключевым фактором риска нарушений углеводного обмена является избыточная масса тела или ожирение, особенно в случае отложения жира в висцеральных депо, которые также ассоциируются с артериальной гипертензией, дислипидемией, сердечно-сосудистыми заболеваниями и др. (рис. 1) [10]. Считается, что эпидемический рост заболеваемости СД 2 типа за последние десятилетия связан с повсеместным увеличением доли населения с избыточным весом или ожирением. Согласно результатам исследования NATION, количество участников с предиабетом и СД 2 типа увеличивалось по мере повышения ИМТ [5]. В частности, в группе лиц с ИМТ < 25 кг/м2 распространенность СД 2 типа и предиабета составила 1,1 и 7,4% соответственно, в группе лиц с ИМТ ≥ 25 и < 30 кг/м2 (с избыточной массой тела) – 3,9 и 18,6%, в группе лиц с ИМТ ≥ 30 кг/м2 (с ожирением) – 12,0 и 33,1% [5]. Гендерные различия в отношении распространенности нарушений углеводного обмена отсутствовали [5].
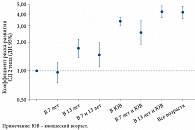
К сожалению, появляется все больше данных о резком увеличении встречаемости избыточного веса или ожирения среди подростков [11]. Так, согласно результатам когортного исследования с включением 62 565 лиц детского, подросткового и юношеского возраста, среди которых у 10,7% был диагностирован СД 2 типа (в течение 1 969 165 человеко-лет наблюдения), повышенный ИМТ был связан с более высоким риском развития СД 2 типа во взрослой жизни [12]. Имевшие избыточный вес в пубертатно-юношеском периоде чаще в будущем заболевали СД 2 типа (рис. 2). При этом избыточная масса тела в период полового созревания и юношества была связана с более высоким риском развития СД 2 типа, чем таковая в юношеском возрасте.
По мере накопления жира не только увеличиваются размер и количество адипоцитов, но и изменяется их функциональная активность. Нарушение адипогенеза приводит к тому, что гипертрофированные жировые клетки в избытке секретируют адипоцитокины, включая фактор некроза опухолей α (ФНО-α), интерлейкины (ИЛ) 6 и 8, моноцитарный хемоаттрактантный протеин 1, С-реактивный белок, воздействующие на различные метаболические и гемодинамические процессы, в частности на метаболизм глюкозы, чувствительность тканей к инсулину, системное воспаление, эндотелиальную функцию [13]. При избытке жировой ткани секреция адипоцитокинов, повышающих чувствительность тканей к инсулину, например адипонектина и оментина, снижается. В то же время секреция адипокинов, способствующих возникновению инсулинорезистентности (ИР), повышается. Речь, в частности, идет о резистине и вистафине. Выраженность ИР возрастает параллельно с накоплением жировой массы [14].
Инструментальные исследования, такие как компьютерная и магнитно-резонансная томография, позволили более детально изучить топографию жировой ткани. В настоящее время выделяют подкожную жировую ткань и висцеральную жировую ткань (ВЖТ). Последняя расположена вокруг внутренних органов, и ее количество увеличивается с возрастом не только абсолютно, но и относительно [15, 16]. Анатомо-топографические и метаболические особенности ВЖТ по сравнению с подкожной жировой тканью признаны определяющими в развитии ИР. Так, ВЖТ лучше иннервирована, имеет большее количество адипоцитов на единицу массы, более широкую сеть капилляров, обильную иннервацию и непосредственное сообщение с портальной системой [15–17]. Важно отметить, что многие адипоцитокины, экспрессия которых более всего выражена в адипоцитах ВЖТ, играют существенную роль в формировании ИР и ее различных проявлений.
Увеличение объема висцеральных адипоцитов приводит к изменению конформации молекулы инсулинового рецептора, нарушению процессов связывания рецептора с инсулином, а также передачи сигнала от рецептора инсулина к мишеням инсулина во внутриклеточных инсулинозависимых сигнальных каскадах по механизму отрицательной обратной связи [18–20]. При нарушенном адипогенезе большинство секретируемых адипоцитокинов ухудшают чувствительность тканей к инсулину путем активации таких киназ, как NF-κB (nuclear factor κ-light-chain-enhancer activated B cells), IKK (inhibitor κB kinase) и JNK (c-jun N-terminal kinase) [21]. Указанные киназы используют субстрат инсулинового рецептора как один из субстратов. Они фосфорилируют его по нескольким сериновым остаткам, переводя в неактивное состояние и таким образом прерывая передачу сигнала по инсулиновому каскаду. Наряду с цитокинами провоспалительным воздействием также обладают свободные жирные кислоты (СЖК), уровень которых значительно возрастает при висцеральном ожирении [14]. СЖК запускают тот же воспалительный каскад с участием NF-κB, IKK и JNK. Провоспалительные цитокины, продуцируемые жировой тканью, и СЖК цитотоксичны для β-клеток поджелудочной железы.
Существует тесная связь между хроническим метавоспалением жировой ткани и нарушением чувствительности к инсулину [21, 22]. На фоне нарушенного адипогенеза происходит активное накопление макрофагов вследствие рекрутирования из сосудистого русла (макрофаги-рекруты) в жировую ткань [13, 23]. При ожирении изменяются фенотипические и функциональные характеристики макрофагов. Гипертрофия адипоцитов в сочетании со снижением васкуляризации жировой ткани вследствие несовершенного ангиогенеза вызывает гипоксию. В результате происходит гибель жировых клеток путем апоптоза и ишемического некроза. В ответ на этот процесс жировая ткань инфильтрируется активированными макрофагами-рекрутами (M1-фенотип), образующими короноподобные структуры вокруг погибших адипоцитов [13]. По мере прогрессирования ожирения происходит поляризация макрофагов в сторону преобладания провоспалительного М1-фенотипа (классически активированные), которые экспрессируют CD11c и вырабатывают провоспалительные цитокины ИЛ-6, ИЛ-1β, ФНО-α и др., что способствует активации локального и системного воспаления, нарушению сигнальных путей инсулина, особенно в ВЖТ [22, 24]. При этом продукция адипонектина, способствующего поляризации макрофагов в М2-направлении (антивоспалительный фенотип), при накоплении жира уменьшается.
Патофизиология нарушенной толерантности к глюкозе и нарушения гликемии натощак
Как уже подчеркивалось ранее, сопутствующие ИР ранние нарушения углеводного обмена, а именно НГН и НТГ, было предложено обозначить термином «предиабет», чтобы подчеркнуть высокий риск развития СД 2 типа в будущем у такой категории пациентов.
Риск перехода НТГ и НГН в СД 2 типа можно предотвратить с помощью модификации образа жизни и медикаментозной терапии, именно поэтому крайне необходима своевременная диагностика ранних нарушений углеводного обмена [25–27].
Предиабет – метаболическое состояние, достаточно разнородное как по патогенезу, так и по прогнозу.
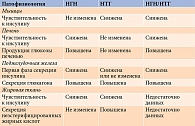
Предиабетические нарушения обусловлены количественным и/или качественным дефицитом инсулина на фоне нарушения действия инсулина в основных органах-мишенях [27]. Нарушение чувствительности тканей к инсулину – ключевой дефект при нарушении метаболизма глюкозы [28]. Переход от нормальной толерантности к глюкозе к нарушенной сопровождается повышением из-за нарастания ИР как базального, так и стимулированного глюкозой уровня инсулина, которого со временем становится недостаточно для поддержания нормальной утилизации глюкозы тканями [26, 29]. Нарушение адаптации островкового аппарата поджелудочной железы к повышенной потребности в инсулине проявляется НГН и НТГ [25]. Метаболические изменения на стадии НГН и НТГ представлены в табл. 1 [30].
В целом для лиц с НГН характерна резистентность к инсулину. При НТГ может наблюдаться более выраженный дефект β-клеток (рис. 3). Оба этих состояния различаются не только степенью, но и уровнем ИР. Так, лицам с изолированной НГН свойственна ИР печени, лицам с изолированной НТГ – нормальная или незначительно сниженная чувствительность к инсулину со стороны печени на фоне более выраженной ИР мышечной ткани [31–33]. Утрата β-клетками способности к адекватной секреции инсулина в ответ на ИР (дефицит ранней фазы секреции инсулина) при наличии определенных генетических факторов и других метаболических нарушений, в частности избытка СЖК и воспаления, приводит к развитию СД 2 типа [25, 33]. По мнению M. Hanefeld, одного из ведущих исследователей ИР и метаболического синдрома, НТГ и НГН примерно равнозначны в отношении риска развития СД 2 типа [32]. В то же время накапливается все больше данных о том, что НТГ в отличие от НГН обладает большей прогностической значимостью в отношении развития неблагоприятных сердечно-сосудистых исходов [34].
В последние годы активно обсуждается роль энтероинсулярной оси в поддержании гомеостаза глюкозы [34, 35]. Снижение эффектов инкретинов инициируется еще на стадии предиабета. Так, в исследованиях, проведенных у пациентов с впервые выявленными нарушениями углеводного обмена (НТГ и СД 2 типа), отмечено уменьшение концентрации глюкагоноподобного пептида 1 (ГПП-1) по сравнению с лицами контрольной группы. Однако при предиабете ее снижение было менее выраженным, чем при СД 2 типа [36, 37]. Описанное изменение может быть обусловлено нарушением секреции ГПП-1, ускоренным метаболизмом или нечувствительностью рецепторов-мишеней к инкретинам. Данный вопрос требует дальнейшего изучения и анализа. Полагают, что изменение бактериальных кишечных пропорций может приводить к развитию резистентности к ГПП-1 [38, 39].
Рекомендации по скринингу
У лиц с высоким риском развития нарушений углеводного обмена может быть выполнен любой из следующих скрининговых тестов:
- определение глюкозы плазмы натощак;
- проведение перорального глюкозотолерантного теста (ПГТТ);
- определение уровня гликированного гемоглобина (HbA1c).
Частота обследования для скрининга нарушений углеводного обмена представлена в табл. 2 [40].
Диагностические критерии СД и других нарушений гликемии представлены в табл. 3 [40].
Для диагностики нарушений углеводного обмена и СД 2 типа одобрено определение уровня HbA1c – интегрального показателя, который отражает средний уровень гликемии за предшествующие два-три месяца. Согласно рекомендациям экспертов Всемирной организации здравоохранения, уровень HbA1c от 6,0 до 6,4% не позволяет поставить какой-либо диагноз, но не исключает возможности диагностики диабета по уровню глюкозы в крови.
Согласно действующим российским клиническим рекомендациям, диагноз «предиабет» устанавливается на основании обнаружения НГН и/или НТГ [40]. Следует отметить, что при уровне HbA1c 6,0–6,4% целесообразно последующее проведение ПГТТ либо определение глюкозы плазмы натощак. Тем не менее данные показатели позволяют стратифицировать пациентов в группу наибольшего риска развития СД 2 типа. Для состояний, при которых имеет место изменение или нарушение скорости обновления эритроцитов, диагностика нарушений углеводного обмена должна проводиться с использованием критериев определения гликемии [40]. В данном случае речь идет о втором и третьем триместрах беременности, послеродовом периоде, дефиците глюкозо-6-фосфатдегидрогеназы, ВИЧ, гемодиализе, недавней кровопотере, переливании крови, терапии эритропоэтином, гемолитической или железодефицитной анемии.
Накапливается все больше доказательств высокой прогностической ценности HbA1c в определении не только риска прогрессирования предиабета в СД 2 типа, но и риска сердечно-сосудистых исходов [7, 8]. В этом отношении вызывает интерес метаанализ 16 исследований с участием 44 203 пациентов и средним периодом наблюдения 5,5 (2,8–12,0) года. При рассмотрении долгосрочного риска развития СД 2 типа установлена прямая связь с уровнем HbА1c. Так, пятилетний риск развития СД 2 типа оказался максимальным (25–50%) в диапазоне значений HbА1c от 6,0 до 6,5% [41].
Основные принципы профилактики развития сахарного диабета 2 типа
Особого внимания заслуживает активное выявление групп риска развития СД 2 типа и осуществление немедикаментозных и медикаментозных вмешательств.
Основой лечения НТГ и/или НГН и профилактики СД 2 типа является модификация образа жизни посредством диетотерапии и дозированной физической нагрузки [41–43].
При выборе цели по снижению массы тела в долгосрочной перспективе необходимо учитывать ассоциированные с предиабетом состояния (метаболический синдром, дислипидемию, артериальную гипертензию, неалкогольную жировую болезнь печени, синдром поликистозных яичников, ночное апноэ). Ожидаемое снижение массы тела составляет 5–15% и более в зависимости от сопутствующей патологии. Таковое достигается за счет соблюдения умеренного гипокалорийного питания с преимущественным ограничением потребления легкоусвояемых (простых) углеводов и насыщенных жиров, а также за счет регулярной физической активности умеренной интенсивности [43].
Согласно российским алгоритмам специализированной помощи пациентам с СД, им показана регулярная физическая активность длительностью не менее 30 минут в день в большинство дней недели, или не менее 150 минут в неделю. Физическая нагрузка подбирается индивидуально с учетом возраста больного, исходной физической формы, наличия сопутствующих патологий и переносимости [40].
Существующие рекомендации по профилактике развития СД 2 типа основываются на данных клинических исследований. Неоспоримую ценность представляют результаты исследования DPP и исследования DPPOS, являющегося продолжением исследования DPP [44, 45]. В частности, получены убедительные данные о том, что интенсивное изменение образа жизни эффективно в отношении снижения прогрессирования НТГ в СД 2 типа независимо от уменьшения массы тела. Напомним, что поведенческие вмешательства в рамках этого исследования подразумевали проведение индивидуальных учебных занятий (в последующем – ежемесячные индивидуальные или групповые занятия), соблюдение низкокалорийной диеты с ограничением жиров и выполнение физических упражнений в течение хотя бы 150 минут в неделю.
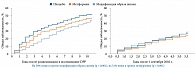
В конце трехлетнего периода наблюдения за участниками исследования DPP у рандомизированных в группу интенсивного изменения образа жизни вероятность развития СД 2 типа оказалась на 58% меньше, чем в группе плацебо (рис. 4). Об устойчивости полученных результатов свидетельствовало то, что спустя 15 лет степень достигнутого улучшения составляла 30%. В исследовании DPP применение метформина по сравнению с использованием плацебо способствовало снижению риска развития СД 2 типа на 31%. Однако эффективность немедикаментозных вмешательств превзошла влияние метформина в отношении профилактики СД 2 типа.
Несмотря на доказанную пользу модификации образа жизни, его значимой проблемой является недостаточная приверженность пациентов как к соблюдению диеты, так и к выполнению физических упражнений на длительной регулярной основе. Именно поэтому ведение пациентов с предиабетом предполагает присоединение к коррекции питания и физической активности фармакотерапии. Наряду с метформином в арсенал клиницистов входят ингибиторы α-глюкозидазы, тиазолидиндионы, орлистат, которые доказали свою эффективность в снижении риска развития СД 2 типа в долгосрочных клинических исследованиях (табл. 4) [46, 47].
В большинстве опубликованных клинических рекомендаций метформин (препарат Сиофор) занимает лидирующую позицию среди медикаментозных средств при предиабете. Его назначают с целью профилактики развития СД 2 типа при неэффективности мероприятий по изменению образа жизни [40, 42, 46].
Общепринятый механизм действия метформина включает снижение продукции глюкозы печенью, увеличение чувствительности периферических тканей к инсулину, утилизации глюкозы периферическими тканями, уменьшение окисления жирных кислот и всасывание углеводов в кишечнике. Целенаправленное воздействие на ИР позволяет улучшить тканевую чувствительность к инсулину [47].
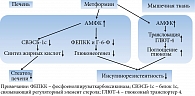
Важно, что механизм действия метформина не связан со стимуляцией выработки инсулина β-клетками поджелудочной железы. Это результат влияния препарата на чувствительность к инсулину на уровне печени, мышечной и жировой тканей при преобладающем эффекте на гепатическую продукцию глюкозы. Молекулярной мишенью метформина является аденозинмонофосфат-активируемая протеинкиназа (АМФК) – ключевой фермент клеточного метаболизма и энергетического баланса [48]. Считается, что ингибирование продукции глюкозы в печени может быть опосредовано подавлением дыхательного комплекса I митохондрий, повышением уровня 5'-аденозинмонофосфата (АМФ) и активацией АМФК, что способствует восстановлению энергетического гомеостаза, угнетению глюконеогенеза в печени, повышению чувствительности к инсулину с одновременным улучшением утилизации глюкозы на периферии (рис. 5) [31, 49, 50].
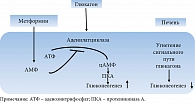
Супрессия митохондриального дыхательного комплекса I метформином подавляет глюконеогенез и за счет угнетения передачи сигналов глюкагона вследствие инактивации аденилатциклазы (рис. 6) [32, 50]. Применение метформина сопровождается уменьшением экспрессии гена, индуцирующего образование глюкозы из неуглеводных соединений, путем фосфорилирования циклического аденозинмонофосфата (цАМФ, cAMP) – коактиватора транскрипционного фактора CREB-протеина (cAMP response element-binding protein), а также подавления поступления субстратов глюконеогенеза в печень и активности ключевых энзимов глюконеогенеза (пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы (Г-6-Ф)) [47, 51–54].
Эффекты метформина способствуют улучшению метаболизма глюкозы и чувствительности к инсулину клеток печени, а в конечном итоге – улучшению гликемического контроля.
Важное следствие активации АМФК – снижение синтеза триглицеридов из жирных кислот, подавление митохондриального β-окисления, снижение экспрессии ФНО-α и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А, что означает уменьшение последствий липотоксичности [47, 55].
Под влиянием метформина в инсулинзависимых тканях происходит стимуляция экспрессии и активности транспортеров, увеличиваются транспортная емкость мембранных переносчиков глюкозы, их количество и транслокация из внутриклеточного пула на клеточную мембрану, активирование пострецепторных механизмов действия инсулина, в частности тирозинкиназы и фосфотирозин фосфатазы, утилизация глюкозы скелетными мышцами и жировой тканью [50, 55].
Механизмы действия метформина продолжают изучаться.
Эффекты препарата частично реализуются через желудочно-кишечный тракт – прямое воздействие на поглощение и метаболизм глюкозы, прямое или косвенное влияние на секрецию ГПП-1 и микробиом [56, 57].
Метформин замедляет скорость всасывания и повышает утилизацию глюкозы, что улучшает контроль постпрандиальной гликемии [56]. Увеличение концентрации ГПП-1, по-видимому, обусловлено активацией Wnt-сигнальных путей в L-клетках желудочно-кишечного тракта и экспрессии генов, кодирующих рецепторы ГПП-1, повышением экспрессии генов белков-предшественников – преглюкагона и проглюкагона, а также уменьшением метаболизма ГПП-1 под воздействием ингибиторов дипептидилпептидазы 4 [47]. Получены также данные, позволяющие предположить, что метформин может стимулировать секрецию ГПП-1 посредством изменения метаболизма желчных кислот. Препарат способен оказывать потенциальное воздействие на пул желчных кислот через фарнезоидный рецептор – ключевой регулятор метаболизма глюкозы и липидов [56, 57].
Метформин препятствует развитию резистентности к инсулину и, следовательно, уменьшает выраженность ее атерогенного влияния, что в совокупности с потенциальными кардиопротективными эффектами делает его привлекательной опцией у пациентов с предиабетом для уменьшения риска возникновения сердечно-сосудистых событий [58].
Несмотря на указание в клинических рекомендациях по лечению предиабета на необходимость применять эффективные профилактические вмешательства для предотвращения развития СД 2 типа, включая использование метформина, частота его назначений остается низкой [59, 60].
Для профилактики СД 2 типа у лиц с предиабетом рекомендованная доза метформина составляет 1000–1700 мг/сут, при этом ее следует разделить на два приема и принимать после или во время приема пищи [42, 46, 61]. В качестве стартовой дозы метформина обычного высвобождения рекомендована доза 850 мг/сут во время ужина в течение первой недели. Со второй недели ее увеличивают до 850 мг два раза в сутки (во время завтрака и ужина). С целью снижения риска развития нежелательных явлений со стороны желудочно-кишечного тракта терапию можно начинать с дозы 500 мг/сут в течение первой недели (во время последнего приема пищи) с последующим ее увеличением до 850 мг два раза в сутки к концу первого месяца терапии. При непереносимости метформина обычного высвобождения или низкой приверженности пациента лечению по причине кратности приема (два раза в день) целесообразно назначение метформина пролонгированного действия в дозе 750 мг (по две таблетки во время ужина).
В заключение следует отметить, что предиабет – широко распространенное нарушение углеводного обмена, медико-социальная важность которого определена негативным влиянием на показатели заболеваемости СД 2 типа и сердечно-сосудистой патологией. Своевременная диагностика, модификация образа жизни и эффективная фармакотерапия являются эффективными мерами профилактики развития СД 2 типа у лиц с НТГ и НГН.
E.V. Biryukova, MD, PhD, Prof., M.V. Shinkin, A.A. Starshinova
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Yelena V. Biryukova, lena@obsudim.ru
Prediabetes is an acute medical and social problem. Prediabetes includes any of early glycemic disorders, such as impaired fasting glycemia and impaired glucose tolerance. The high prevalence of prediabetes creates prerequisites for the further increase in the incidence of type 2 diabetes mellitus (DM) and cardiovascular pathology in Russia.
The article discusses the risk factors of carbohydrate metabolism disorders development. Actualized the problem of obesity, the contribution of adipogenesis disorders to the formation of insulin resistance. Considered the issues of pathogenesis, screening and therapy of prediabetes.
The main goal of prediabetes treatment is to prevent the development of type 2 diabetes and cardiovascular complications. For this purpose, non-drug and drug therapies are used in patients with early disorders of carbohydrate metabolism. Medical methods should include metformin. The mechanism of action of metformin includes a decrease in glucose production by the liver, an increase in the sensitivity of peripheral tissues to insulin, glucose utilization by peripheral tissues, a decrease in fatty acid oxidation and absorption of carbohydrates in the intestine.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


