количество статей
7242
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Применение ботулинического токсина типа А при спастических формах детского церебрального паралича
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" №1
- Аннотация
- Статья
- Ссылки
Описаны методы оценки спастичности, которые важны для оценки эффективности проведенного лечения. Подчеркивается необходимость мультидисциплинарного подхода при лечении пациентов с ДЦП и планирования восстановительного лечения после проведения инъекций БТА для повышения эффективности комплексной терапии. В статье приведены данные, показывающие преимущества применения БТА при ДЦП.
Препараты ботулинического токсина типа А (БТА) более 20 лет применяются для лечения спастичности у неврологических больных. При детском церебральном параличе (ДЦП) применение БТА имеет высокую эффективность, особенно при эквинусной и эквиноварусной установках стоп. В статье подробно разбираются клинические паттерны спастичности пациентов с ДЦП, для лечения которых наиболее эффективно применение БТА, а также приводятся оптимальные дозы введения и мышцы-мишени.
Описаны методы оценки спастичности, которые важны для оценки эффективности проведенного лечения. Подчеркивается необходимость мультидисциплинарного подхода при лечении пациентов с ДЦП и планирования восстановительного лечения после проведения инъекций БТА для повышения эффективности комплексной терапии. В статье приведены данные, показывающие преимущества применения БТА при ДЦП.

Таблица. Модифицированная шкала спастичности Эшворта
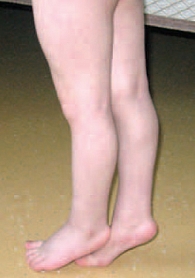
Рис. 1. Пример эквинусной установки стоп у ребенка 3 лет с диагнозом «ДЦП, спастическая диплегия»
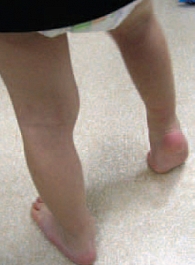
Рис. 2. Пример эквинусной установки стопы у ребенка 3 лет 4 месяцев с диагнозом «ДЦП, правосторонний гемипарез»
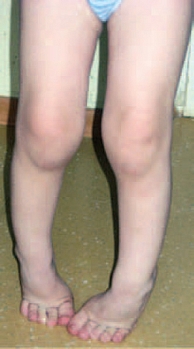
Рис. 3. Пример эквиноварусной установки стоп у ребенка 4,5 лет с диагнозом «ДЦП, спастическая диплегия»
По данным зарубежных авторов, распространенность ДЦП в педиатрической популяции в мире варьирует в диапазоне от 2 до 5 случаев на 1000 (в среднем 2,5 на 1000 родов). В группе недоношенных детей частота ДЦП составляет 1%, при этом у новорожденных с массой тела менее 1500 г распространенность ДЦП увеличивается до 5–15%, а при массе тела менее 1000 г достигает 25–50% [3]. По данным отечественных эпидемиологов, в России распространенность зарегистрированных случаев ДЦП составляет от 2,2 до 3,3 случаев на 1000, а в Москве – 1,9 на 1000 детей. В целом, по данным статистики, на данный момент времени в Москве проживает более 10 000 больных различного возраста с диагнозом ДЦП, из которых 4500 составляют дети и подростки [4]. Традиционно классификации ДЦП строятся в соответствии с типом двигательных расстройств и топографического распределения нарушений (число пораженных конечностей) [5]. В нашей стране наиболее широкое распространение получила классификация К.А. Семеновой, предложенная в 1972 г. [6]. Согласно этой классификации, выделяют 5 форм ДЦП:
- спастическая диплегия;
- гемипаретическая;
- гиперкинетическая;
- атонически-астатическая;
- двойная гемиплегия.
При оценке двигательных расстройств при ДЦП особое внимание уделяется спастичности, поскольку длительно существующее нарушение мышечного тонуса постепенно приводит к ограничению функциональных возможностей, формированию двигательного дефицита, нарушению овладения навыками передвижения, затруднению самообслуживания, появлению патологических установок, формированию контрактур, подвывихов и вывихов суставов. Для оценки уровня спастичности при ДЦП используют ряд специальных шкал, наиболее распространенной является модифицированная шкала спастичности Эшворта (Modified Ashworth Scale for Grading Spasticity) (табл.) [8].
Несмотря на простоту оценки спастичности по шкале Эшворта, присутствует определенный субъективизм получаемых данных и неполное совпадение баллов при тестировании разными врачами. Поэтому часто прибегают к измерению динамического угла в суставе, что может быть применено к большинству суставов и использовано как количественная оценка спастичности [9]. На этом принципе основана шкала Тардье. Для измерения динамического компонента производят движение в суставе так быстро, как только возможно на протяжении полного диапазона движения. Тот угол в суставе, когда происходит первое «схватывание» мышцы (то есть когда рефлекс на растяжение вызывается), определяется как R1. Угол полного пассивного движения в суставе определяется как R2. Разница между углами R2 и R1 отражает потенциал движения, возможный для ребенка, если спастичность будет нивелирована (преодолена). Измерение по шкале Тардье имеет огромное практическое значение в оценке спастичности, потому что помогает:
- дифференцировать спастичность и контрактуру;
- количественно определить степень спастичности;
- выбрать те мышцы, которые могут ответить на лечение спастичности;
- мониторировать состояние мышцы при лечении спастичности.
Лечение ДЦП должно быть комплексным, непрерывным, поэтапным, и наилучшие результаты достигаются при мультидисциплинарном подходе, когда в реабилитационном процессе участвуют педиатр, невролог, ортопед, врач ЛФК, физиотерапевт, логопед, дефектолог, детский психиатр, специалист по ортезированию и другие специалисты при необходимости (окулист, оториноларинголог, специалист по функциональной диагностике, генетик). Такой большой спектр специалистов необходим, поскольку двигательные нарушения при ДЦП очень часто сочетаются с симптоматической эпилепсией, расстройствами слуха и зрения, когнитивным дефицитом, расстройствами внимания, эмоциональной неустойчивостью, поведенческими нарушениями. Мультидисциплинарный подход гарантирует индивидуальный подход к ребенку, при этом решение о необходимых подходах к лечению будет приниматься с учетом всесторонней оценки состояния ребенка [10]. Поиск новых подходов к комплексной терапии направлен на улучшение двигательных функций и качества жизни детей с ДЦП. В последние годы разрабатываются новые высокоэффективные комплексные подходы с использованием лекарственных препаратов, ортопедических и хирургических мероприятий [11]. Согласно Европейскому консенсусу, основные лечебные мероприятия при ДЦП включают следующие:
методы функциональной терапии (массаж, ЛФК, аппаратная кинезиотерапия, физиотерапия и др.);
- консервативное ортопедическое лечение;
- лекарственное лечение (антиспастические препараты);
- препараты ботулинического токсина типа А;
- методы функциональной нейрохирургии;
- ортопедо-хирургическое лечение [12].
В России для лечения двигательных расстройств у детей препарат БТА Диспорт® («Ипсен Фарма») был разрешен c 1999 г. Одним из показаний к применению является коррекция динамической деформации стопы при ДЦП, вызванная спастичностью, у детей в возрасте 2 лет и старше. Вместе с тем нужно помнить, что использование БТА оказывает адресную помощь только при определенном типе расстройств движения при ДЦП и, назначая это лечение, следует руководствоваться несколькими принципами:
- Двигательные нарушения должны иметь преимущественно локальное или региональное распределение, то есть целью инъекций будут только небольшое число мышц. Это пример достаточно частого случая, когда лечение с помощью БТА приводит к решению локальной проблемы, хотя имеется генерализованное поражение.
- Двигательные нарушения должны иметь динамический компонент, то есть отсутствуют фиксированные деформации.
- Следует выявлять и лечить сопутствующие нарушения, поскольку их вклад в проблемы движения у ребенка с ДЦП может иметь большое значение.
- Важно определить конкретные индивидуальные цели лечения на данном этапе двигательного развития ребенка, которые являются наиболее значимыми, понятными и достижимыми.
- Необходимо все время проводить работу по мотивированию ребенка и его родителей на активное реабилитационное лечение.
- конкретные цели лечения ребенка на данном этапе его развития, ожидаемые результаты, план комплексной реабилитации после проведения ботулинотерапии, сроки повторных контрольных визитов;
- выбор мышц-мишеней для введения препарата БТА (Диспорт®);
- суммарную дозу Диспорта, учитывая вес пациента, возраст, состояние мышц-мишеней;
- дозу препарата для каждой мышцы;
- дозу препарата для каждой точки инъекции;
- протокол информированного согласия (подписывается совместно в двух экземплярах до проведения процедуры).
Эквинусная и эквиноварусная установка стопы при спастических формах ДЦП является самым частым показанием для проведения инъекций БТА. При кажущейся однотипности внешних проявлений у каждого ребенка с ДЦП имеется большое число индивидуальных проявлений двигательного стереотипа (степень спастичности мышц, ее распределение в разных группах мышц, степень пареза каждой мышцы, наличие и степень выраженности патологических тонических рефлексов, наличие и степень выраженности патологических синергий и синкинезий, нарушения реципрокных взаимоотношений мышц синергистов-антагонистов и многое другое), которые зачастую и определяют ответ на лечение [17]. Для получения хорошего результата от лечения препаратами ботулинического токсина типа А (Диспорт®) необходимо правильно выбрать пациента и мышцы-мишени, что является одним из самых сложных моментов лечения. Для этого предлагаем несколько описаний «портретов» пациентов с ДЦП. При отборе таких детей для проведения ботулинотерапии эффект от лечения будет оптимальным.
Клинический пример 1. Ребенок в возрасте от 2 до 6 лет с диагнозом «ДЦП, спастическая диплегия». Мишень для ботулинотерапии – эквинусная установка (положение) стопы. У ребенка отмечается преимущественно локальное преобладание спастичности в нижних конечностях с максимумом повышения мышечного тонуса в икроножных и камбаловидной мышцах. При этом наблюдается избыточное разгибание (подошвенное сгибание) стопы, а нормальная походка заменена хождением на переднем отделе стопы или кончиках пальцев (так называемая ходьба на цыпочках). Обычно при опоре отмечается разгибание в коленном суставе (рис. 1).
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, однако быстро устает, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), реже – камбаловидная мышца (m. Soleus) с обеих сторон. Доза Диспорта на одну инъекционную сессию рассчитывается следующим образом: в среднем 15–20 ЕД на 1 кг массы тела ребенка (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка). Полученная доза распределяется поровну между икроножными мышцами.
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, однако быстро устает, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), реже – камбаловидная мышца (m. Soleus) с обеих сторон. Доза Диспорта на одну инъекционную сессию рассчитывается следующим образом: в среднем 15–20 ЕД на 1 кг массы тела ребенка (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка). Полученная доза распределяется поровну между икроножными мышцами.
Клинический пример 2. Пациент от 2 до 7 лет с диагнозом «ДЦП, гемипаретическая форма». Мишень для ботулинотерапии – эквинусная установка (положение) стопы. У ребенка отмечается преимущественно локальное преобладание спастичности в пораженной ноге с максимумом повышения мышечного тонуса в икроножных и камбаловидной мышцах. При этом наблюдается избыточное разгибание (подошвенное сгибание) стопы. При ходьбе ребенок припадает на больную ногу, при этом опора осуществляется на передний отдел стопы или кончики пальцев, а пораженная нога, как правило, незначительно согнута в коленном суставе (рис. 2).
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, но быстро истощается, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), реже – камбаловидная мышца (m. Soleus) на пораженной стороне. Доза Диспорта на одну инъекционную сессию рассчитывается следующим образом: в среднем 15–20 ЕД на 1 кг массы тела ребенка (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка). Полученная доза распределяется поровну между икроножными мышцами.
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, но быстро истощается, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), реже – камбаловидная мышца (m. Soleus) на пораженной стороне. Доза Диспорта на одну инъекционную сессию рассчитывается следующим образом: в среднем 15–20 ЕД на 1 кг массы тела ребенка (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка). Полученная доза распределяется поровну между икроножными мышцами.
Клинический пример 3. Пациент от 2 до 7 лет с диагнозом «ДЦП, спастическая диплегия». Мишень для ботулинотерапии – эквиноварусная установка (положение) стопы. У ребенка отмечается преимущественно локальное преобладание спастичности в нижних конечностях с максимумом повышения мышечного тонуса в икроножных, камбаловидной мышцах, а также в задней большеберцовой мышце. При этом наблюдается избыточное разгибание (подошвенное сгибание) стопы, а также опора стопы на наружный край с поворотом ее переднего отдела внутрь. Обычно при опоре отмечается небольшое сгибание или разгибание в коленном суставе (рис. 3).
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, однако быстро истощается, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), задняя большеберцовая мышца (m. Тibialis posterior), реже – камбаловидная мышца (m. Soleus) с обеих сторон. При этом доза препарата Диспорт® для икроножной мышцы составляет 10–15 ЕД/кг, а для задней большеберцовой мышцы – 5–10 ЕД/кг (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка).
Обязательное условие – возможность самостоятельной вертикализации: ребенок стоит на коленях, стоит у опоры, ходит с поддержкой. У ребенка нормальный интеллект или незначительное снижение интеллектуальных функций (ребенок говорит короткими фразами, знает близких, проявляет интерес к игрушкам, однако быстро истощается, отвлекается, с трудом продолжительное время концентрирует внимание на занятиях).
Мышцы-мишени: медиальная и латеральная головки икроножной мышцы (m. Gastrocnemius), задняя большеберцовая мышца (m. Тibialis posterior), реже – камбаловидная мышца (m. Soleus) с обеих сторон. При этом доза препарата Диспорт® для икроножной мышцы составляет 10–15 ЕД/кг, а для задней большеберцовой мышцы – 5–10 ЕД/кг (максимально допустимая доза не должна превышать 30 ЕД на 1 кг массы тела ребенка).
В настоящее время у детей с ДЦП при лечении эквинусной установки стопы введение БТА начинают в возрастном интервале от 2 лет до 4 лет и часто сочетают с массажем, лечебной физкультурой, кинезиотерапией, ортезированием. Помимо лечения эквинусной и эквиноварусной установки стопы у детей с ДЦП могут дополнительно производиться инъекции БТА в другие мышцы, что позволяет добиться более комплексного воздействия и улучшить двигательный статус ребенка. При гемипаретической форме ДЦП введение БТА, помимо мышц голени (икроножных, камбаловидной и задней большеберцовой), достаточно часто требуется в мышцы пораженной руки. Самыми частыми мышцами-мишенями являются сгибатели предплечья (двуглавая мышца плеча и/или плечевая), сгибатели кисти (локтевой сгибатель кисти и/или лучевой сгибатель кисти), пронаторы предплечья (в основном круглый пронатор) и реже мышцы кисти (в основном мышца, приводящая большой палец).
У детей со спастической диплегией возможно проведение дополнительных инъекций БТА в приводящие мышцы бедра (как правило, в большую приводящую мышцу и/или длинную приводящую мышцу) или мышцы сгибатели голени (обычно в полуперепончатую и полусухожильную мышцы). При наличии спастичности мышц руки возможно введение небольших доз препаратов БТА в заинтересованные мышцы, как правило, это сгибатели предплечья (двуглавая мышца плеча и/или плечевая) и круглый пронатор. Обычно специальной подготовки к процедуре инъекций не требуется. Это означает, что нет необходимости изменять режим питания, режим «сон – бодрствование», режим и дозирование лекарственных препаратов или любых нелекарственных мероприятий (например, массаж и ЛФК в курсе реабилитационного лечения), отменять посещения дошкольных учреждений, учебу в школе или посещение различных коллективных мероприятий (например, запланированная поездка к родственникам или поход в кино, на концерт).
Заранее готовиться к процедуре инъекции требуется только в редких случаях. Во-первых, если ребенок беспокойный, с высоким уровнем тревоги, страхов (в том числе страха перед любым посещением врача), то возможно применение легких успокоительных препаратов как заранее, так и непосредственно перед процедурой. Обычно необходимость в такой подготовке возникает перед первой процедурой инъекции БТА, при повторных инъекциях – значительно реже. Выбор препарата, дозы и пути введения определяет врач. Во-вторых, непосредственно перед процедурой с целью снижения болезненности от инъекций можно применять анальгетические мази, кремы или гели, например крем Эмла, которые наносятся на кожу над мышцами-мишенями в точках инъекций за 20–30 минут до процедуры.
После выполнения инъекций обязательным является наблюдение за ребенком в течение 20–30 минут. После проведения инъекций БТА в этот день не назначают других лечебных процедур. На следующий день возможно возобновление реабилитации в прежнем объеме. Снижение спастичности мышц, как правило, наблюдается через несколько дней (от 2 до 14 дней) с развитием максимального эффекта к концу первого месяца после инъекций. При выполнении инъекций по поводу эквинусной установки стопы действие препарата БТА (Диспорт®) проявляется увеличением угла пассивных и активных движений в голеностопном суставе, уменьшением сопротивления движению в голеностопном суставе при мануальном тестировании, увеличением площади опоры стопы при стоянии, появлением опоры на полную стопу при ходьбе, снижением болезненности икроножных мышц при их пассивном растяжении, исчезновением внезапных болезненных сокращений икроножных мышц (крампи) и другими проявлениями.
После проведения лечения инъекциями БТА (Диспорт®) необходимо правильное планирование последующего курса реабилитационного лечения, целью которого является формирование новых навыков и движений в условиях корригированного двигательного стереотипа. Наиболее адекватным является включение препаратов БТА в комплексное восстановительное лечение непосредственно перед очередным курсом реабилитации или за 2–3 недели до начала курса, когда антиспастическое действие препарата будет максимальным. Для контроля эффективности ботулинотерапии и планирования дальнейшего лечения составляется план повторных консультаций ребенка у специалиста по ботулинотерапии. Как правило, необходимо осмотреть ребенка через 1 неделю, 1 и 3 месяца после введения препарата Диспорт®. Применение БТА (препарата Диспорт®) при ДЦП позволяет:
У детей со спастической диплегией возможно проведение дополнительных инъекций БТА в приводящие мышцы бедра (как правило, в большую приводящую мышцу и/или длинную приводящую мышцу) или мышцы сгибатели голени (обычно в полуперепончатую и полусухожильную мышцы). При наличии спастичности мышц руки возможно введение небольших доз препаратов БТА в заинтересованные мышцы, как правило, это сгибатели предплечья (двуглавая мышца плеча и/или плечевая) и круглый пронатор. Обычно специальной подготовки к процедуре инъекций не требуется. Это означает, что нет необходимости изменять режим питания, режим «сон – бодрствование», режим и дозирование лекарственных препаратов или любых нелекарственных мероприятий (например, массаж и ЛФК в курсе реабилитационного лечения), отменять посещения дошкольных учреждений, учебу в школе или посещение различных коллективных мероприятий (например, запланированная поездка к родственникам или поход в кино, на концерт).
Заранее готовиться к процедуре инъекции требуется только в редких случаях. Во-первых, если ребенок беспокойный, с высоким уровнем тревоги, страхов (в том числе страха перед любым посещением врача), то возможно применение легких успокоительных препаратов как заранее, так и непосредственно перед процедурой. Обычно необходимость в такой подготовке возникает перед первой процедурой инъекции БТА, при повторных инъекциях – значительно реже. Выбор препарата, дозы и пути введения определяет врач. Во-вторых, непосредственно перед процедурой с целью снижения болезненности от инъекций можно применять анальгетические мази, кремы или гели, например крем Эмла, которые наносятся на кожу над мышцами-мишенями в точках инъекций за 20–30 минут до процедуры.
После выполнения инъекций обязательным является наблюдение за ребенком в течение 20–30 минут. После проведения инъекций БТА в этот день не назначают других лечебных процедур. На следующий день возможно возобновление реабилитации в прежнем объеме. Снижение спастичности мышц, как правило, наблюдается через несколько дней (от 2 до 14 дней) с развитием максимального эффекта к концу первого месяца после инъекций. При выполнении инъекций по поводу эквинусной установки стопы действие препарата БТА (Диспорт®) проявляется увеличением угла пассивных и активных движений в голеностопном суставе, уменьшением сопротивления движению в голеностопном суставе при мануальном тестировании, увеличением площади опоры стопы при стоянии, появлением опоры на полную стопу при ходьбе, снижением болезненности икроножных мышц при их пассивном растяжении, исчезновением внезапных болезненных сокращений икроножных мышц (крампи) и другими проявлениями.
После проведения лечения инъекциями БТА (Диспорт®) необходимо правильное планирование последующего курса реабилитационного лечения, целью которого является формирование новых навыков и движений в условиях корригированного двигательного стереотипа. Наиболее адекватным является включение препаратов БТА в комплексное восстановительное лечение непосредственно перед очередным курсом реабилитации или за 2–3 недели до начала курса, когда антиспастическое действие препарата будет максимальным. Для контроля эффективности ботулинотерапии и планирования дальнейшего лечения составляется план повторных консультаций ребенка у специалиста по ботулинотерапии. Как правило, необходимо осмотреть ребенка через 1 неделю, 1 и 3 месяца после введения препарата Диспорт®. Применение БТА (препарата Диспорт®) при ДЦП позволяет:
- уменьшить проявления патологического двигательного стереотипа;
- увеличить объем активных движений в разных сегментах тела;
- снизить болевой синдром, обусловленный длительно существующей спастичностью;
- использовать время действия препарата для обучения ребенка новым двигательным навыкам (ходьба, хват и т.д.);
- избежать некоторых видов ортопедического оперативного лечения в раннем возрасте;
- изменить тактику оперативного лечения, его объем или избежать его вовсе в более позднем возрасте.
- повысить качество жизни ребенка;
- улучшить социально-психологическую адаптацию ребенка;
- сформировать мотивацию к лечению;
- облегчить уход за больным ребенком.
1. Bax M., Goldstein M., Rosenbaum P. et al. Proposed definition and classification of cerebral palsy, April 2005 // Dev. Med. Child. Neurol. 2005. Vol. 47. № 8. P. 571–576.
2. Бадалян Л.О., Журба Л.Т., Тимонина О.В. Детские церебральные параличи. Киев: Здоров'я, 1988. 328 с.
3. Miller F. Cerebral palsy. New York: Springer Science, 2005. 1055 p.
4. Куренков А.Л., Батышева Т.Т., Виноградов А.В. и др. Спастичность при детском церебральном параличе: диагностика и стратегии лечения // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 7. № 2. С. 24–28.
5. Miller G. Cerebral Palsies: an overview // The Cerebral Palsies: causes, consequences, and management. Boston: Butterworth-Heinemann, 1998. P. 1–35.
6. Семенова К.А. Вопросы патогенеза детского церебрального паралича // Журнал невропатологии и психиатрии. 1980. Т. 80. № 10. С. 1445–1450.
7. Palisano R., Rosenbaum P., Walter S. et al. Development and reliability of a system to classify gross motor function in children with cerebral palsy // Dev. Med. Child. Neurol. 1997. Vol. 39. № 4. P. 214–223.
8. Damiano D.L., Quinlivan J.M., Owen B.F. et al. What does the Ashworth scale really measure and are instrumented measures more valid and precise? // Dev. Med. Child. Neurol. 2002. Vol. 44. № 2. P. 112–118.
9. Leonard J., Graham H.K. Treatment of motor disorders in cerebral palsy with botulinum neurotoxin // Botulinum toxin: Therapeutic clinical practice and science / Ed. by J. Jankovic. Philadelphia: Saunders Elsevier, 2009. P. 172–191.
10. Семенова К.А. Восстановительное лечение детей с перинатальным поражением нервной системы и детским церебральным параличом. М.: Закон и порядок, 2007. 616 с.
11. Murphy N., Such-Neibar T. Cerebral palsy diagnosis and management: the state of the art // Curr. Probl. Pediatr. Adolesc. Health Care. 2003. Vol. 33. № 5. P. 146–169.
12. Heinen F., Desloovere K., Schroeder A.S. et al. The updated European Consensus 2009 on the use of Botulinum toxin for children with cerebral palsy // Eur. J. Paediatr. Neurol. 2010. Vol. 14. № 1. P. 45–66.
13. Simpson D.M., Gracies J.M., Graham H.K. et al. Assessment: Botulinum neurotoxin for the treatment of spasticity (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology // Neurology. 2008. Vol. 70. № 19. P. 1691–1698.
14. Delgado M.R., Hirtz D., Aisen M. et al. Practice parameter: pharmacologic treatment of spasticity in children and adolescents with cerebral palsy (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society // Neurology. 2010. Vol. 74. № 4. P. 336–343.
15. Дутикова Е.М., Лильин Е.Т. Ботулотоксин типа А (Диспорт) в лечении детского церебрального паралича // Фарматека. 2007. Т. 7. № 142. С. 37–42.
16. Heinen F., Molenaers G., Fairhurst C. et al. European consensus table 2006 on botulinum toxin for children with cerebral palsy // Eur. J. Paediatr. Neurol. 2006. Vol. 10. № 5–6. P. 215–225.
17. Куренков А.Л., Дутикова Е.М., Никитин С.С. и др. Коррекция препаратом ботулинического токсина типа А (Диспорт) деформаций стоп у детей со спастическими формами детского церебрального паралича // Журнал неврологии и психиатрии им. С.С. Корсакова. 2010. Т. 110. № 6. С. 37–43.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.