Применение глюкокортикостероидов в виде мелкодисперсных аэрозолей: в фокусе циклесонид
- Аннотация
- Статья
- Ссылки
Введение
С момента своего появления в середине 1950-х гг. конструкция дозированных аэрозольных ингаляторов (ДАИ) практически не изменилась. Устройство порошковых ингаляторов (ПИ), напротив, активно развивалось в технологическом плане, обеспечивая более надежную и удобную для больного доставку препарата в дыхательные пути. В результате такие современные порошковые системы, как Турбухалер или Новолайзер, превзошли ДАИ практически по всем показателям, кроме стоимости. Подводя итоги конкуренции систем доставки, ряд известных экспертов рекомендовали ограничить область применения ДАИ назначением бронхолитиков по потребности, а более важную для больного поддерживающую терапию проводить при помощи дорогостоящих, но более надежных порошковых ингаляторов [1].
Однако после появления мелкодисперсных аэрозолей такое сопоставление представляется уже не столь однозначным. Современные беcфреоновые ингаляторы в состоянии генерировать аэрозоли, содержащие существенно более мелкие частицы, чем ПИ. Кроме того, ингаляции лекарственных веществ в виде растворов более эффективны по сравнению с ингаляциями суспензий и твердых частиц, так как капли раствора при столкновении с поверхностью бронхов дробятся на более мелкие и имеют шанс продолжить свое движение по дыхательным путям [2].
Это тем более важно, что в последние годы была пересмотрена роль мелких дыхательных путей в патогенезе бронхиальной астмы. Традиционные аэрозоли и ПИ доставляют в периферические (малые) дыхательные пути лишь небольшое количество препарата. К тому же из-за большой общей площади периферических бронхов (95,5% от общей площади дыхательных путей) концентрация препарата в них в 100–140 раз ниже, чем в крупных бронхах1. Мелкодисперсные аэрозоли способны доставить в мелкие дыхательные пути бóльшую часть дозы, что создает условия для эффективной терапии.
Появление циклесонида – уникального препарата, сочетающего высокую кортикостероидную активность с низким риском местных и системных нежелательных эффектов, – делает его использование многообещающим у пациентов с тяжелой астмой, связанной с поражением мелких дыхательных путей, а также у детей, поскольку доставка обычных препаратов у детей младшего возраста существенно ограничена из-за малого (по сравнению со взрослыми) просвета дыхательных путей.
Настоящий обзор посвящен перспективам клинического применения нового глюкокортикостероида (ГКС) – циклесонида2 в виде мелкодисперсного аэрозоля – у больных бронхиальной астмой.
Место мелкодисперсных аэрозолей в терапии бронхиальной астмы
Малые дыхательные пути
К малым дыхательным путям принято относить бронхи с внутренним диаметром менее 2 мм. Это бронхи 9–23-й генерации, стенка которых не содержит хрящевой ткани, а на долю мышечных волокон приходится не более 20% от периметра бронхиальной стенки [3]. Общая площадь дыхательных путей на уровне 8-й генерации составляет 7 см2, суммарный просвет бронхов 15-й генерации уже превышает 100 см2, а у 20-й генерации этот показатель составляет 1743 см2 [3]. Таким образом, ограничение воздушного потока в мелких бронхах практически не влияет на показатели спирометрии и остается незамеченным для клиницистов.
Протяженность периферических дыхательных путей составляет всего несколько сантиметров, а скорость воздуха на этом участке в десятки раз ниже, чем в крупных бронхах. Именно поэтому ограничение воздушного потока на уровне мелких бронхов никогда не сопровождается хрипами и не выявляется при аускультации. Таким образом, малые дыхательные пути представляют собой «немую зону», недоступную для стандартных клинико-инструментальных методов обследования.
О повреждении мелких дыхательных путей свидетельствуют морфологические изменения мелких бронхов, обнаруженные у больных, погибших от астмы [4], и высокое число активных эозинофилов в биоптатах мелких бронхиол у больных тяжелой астмой [5].
Первые работы, указавшие на роль мелких дыхательных путей в патогенезе астмы, были выполнены в начале 1990-х гг. [6]. При исследовании сопротивления периферических бронхов с помощью специального катетера, вводимого в дыхательные пути через бронхоскоп, оказалось, что общее сопротивление периферических дыхательных путей у больных астмой в 7–8 раз выше, чем у здоровых лиц.
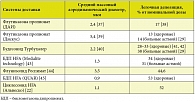
Несколько позднее были предложены неинвазивные методы исследования малых дыхательных путей. В первую очередь речь идет об импульсной осциллометрии. Исследования, проведенные по этой методике, в частности, показали, что у больных с неконтролируемой астмой уровень сопротивления периферических отделов респираторного тракта достоверно выше, чем у пациентов с хорошим контролем [7]. При этом оказалось, что терапия ГКС в виде мелкодисперсных аэрозолей (беклометазона дипропионат (БДП) QUAR, средний диаметр частиц 1,1 мкм) позволяет значимо снизить сопротивление периферических дыхательных путей, в то время как обычные аэрозоли (БДП Альдецин, средний диаметр частиц 3,5 мкм) не оказывают влияния на сопротивление малых дыхательных путей даже при назначении в более высоких (по сравнению с мелкодисперсными ГКС) дозах [8].
Другим методом оценки состояния мелких дыхательных путей является измерение концентрации оксида азота (NO), образующегося в альвеолах и малых дыхательных путях (NOальвеолярн.) [9]. Принято считать, что концентрация NO хорошо коррелирует с уровнем воспаления в дыхательных путях [10]. Обычно у больных астмой уровень NOальвеолярн. остается низким, а повышается концентрация NO, который образуется в крупных бронхах [11]. Однако у больных с тяжелой, резистентной к терапии астмой было отмечено существенное увеличение концентрации NOальвеолярн., что свидетельствует об активном воспалительном процессе в периферических отделах бронхов. При этом удвоение дозы ингаляционных ГКС не влияло на уровень NOальвеолярн., но после назначения курса ГКС внутрь продукция NO в малых дыхательных путях существенно снижалась [12]. Увеличение синтеза NO в периферических бронхах было выявлено также у больных с ночными симптомами астмы [13].
Таким образом, патологические процессы в мелких дыхательных путях, по-видимому, более характерны для тяжелого, резистентного к действию ГКС варианта течения бронхиальной астмы. У таких больных развиваются существенные структурные и функциональные изменения мелких бронхов, сходные с повреждением мелких бронхов у больных хронической обструктивной болезнью легких: ремоделирование [14], утолщение бронхиальной стенки [15] и формирование воздушной ловушки [16]. ГКС, назначенные в виде обычных аэрозолей, не оказывают существенного влияния на патологические процессы, локализованные в области малых дыхательных путей.
Опираясь на данные процитированных исследований, можно утверждать, что патологические процессы в мелких бронхах имеют важное значение для больных с тяжелой и рефрактерной астмой. Такие больные могли бы извлечь пользу из применения мелкодисперсных аэрозолей. В качестве примера можно привести исследование J. Cohen и соавт., опубликованное в 2011 г. [17]. В этом исследовании у больных астмой был выполнен бронхопровокационный тест с аденозина монофосфатом (АМФ), который назначался в виде крупнодисперсных (9,9 мкм) и мелкодисперсных (1,06 мкм) частиц.
Исследование показало, что крупнодисперсные частицы АМФ вызывали значимую бронхоконстрикцию в более низких концентрациях, чем мелкодисперсные. Более того, на провокацию мелкодисперсным АМФ отреагировала лишь часть пациентов. Это наблюдение полностью согласуется с общепринятым положением, согласно которому за бронхиальную гиперреактивность у больных астмой отвечают в основном крупные дыхательные пути. В исследовании больные, которые реагировали на провокацию мелкодисперсным АМФ, получали в качестве терапии обычный флутиказона пропионат (ФП) или мелкодисперсный циклесонид. Оказалось, что назначение ФП не влияло на устойчивость пациентов к действию мелких частиц АМФ, в то время как лечение циклесонидом существенно снижало частоту возникновения бронхоспазма под воздействием мелкодисперсных частиц АМФ.
Мелкодисперсные аэрозоли
Традиционные ДАИ, содержащие в качестве пропеллента хлорфторуглерод (CFC), продуцируют достаточно крупные частицы (3–4 мкм). При этом ингалятор выделяет аэрозоль с большой скоростью. Двигаясь со скоростью от 5 до 7 м/с [18], крупные частицы аэрозоля благодаря инерции сохраняют прямолинейное движение и ударяются о заднюю стенку глотки, где задерживается до 80–90% от номинальной дозы препарата. Кроме того, чем выше скорость вдоха больного, тем ниже периферическая депозиция препарата [19], так как при высокой скорости воздушного потока крупные частицы сталкиваются с бифуркацией трахеи и крупных бронхов. Поскольку более крупные частицы несут с собой бóльшую часть препарата, периферическая депозиция лекарственных средств не превышает 17% от номинальной дозы [20].
ДАИ на основе гидрофлюороалканов (HFA) могут содержать ГКС в виде суспензии (например, суспензия ФП или будесонида) или раствора (БДП, циклесонид). В первом случае ингаляторы продуцируют довольно крупные частицы, примерно такие же, как в традиционных ингаляторах на основе CFC, в то время как ингаляторы, содержащие растворы БДП и циклесонида, продуцируют существенно более мелкие частицы со средним аэродинамическим диаметром 0,9–1,3 мкм. Кроме того, использование в качестве пропеллента HFA позволяет снизить начальную скорость частиц до 2 м/с. Благодаря низкой скорости аэрозоля более мелкие частицы в меньшей степени задерживаются в ротоглотке и полости рта и более активно поступают в дыхательные пути (табл.).
Из числа ДАИ на основе HFA (ФП, будесонид, БДП и циклесонид) циклесонид обладает максимальной долей частиц диаметром меньше 3,1 мкм [21]. Как следствие – после ингаляции циклесонида в центральных отделах легких задерживается 7,4% от дозы, в промежуточные отделы поступает 36,9%, а в периферических дыхательных путях оказывается основная часть препарата, достигшего легких, – 55,8% [22].
Таким образом, в ряду современных ДАИ, содержащих в качестве пропеллента HFA, у циклесонида отмечается максимальная доля мелкодисперсных частиц и один из самых высоких показателей депозиции в периферических дыхательных путях. Сходными характеристиками обладает только БДП QUAR, однако этот препарат не доступен в РФ, кроме того, он существенно уступает циклесониду по параметрам активности и безопасности.
Недостатки мелкодисперсных аэрозолей
В легких толщина альвеолярно-капиллярных перегородок составляет 0,2–0,5 мкм, а общая площадь альвеол на вдохе достигает 120 м2, что создает условия для практически полной абсорбции ГКС, достигших альвеол, в кровь. При этом чем больше мелкодисперсных частиц содержит аэрозоль, тем выше степень абсорбции.
В одном из сравнительных исследований пиковая концентрация препарата в крови после ингаляции 400 мкг БДП в виде ДАИ на основе CFC оказалась на 1/3 ниже, чем после ингаляции 200 мкг БДП в виде мелкодисперсного аэрозоля [23]. Таким образом, использование мелкодисперсных ГКС может обернуться более высоким риском системных нежелательных эффектов.
Исключением из этого правила является циклесонид. Дело в том, что на сегодняшний день это единственный ГКС, для которого характерна активация in situ.
Преимущества циклесонида
Фармакокинетика циклесонида
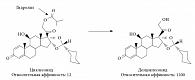
Циклесонид обладает низкой кортикостероидной активностью: относительная аффинность циклесонида по отношению к ГКС-рецептору оценивается как 12 (аффинность дексаметазона принята за 100). Попав в клетки бронхиального эпителия, неактивный циклесонид подвергается гидролизу эстеразами и превращается в свой активный метаболит – десизобутирил-циклесонид (дезциклесонид), относительная аффинность которого в 100 раз выше, чем у циклесонида, – 1200 [24] (рис.).
В отличие от БДП и будесонида, циклесонид практически не всасывается в желудочно-кишечном тракте – биодоступность препарата при пероральном приеме составляет менее 1% [25].
После ингаляции циклесонид длительно задерживается в эпителии дыхательных путей, что позволяет назначать препарат один раз в день. Активация циклесонида происходит преимущественно в легких, в то время как циклесонид и дезциклесонид, попавшие в системный кровоток, быстро разрушаются в печени при участии изофермента CYP3A4. А пиковая концентрация активного дезциклесонида в крови после ингаляции в 3 раза ниже, чем концентрация неактивного циклесонида. Находясь в плазме, циклесонид на 99% связывается с белками, что не позволяет препарату поступать в органы и ткани [26].
По величине системного клиренса3 циклесонид и его активный метаболит значительно превосходят все другие ингаляционные ГКС. Кроме того, величина объема распределения4 у циклесонида одна из самых низких среди других ГКС. Эти параметры свидетельствуют о высокой потенциальной безопасности циклесонида [27].
Исследования безопасности циклесонида показали, что при назначении в дозе 640 мкг дважды в день препарат не влияет на функцию надпочечников (не влияет на уровень суточной экскреции кортизола с мочой). Для сравнения: у больных, которые получали ФП в дозе 440 мкг дважды в день в виде ДАИ, отмечалось статистически значимое снижение экскреции кортизола [28]. В целом ряде исследований циклесонид продемонстрировал более высокие показатели безопасности (параметр степени риска развития нежелательных эффектов) по сравнению с ФП. Препарат может назначаться детям с шести лет. Циклесониду, как и большинству других ГКС, присвоена категория риска для беременных – С (по классификации Федерального агентства по надзору за лекарствами и пищевыми продуктами (Food and Drug Administration, FDA) США).
Таким образом, циклесонид в виде мелкодисперсного аэрозоля достигает периферических дыхательных путей значительно лучше, чем большинство других ГКС. Более того, благодаря особенностям фармакокинетики препарата лечение не сопровождается системными нежелательными эффектами, связанными с поступлением препарата в кровь. Кроме того, накапливаясь в клетках в эстерифицированном виде, циклесонид способен продолжительное время активировать ГКС-рецепторы, что позволяет назначать препарат один раз в день [29].
Клиническая эффективность циклесонида
Циклесонид доказал свою высокую эффективность в целом ряде рандомизированных клинических исследований. Препарат в дозе 80 мкг при однократном назначении обеспечивает у больных с легкой и умеренной астмой лечебный эффект и контроль над заболеванием, эквивалентный ФП, назначенному дважды в день в дозе по 100 мкг [30].
При назначении больным с умеренной и тяжелой астмой циклесонид в дозе 320 мкг два раза в день сопоставим по эффективности с ФП в дозе 330 мкг дважды в день, однако случаи орофарингеального кандидоза в группе приема циклесонида отмечались существенно реже, чем на фоне терапии ФП (2% и 4,8% соответственно) [31].
По сравнению с терапией будесонидом (Турбухалер) в дозе 320 мкг один раз в день однократное назначение циклесонида в дозе 320 мкг обеспечивало больным с персистирующей астмой более высокие показатели спирометрии и лучший контроль над симптомами [32, 33]. При этом частота нежелательных явлений при терапии будесонидом и циклесонидом не отличалась.
Особый интерес представляют исследования, в которых оценивалась способность циклесонида влиять на воспаление в малых дыхательных путях. В исследовании продолжительностью 4 недели [34] назначение циклесонида в дозе 320 мкг (один раз в день) позволило достоверно снизить концентрацию NOальвеолярн. в 2 раза по сравнению с исходным уровнем. В другом исследовании больные были рандомизированы для приема циклесонида 160 мкг один раз в день и ФП в виде порошкового ингалятора по 100 мкг дважды в день. В этом исследовании сопротивление мелких бронхов, оцениваемое методом импульсной осциллометрии, достоверно снижалось в группе пациентов, получавших циклесонид, в то время как у больных, получавших ФП, этот показатель не претерпел изменений. Кроме того, в этой работе оценивалось количество эозинофилов в стимулированной мокроте. Поскольку мокрота была получена в позднюю фазу после стимуляции, по результатам ее исследования можно судить об уровне воспаления в периферических дыхательных путях. После лечения циклесонидом число эозинофилов в мокроте больных достоверно снизилось, в то время как в группе, принимавшей ФП, уровень эозинофилов не менялся.
Ингаляционные ГКС, как правило, недостаточно эффективны у больных с обострениями астмы, так как существующие системы доставки не обеспечивают должного поступления препарата в дыхательные пути у больных с выраженной бронхообструкцией [35]. Однако благодаря высокой степени легочной депозиции циклесонид в высокой дозе (640 мкг дважды в день) при нетяжелых обострениях астмы по эффективности оказался сопоставим с преднизолоном, но при этом выгодно отличался по своей безопасности [36].
Выводы
Циклесонид лишь недавно стал доступен в нашей стране под торговым названием Альвеско. Этот препарат характеризуется высокой степенью легочной депозиции, но, в отличие от мелкодисперсных аэрозолей, содержащих БДП, обладает высоким профилем безопасности: благодаря особенностям своей фармакокинетики циклесонид попадает в системный кровоток в незначительном количестве и быстро выводится из организма. Наиболее привлекательной точкой приложения препарата является терапия воспаления малых дыхательных путей. К сожалению, до сих пор нет простых и общепринятых методов исследования, позволяющих диагностировать у больного астмой поражение периферических бронхов, но это состояние можно заподозрить у больных, плохо отвечающих на терапию ингаляционными ГКС, при тяжелом течении астмы и частых симптомах в ночные часы. Терапия циклесонидом у таких больных существенно расширит наши терапевтические возможности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.