количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Применение гормональной терапии, содержащей низкодозированный эстроген и дроспиренон, у женщин в пременопаузе и ранней постменопаузе
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №4
- Аннотация
- Статья
- Ссылки
Сердечно-сосудистые заболевания (ССЗ) занимают первое место в структуре смертности среди женщин, поэтому меры, направленные на эффективную первичную и вторичную профилактику, имеют большое социальное значение.
Сердечно-сосудистые заболевания (ССЗ) занимают первое место в структуре смертности среди женщин, поэтому меры, направленные на эффективную первичную и вторичную профилактику, имеют большое социальное значение.

Таблица 1. Клиническая характеристика женщин, включенных в исследование
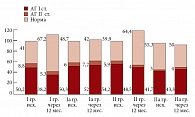
Рис. 1. Процентное соотношение показателей АД до и после терапии в исследуемых группах
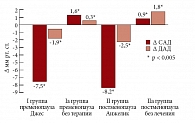
Рис. 2. Динамика АД через 12 месяцев в исследуемых группах
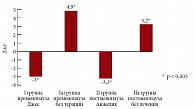
Рис. 3. Динамика массы тела через 12 месяцев в исследуемых группах
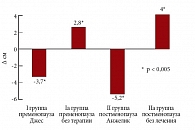
Рис. 4. Динамика объема талии через 12 месяцев в исследуемых группах

Рис. 5. Динамика липидного обмена (%) через 12 месяцев в исследуемых группах
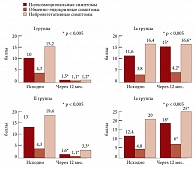
Рис. 6. Динамика модифицированного менопаузального индекса через 12 месяцев в исследуемых группах
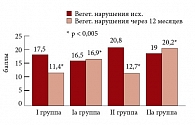
Рис. 7. Динамика среднего балла вегетативной дисфункции через 12 месяцев в исследуемых группах
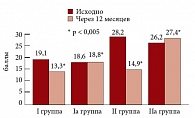
Рис. 8. Исследование степени выраженности депрессивных расстройств с применением анкеты Бека (средний балл по шкале Бека)

Рис. 9. Выявление личностной и реактивной тревожности (результаты теста Спилбергера) через 12 месяцев в исследуемых группах
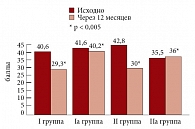
Рис. 10. Выявление личностной и реактивной тревожности (результаты теста Спилбергера, средний балл) через 12 месяцев в исследуемых группах
Большинство сердечно-сосудистых осложнений развивается у женщин в период постменопаузы, в среднем на 10–12 лет позже, чем у мужчин. Более позднее начало ССЗ у женщин обусловлено защитными свойствами женских половых гормонов, особенно эстрогена [1].
В настоящее время в Европе средняя продолжительность жизни женщин превышает 80 лет, а поскольку возраст наступления менопаузы значительно не меняется (в среднем 51,3 года), длительность постменопаузы составляет примерно 30–40% общей продолжительности их жизни. Несмотря на то что своевременная менопауза относится к числу физиологических явлений, она является предвестником многих потенциальных проблем со здоровьем, которые могут повлиять не только на качество, но подчас и на продолжительность жизни женщины. Специфическими проявлениями в этот период могут быть вазомоторная нестабильность, психологические, психосоматические расстройства и урогенитальные симптомы, появление которых заставляет многих женщин обращаться за медицинской помощью. Однако большинство не подозревают о долгосрочных последствиях дефицита эстрогенов, к которым в первую очередь относятся ССЗ и остеопороз. Исследования последних лет свидетельствуют о том, что эти нарушения могут быть «запрограммированы» уже in utero. Таким образом, многие женщины в постменопаузе уже имеют латентные признаки этих заболеваний и нередко такие серьезные события, как инфаркт миокарда или переломы вследствие остеопороза, возникают до первого обращения к гинекологу с вазомоторными жалобами.
У многих женщин уже в переходный период (в пременопаузе) начинают развиваться взаимосвязанные сосудистые и метаболические изменения, такие как увеличение веса, нарушение липидного и углеводного обмена, а также эндотелиальная дисфункция [2]. Андроидное ожирение, связанное с наступлением менопаузы, способствует повышению резистентности к инсулину на периферии наряду с повышением уровня артериального давления (АД) и ухудшением липидного профиля. Прослеживается четкая взаимосвязь между длительностью постменопаузы и уровнем АД, поскольку параллельно с изменением гормонального статуса происходит увеличение симпатического тонуса, активация ренин-ангиотензин-альдостероновой системы (РААС) и повышение чувствительности к соли у женщин. С клинической точки зрения отсутствие контроля над высоким уровнем АД является одним из самых важных сердечно-сосудистых факторов риска у женщин в постменопаузе, так как риск развития ССЗ повышается в 4 раза по сравнению с лицами того же возраста с нормальным уровнем АД. Только что опубликованные результаты крупного популяционного исследования еще раз подтверждают важность снижения уровня АД у женщин для сокращения сердечно-сосудистого риска по сравнению с мужчинами [3].
В последние годы в ряде работ получены интересные результаты, свидетельствующие о том, что наличие вазомоторных симптомов у женщин в постменопаузе коррелирует с повышенным риском ССЗ, углеводными и липидными нарушениями. Так, G.-C. M. Gast и соавт. [4], наблюдавшие с 1995 по 2000 г. когорту женщин (n = 10 787) в возрасте 46–64 лет в Швеции и Дании, выявили, что вазомоторные проявления коррелировали с повышением риска ССЗ с величиной индекса массы тела (ИМТ), уровнем холестерина и гипертензией по сравнению с теми, у кого эти симптомы отсутствовали. В исследовании SWAN (Women’s Health Across the Nation) у женщин с приливами с большей вероятностью выявлялись такие латентные нарушения, как эндотелиальная дисфункция или кальцификация аорты, по сравнению с женщинами без приливов [5]. Кроме того, женщины в постменопаузе с вазомоторными симптомами демонстрировали более высокий уровень систолического АД не только в дневное время, но также и во время ночного сна, по сравнению со сверстницами, не имевшими симптомов. Показано, что у женщин с менопаузальными проявлениями наблюдается более низкий уровень антиоксидантной активности плазмы, а именно: сниженные концентрации сульфгидрильных групп и более высокие значения липопероксидов, чем у женщин без приливов. Таким образом, приливы у женщин в постменопаузе коррелируют с наличием оксидативного стресса, в свою очередь связанного с повышением риска ССЗ.
Можно предположить, что наличие выраженных приливов является индикатором латентно протекающих ССЗ и способствует значительно более высокому пожизненному риску неблагоприятных событий со стороны сердечно-сосудистой системы у женщин в постменопаузе [6]. Этот факт может объяснять, по крайней мере частично, отрицательное влияние или отсутствие какого-либо эффекта заместительной гормональной терапии (ЗГТ) на ССЗ в тех испытаниях, где терапия была назначена в основном пожилым женщинам без вазомоторных симптомов, в то время как результаты ЗГТ были положительными (значимое снижение числа сердечно-сосудистых осложнений) в наблюдательных исследованиях, в которых здоровые женщины в переходном периоде получали терапию в связи с вазомоторными симптомами.
Эстрогены могут оказывать как положительное, так и отрицательное действие на сердечно-сосудистую систему [7]. Так, эстрогены оказывают позитивное влияние на липидный профиль в виде снижения уровня общего холестерина (ХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), липопротеина (а) и аполипопротеина, повышения уровня холестерина липопротеидов высокой плотности (ХС ЛПВП). На эндотелиальную функцию эстрогены воздействуют следующим образом:
Несмотря на имеющиеся данные, многие аспекты влияния эстрогенов на сердечно-сосудистую систему остаются невыясненными. Особенно важно дальнейшее изучение влияния гормонов в пре- и постменопаузальном периоде. По данным Фрамингемского исследования было выявлено, что число сердечно-сосудистых осложнений в период постменопаузы увеличилось в 2,6 раза в сравнении с пременопаузой [10]. Риск развития ССЗ, связанный с наступлением хирургической менопаузы, увеличивался в 2,7 раза по сравнению с периодом пременопаузы у женщин того же возраста (p < 0,01) и был в 2,2 раза выше, чем у женщин с естественной менопаузой. Применение гормональной терапии в этом периоде, возможно, обеспечит дополнительные преимущества в снижении риска сердечно-сосудистых осложнений. Так как современные препараты для гормональной терапии отличаются по содержанию эстрогенов и прогестинового компонента, требуется дальнейшие изучение их влияния на сердечно-сосудистую систему. В состав препаратов для комбинированной гормональной терапии входят прогестагены, необходимые для профилактики гиперплазии эндометрия (циклический или постоянный режим), которые могут ослаблять или нивелировать благоприятные эффекты эстрогенов. Важно отметить, что именно прогестагеновый компонент определяет различия общих метаболических и клинических эффектов, вызываемых комбинированными гормональными препаратами, что влияет на выбор того или иного средства [11–13]. Недавние обзорные исследования показывают, что идеальные фармакологические свойства синтетического прогестина должны как можно больше соответствовать свойствам прогестерона [14–16].
Прогестерон – гормон желтого тела – снижает тонус артериол, пролиферацию гладкомышечных клеток коронарных артерий, блокирует медленные кальциевые каналы. В почках прогестерон уменьшает реабсорбцию ионов натрия. Кроме того, он оказывает позитивное влияние на липидный обмен, снижает уровни триглицеридов (ТГ) и холестерина липопротеидов очень низкой плотности (ХС ЛПОНП). Прогестерон, также участвуя в регуляции свертывающей системы крови, снижает уровень антитромбина III и концентрацию фактора VIII. Прогестерон взаимодействует с PPARγ рецепторами адипоцитов висцерального жира, повышая таким образом чувствительность периферических тканей к инсулину. Кроме того, он участвует в дифференцировке адипоцитов, препятствуя развитию висцерального ожирения.
Наиболее близок к прогестерону дроспиренон – прогестин, обладающий антиминералокортикоидными и антиандрогенными свойствами. Известно, что его антиминералокортикоидная активность превосходит таковую известного антагониста альдостерона – спиронолактона. Не менее важным свойством дроспиренона является воздействие на висцеральную жировую ткань и дифференцировку адипоцитов, которое препятствует увеличению объема висцерального жира, нормализует чувствительность к инсулину и липидный обмен. Эти свойства дроспиренона крайне важны для профилактики метаболического синдрома (МС) и артериальной гипертонии (АГ) у женщин в ранней постменопаузе. В связи с этим представляет интерес исследование влияния комбинированной гормональной терапии, включающей наряду с эстрогеном дроспиренон, на АД, липидный обмен, состояние микроциркуляции и сосудистой стенки у женщин в пре- и постменопаузе.
Целью нашего исследования явилось изучение влияния гормональной терапии, содержащей низкодозированный эстроген и дроспиренон, на уровень АД, метаболический статус, психоэмоциональные, вегетативные расстройства и липидный профиль у женщин в пре- и постменопаузе.
Материалы и методы
Было обследовано 178 женщин с диагностированным нарушением менструальной функции (пременопауза, постменопауза) в сочетании с климактерическим синдромом. Средний возраст пациенток составил 49,6 ± 5,63 года. Средняя продолжительность менопаузы составила 5,02 ± 4,39 года. Критерии включения: возраст от 43 до 58 лет; дефицит эстрогенов, подтвержденный повышением уровня ФСГ более 30 мМЕ/л; наличие жалоб, представленных симптомокомплексом дефицита эстрогенов; согласие женщин на использование гормональной терапии и отсутствие противопоказаний для ЗГТ.
Для комплексной оценки изменений в психоэмоциональной сфере, оценки состояния сердечно-сосудистой системы, вегетативной регуляции, качества жизни с учетом особенностей гормонального профиля при применении различных режимов ЗГТ, установления корреляционных связей, а также для обоснования выбора оптимальных режимов ЗГТ обследованные женщины были распределены на группы в соответствии с характером проводимой терапии.
Первую (I) группу составили 64 женщины в пременопаузе, желающие принимать оральный контрацептив, с жалобами на вазомоторные, психоэмоциональные нарушения. Средний возраст пациенток составил 43,0 ± 5,9 года. Терапия в данной группе проводилась препаратом Джес (Schering, Германия). Джес содержит этинилэстрадиол 20 мкг и дроспиренон 3 мг. Препарат Джес принимают по 1 таблетке в день в течение 28 дней, по схеме 24 + 4.
Во вторую (II) группу вошли 43 женщины в постменопаузе, предъявляющие урогенитальные, вазомоторные, психоэмоциональные жалобы, желающие принимать ЗГТ и не имеющие противопоказаний к ней. Средний возраст пациенток составил 52,0 ± 5,03 года. Терапия в данной группе проводилась препаратом Анжелик (Schering, Германия). Анжелик представляет собой комбинацию 1мг 17-β-эстрадиола и 2 мг дроспиренона. Схема приема – по 1 таблетке ежедневно в непрерывном режиме.
Курс проводимой терапии в обеих группах составил 12 месяцев. Каждая группа включала в себя группы контроля (Ia, IIa), состоящие из пациенток, не получающих гормональную терапию. В Ia группу вошли 46 пациенток, средний возраст которых составил 45,0 ± 4,9 года. Во IIа группу вошли 25 пациенток, средний возраст которых составил 52,6 ± 6,01 года. Женщины в этих группах не получали гормональную терапию.
При изучении анамнеза пациенток I группы было установлено, что средний возраст наступления пременопаузы составил 49,0 ± 2,6 года, в группе сравнения Ia составил 48,3 ± 5,0 года. Средний возраст наступления менопаузы во II группе составил 47,1 ± 5,9 года, во IIа группе – 43,8 ± 4,6 года. Продолжительность постменопаузы во II группе составляла 3,8 ± 3,2 года, во IIа группе – 8,8 ± 5,1 года (табл. 1).
Все наблюдаемые женщины находились в состоянии пременопаузы и постменопаузы и имели соответствующие жалобы, обусловленные дефицитом эстрогенов. Среди жалоб преобладали приливы жара (90%), потливость (65%), головные боли напряжения (50%), перебои в работе сердца, гипервентиляционный синдром (35%) (чувство нехватки воздуха), гастроинтестинальный дискомфорт. Отмечались также психоэмоциональные нарушения в виде снижения фона настроения, раздражительности, выраженной слабости, немотивированной тревоги в той или иной степени. Астенические жалобы и нарушенный сон беспокоили 70% больных.
В исследование не были включены пациентки с АГ III степени (АД > 180/110 мм рт. ст.); симптоматическими артериальными гипертензиями; ишемической болезнью сердца; острым нарушением мозгового кровообращения или преходящим нарушением мозгового кровообращения в анамнезе; сахарным диабетом 1 и 2 типа; сопутствующими заболеваниями, требующими дополнительной терапии и затрудняющими оценку эффективности и переносимости препаратов; тяжелыми заболеваниями печени; уровнем креатинина сыворотки крови 200 мкмоль/л и выше, уровнем калия сыворотки крови более 5,0 ммоль/л; с подтвержденным или предполагаемым диагнозом рака молочной железы; подтвержденным или предполагаемым диагнозом эстрогензависимого предракового заболевания или эстрогензависимой злокачественной опухоли; венозными и артериальными тромбозами и тромбоэмболиями в анамнезе; кровотечениями из половых путей неясной этиологии; выраженной гипертриглицеридемией (более 5 ммоль/л).
Всем пациентам проводилось стандартное общеклиническое обследование с определением антропометрических параметров, гинекологическое обследование (включая мазок на онкоцитологию). Лабораторные исследования включали изучение липидного спектра, уровня глюкозы, мочевой кислоты, аспарагиновой и аланиновой печеночных трансаминаз, креатинфосфокиназы, пероральный тест на толерантность к глюкозе, общий анализ крови, гормональный анализ крови, исследовалась гемостазиограмма.
При гинекологическом исследовании дополнительно проводилась маммография, УЗИ органов малого таза для определения противопоказаний к назначению гормональной терапии. При обследовании также проводили офисное измерение АД, ЭКГ. Всем женщинам проводилось анкетирование с использованием теста Бека для оценки выраженности депрессивных расстройств, теста Спилбергера, вопросник для выявления признаков вегетативных изменений, изучение модифицированного менопаузального индекса.
Статистическую обработку данных проводили с использованием пакета программ Stat Soft Ins. (США) Statistica 6,0 для Microsoft Windows. Все показатели проверяли на соответствие нормальному распределению. Использовали параметрический t-критерий Стьюдента. Результаты представлены в виде среднего арифметического значения и его среднеквадратичного отклонения (М ± σ) в виде медианы, или в виде процента больных из анализируемой группы. Сравнение групп по количественным и порядковым признакам проводилось непараметрическим методом с использованием критерия Манна – Уитни. Сравнение результатов лечения внутри групп проводилось с использованием критерия Вилкоксона. Различия считали достоверными при уровне значимости р ≤ 0,05.
Результаты
Исходно выявлено, что в I группе (пациенты, принимавшие Джес) до начала исследования АГ I степени зарегистрирована у 50%, через 12 месяцев количество пациентов с АГ уменьшилось до 38%. АГ II степени в этой группе пациентов исходно зарегистрирована у 9% пациенток, через 12 месяцев наблюдения уже у 5%. Во II исследуемой группе (пациенты, принимавшие Анжелик) наблюдалась положительная динамика на фоне приема ЗГТ. Так, АГ I степени исходно отмечена в 54%, через 12 месяцев наблюдения – в 49% случаев; АГ II степени исходно выявлена в 6%, через 12 месяцев – в 4% случаев. Таким образом, количество женщин в I и II группах с АГ (АД ≥ 140/90 мм рт. ст.) достоверно уменьшилось через 12 месяцев приема гормональной терапии, содержащей низкодозированный эстроген и дроспиренон (p < 0,005). Положительная динамика АД связана, по всей вероятности, с влиянием эстрогенов на реактивность сосудистой стенки и с антиминералокортикоидным эффектом дроспиренона, входящего в состав назначаемых препаратов.
При анализе динамики показателей АД в группах сравнения (Iа, IIа) установлена тенденция к его повышению. Нормальные показатели до начала исследования наблюдались у 43% в Iа группе женщин в пременопаузе и у 55% женщин во IIа группе у женщин в постменопаузе. Через 12 месяцев наблюдения в данных группах нормальные показатели АД составили 42% в Ia группе и 50% во IIа группе соответственно. При этом АГ I степени в Iа группе исходно наблюдалась у 50% пациентов, через 12 месяцев наблюдения уже у 52%. Количество женщин в контрольной Iа группе пациенток в пременопаузе с АГ II степени через 12 месяцев наблюдения увеличилось на 1%. АД у пациенток в IIa группе контроля в постменопаузе, которые не принимали ЗГТ, также имело тенденцию к увеличению. Количество женщин с АГ I степени возросло на 2%, с АГ II степени увеличилось на 1% (рис. 1).
При офисном измерении АД в среднем уровень САД в I группе пациенток, принимавших Джес, снизился на 7,5 мм рт. ст., уровень ДАД в среднем уменьшился на 1,9 мм рт. ст., в то время как в Iа группе контроля женщин в пременопаузе выявлено увеличение САД в среднем на 1,6 мм рт. ст. и ДАД в среднем повысилось на 0,3 мм рт. ст. Во II группе на фоне приема препарата Анжелик отмечалось снижение САД в среднем на 8,2 мм рт. ст., ДАД в среднем уменьшилось на 2,5 мм рт. ст. В контрольной IIа группе пациенток, не принимавших ЗГТ, отмечалось увеличение САД в среднем на 0,9 мм рт. ст. и ДАД в среднем на 1,8 мм рт. ст. (p < 0,005) (рис. 2).
Через 12 месяцев в I и во II группах также выявлено достоверное снижение массы тела. В I группе пациенток в пременопаузе, принимавших Джес, вес снизился в среднем на 3,0 кг, напротив, в Ia группе масса тела повысилась в среднем на 4,9 кг (p < 0,005). У женщин в постменопаузе во II группе пациенток, принимавших Анжелик, вес уменьшился в среднем на 3,3 кг (p < 0,005). В контрольной IIа группе женщин в постменопаузе отмечалось увеличение массы тела в среднем на 3,2 кг (p < 0,005) (рис. 3).
В целом анализ динамики изменения веса показал, что на фоне приема орального контрацептива Джес и препарата для ЗГТ Анжелик вес у женщин не только не увеличивался, но и отмечалось достоверное снижение данного показателя в отличие от женщин, которые не принимали гормональную терапию, содержащую эстроген/дроспиренон.
При исследовании динамики показателя окружности талии (ОТ) выявлено, что в I группе у женщин в пременопаузе на фоне приема препарата Джес через 12 месяцев показатель ОТ снизился в среднем на 3,7 см (p < 0,005), и напротив, в Iа группе контроля пременопаузальных женщин показатель ОТ через 12 месяцев наблюдения увеличился на 2,8 см (p < 0,005). Во II группе у женщин в постменопаузе, получавших препарат Анжелик, показатель ОТ через 12 месяцев уменьшился на 5,2 см (p < 0,005); в контрольной IIа группе (женщины в постменопаузе, не принимавшие ЗГТ) показатель ОТ увеличился в среднем на 7,8 см (p < 0,005) (рис. 4).
При исследовании показателя ИМТ в группах в I группе женщин в пременопаузе отмечалось уменьшение в среднем с 25,2 ± 1,7 кг/м2 до 24,8 ± 1,0 кг/м2. Во II группе женщин, принимавших Анжелик, через 12 месяцев наблюдения также отмечалось снижение показателя ИМТ в среднем с 27,3 ± 1,4кг/м2 до 25,6 ± 1,2 кг/м2 (р < 0,005). В группе сравнения Ia женщин в пременопаузе показатель ИМТ увеличился в среднем с 26,0 ± 1,0 кг/м2 до 26,8 ± 1,2 кг/м2. Во IIа группе контроля женщин в постменопаузе показатель ИМТ через 12 месяцев наблюдения увеличился в среднем с 26,6 ± 1,5 кг/м2 до 28,0 ± 1,5 кг/м2 (р < 0,005).
Мы также оценивали влияние гормональной терапии на липидный спектр крови у наших пациенток. У женщин, получавших гормональную терапию в I и во II группах, отмечено достоверное снижение показателей общего холестерина (ХС), холестерина липопротеидов низкой плотности (ХС ЛПНП). При оценке динамики через 12 месяцев в липидном спектре отмечалось снижение уровня общего ХС в I группе у женщин в пременопаузе на 8% (в среднем на 0,45 ммоль/л). В Iа группе сравнения женщин в пременопаузе выявлено увеличение показателя общего холестерина на 0,2% (в среднем на 0,01 ммоль/л) (р < 0,005). Во II группе женщин в постменопаузе, принимавших Анжелик, отмечалось снижение показателя общего ХС на 4% (0,27 ммоль/л) (р < 0,005), а в группе IIа контроля женщин в постменопаузе отмечалось увеличение этого показателя на 2% (0,1 ммоль/л) (р < 0,005). При анализе динамики показателя ХС ЛПНП в I группе женщин в пременопаузе, принимающих Джес, отмечено снижение этого показателя через 12 месяцев на 5% (0,2 ммоль/л) (р < 0,005), когда в Iа группе женщин в пременопаузе отмечено увеличение ХС ЛПНП на 3% (в среднем 0,1 ммоль/л) (р < 0,005). Во II группе женщин, принимающих Анжелик, через 12 месяцев выявлено увеличение ХС ЛПНП на 12% (0,45 ммоль/л) (р < 0,005). В IIа группе женщин в постменопаузе наблюдалось увеличение уровня ХС ЛПНП на 11% (0,35 ммоль/л) (р < 0,005). В группах пациенток, получавших Джес и Анжелик, также отмечена тенденция к увеличению уровня холестерина липопротеидов высокой плотности (ХС ЛПВП) и снижение уровня триглицеридов (ТГ), которые не имели статистической значимости. Так, показатель ХС ЛПВП в I группе женщин в пременопаузе увеличился на 19%, во II группе женщин, принимающих Анжелик, увеличился на 9% через 12 месяцев. Уровень ТГ также имел тенденцию к снижению в I и II группах: в I группе женщин в пременопаузе, принимавших Джес, этот показатель через 12 месяцев снизился в среднем с 1,1 ± 0,4 ммоль/л до 1,1 ± 0,5 ммоль/л, во II группе женщин в постменопаузе, принимавших Анжелик, уровень ТГ снизился в среднем с 1,3 ± 1,1ммоль/л до 1,4 ± 0,7ммоль/л. В Iа группе женщин в пременопаузе уровень ТГ увеличился с 1,2 ± 0,6ммоль/л до 1,3 ± 0,47 ммоль, в IIа группе женщин в постменопаузе не принимавших ЗГТ, уровень ТГ увеличился в среднем с 1,4 ± 0,2 ммоль/л до 1,5 ± 0,4 ммоль/л через 12 месяцев. Таким образом, в Ia и IIa группах сравнения пациенток отмечалось достоверное увеличение уровня атерогенных фракций и недостоверное снижение уровня ЛПВП-холестерина (рис. 5). В проведенном исследовании не было обнаружено достоверных изменений уровня глюкозы натощак, а также изменений постпрандиального уровня глюкозы при проведении перорального теста толерантности к глюкозе.
В задачи нашего исследования также входила оценка влияния приема орального контрацептива Джес и препарата для ЗГТ Анжелик на выраженность климактерического синдрома. Оценка тяжести климактерического синдрома проводилась при помощи модифицированного менопаузального индекса (ММИ) в баллах, симптомокомплексы которого оценивались по отдельности. При анализе данных было выявлено отсутствие достоверных различий между группами по нейровегетативным симптомам, обменно-эндокринные преобладали у пациенток I и IIа групп, а психоэмоциональные у пациенток II и IIа групп. Через 12 месяцев у пациенток в пременопаузе I группы, принимавших Джес, нейровегетативные нарушения у 93% (60) практически отсутствовали, при этом средний балл выраженности нейровегетативных симптомов снизился с 15,2 ± 0,7 до 1,2 ± 0,4 балла (р < 0,05). Психоэмоциональные нарушения в этой группе через 12 месяцев отсутствовали у 80% (51) женщин, средний балл уменьшился с 10,0 ± 0,7 баллов до 1,5 ± 0,2 баллов. Обменно-эндокринные нарушения у женщин в пременопаузе, принимавших Джес, через 12 месяцев уменьшились с 4,3 ± 0,2 до 1,1 ± 0,2 балла (р < 0,05). В Iа группе сравнения женщин в пременопаузе через 12 месяцев при анализе динамики нейровегетативных, психоэмоциональных и обменно-эндокринных нарушений положительной динамики не наблюдалось. Средний балл нейровегетативных нарушений остался приблизительно на прежнем уровне при исходном значении в среднем 16,4 ± 0,5 балла и через 12 месяцев равном 16,6 ± 0,5 балла. Через 12 месяцев наблюдения отмечено, что уровень выраженности обменно-эндокринных нарушений увеличился в среднем с 3,8 ± 0,5 до 4,2 ± 0,4 балла, средний балл психоэмоциональных нарушений увеличился с 11,6 ± 0,4 до 15,0 ± 0,3 балла (р < 0,05). Во II группе женщин в постменопаузе, принимавших Анжелик, через 12 месяцев наблюдалось уменьшение нейровегетативных, психоэмоциональных и обменно-эндокринных нарушений. Средний балл нейровегетативных нарушений через 12 месяцев снизился с 19,4 ± 0,4 до 3,3 ± 0,5 балла, обменно-эндокринных нарушений в среднем уменьшился с 4,3 ± 0,4 до 1,1 ± 0,2 балла, психоэмоциональных нарушений в среднем снизился с 13,0 ± 0,6 до 1,6 ± 0,3 балла (р < 0,05). В IIа группе женщин, не принимавших заместительную гормональную терапию, через 12 месяцев средний балл нейровегетативных нарушений повысился с 20,0 ± 0,5 балла до 25 ± 0,5 балла, средний балл обменно-эндокринных нарушений увеличился с 4,8 ± 0,5 балла до 6,0 ± 0,5 балла, средний балл психоэмоциональных нарушений через 12 месяцев увеличился с 12,4 ± 0,5 балла до 18,0 ± 0,5 (р < 0,05). Таким образом, через год наблюдения выраженность всех симптомов в группе женщин в постменопаузе без ЗГТ значительно увеличилась. При анализе общего среднего балла ММИ в I группе женщин, принимающих Джес, при исходном среднем значении 29,5 ± 1,7 балла через 12 месяцев отмечалось его снижение до 3,8 ± 0,3 (р < 0,05). В Iа группе наблюдения исходно общий средний балл ММИ исходно составил 31,8 ± 0,5 балла, через 12 месяцев наблюдения увеличился до 35,8 ± 0,8 балла (р < 0,05). Во II группе женщин в постменопаузе, принимавших Анжелик, исходно этот показатель составил 36,7 ± 0,2 балла, а через 12 месяцев снизился до 6,0 ± 0,3 (р < 0,05). В группе контроля IIа женщин в постменопаузе отмечалось увеличение общего среднего балла ММИ с 37,2 ± 0,2 балла до 11,8 ± 0,5 баллов (р < 0,05) (рис. 6).
Помимо ММИ для оценки вегетативных расстройств нами использовался вопросник, разработанный в отделе патологии вегетативной нервной системы под руководством А.М. Вейна. До начала исследования все женщины, по данным опросника, набрали более 15 баллов, что является показателем вегето-сосудистой дисфункции. Средний балл вегетативной дисфункции исходно в I группе, принимавших Джес, составил 17,5 ± 2,26, а через 12 месяцев снизился до 11,4 ± 0,34 (р < 0,05). В Iа группе женщин в пременопаузе через 12 месяцев наблюдения средний балл увеличился с 16,5 ± 3,5 до 16,9 ± 3,7 (р < 0,05). Во II группе пациентов, принимавших Анжелик, выявлено снижение показателя вегетативной дисфункции в среднем с 20,8 ± 4,2 до 12,7 ± 3,8 (р < 0,05). В группе сравнения IIа женщин, не получавших ЗГТ, средний балл через 12 месяцев увеличился с 19,4 ± 1,6 до 20,2 ± 4,2 (р < 0,05) (рис. 7).
Манифестация климактерического синдрома в виде приливов, повышенной потливости, раздражительности, эмоциональной лабильности, вызывает развитие психосоциального стресса, который характеризуется головными болями напряжения, пониженной концентрацией внимания, бессонницей, депрессивными симптомами [25]. В нашем исследовании мы оценивали эмоциональное состояние пациенток и степень выраженности депрессивных расстройств с помощью анкеты Бека. При оценке психологического статуса мы выявили, что в исследуемых группах у большинства пациенток наблюдаются депрессивные расстройства различной степени выраженности. Наличие депрессивных расстройств в период пре- и постменопаузы можно объяснить как прямым эффектом гипоэстрогении вследствие недостаточного эстрогенного влияния на структуры центральной нервной системы, так и выраженностью вазомоторных симптомов. Через 12 месяцев выраженность депрессивных расстройств уменьшилась в группах пациентов, принимавших Джес и Анжелик. Положительный эффект наблюдался уже через 3 месяца. Средний балл в I группе женщин, принимавших Джес, снизился с 19,14 ± 0,09, что соответствует умеренно-мягкой степени выраженности, до 13,3 ± 0,1 (р < 0,05) (мягкая степень выраженности расстройств). Во II группе пациентов в постменопаузе, принимавших Анжелик, средний балл через 12 месяцев снизился с 28,2 ± 0,03 до 14,9 ± 0,03 (р < 0,05) (умеренно-мягкая степень выраженности). В группах сравнения Iа, IIа степень выраженности депрессивных расстройств через 12 месяцев практически не изменилась (рис. 8).
Для выявления личностной и реактивной тревожности пациенток нами применялся тест Спилбергера. Мы установили наличие той или иной степени тревожности у всех пациенток в исследуемых группах. В I и Iа группах преобладала тревожность средней степени выраженности, во II и IIа группах – высокая степень. Через 12 месяцев средний балл реактивной тревожности в I группе женщин в пременопаузе, принимавших Джес, снизился с 40,6 ± 0,8 до 29,3 ± 0,2 балла. В группе сравнения Iа женщин в пременопаузе не отмечалось существенных изменений этого показателя: исходно средний балл составил 41,2 ± 1,0, через 12 месяцев – 40,2 ± 0,5. Во II группе пациенток в постменопаузе, принимавших Анжелик, средний балл снизился с 42,8 ± 0,4 до 30,0 ± 0,4. Во IIа группе сравнения женщин в постменопаузе показатель реактивной тревожности в среднем увеличился с 35,5 ± 0,1 до 36,0 ± 0,1 балла (рис. 9). В I группе, где исходно преобладали тревожные расстройства средней степени выраженности (64%), через 12 месяцев стали преобладать расстройства низкой степени (70%). Средняя степень тревожности в этой группе, принимавших Джес, снизилась на 39%. Высокая степень тревожности исходно составила 16% в этой группе пациенток, через 12 месяцев высокая степень тревожности наблюдалась лишь у 5%. В группе сравнения Iа женщин в пременопаузе степень выраженности тревожных расстройств увеличилась через 12 месяцев. При этом низкая степень тревожности уменьшилась на 8%, средняя – увеличилась на 6%, высокая – увеличилась на 2%. В постменопаузе в группе пациенток, получающих Анжелик, низкая степень увеличилась на 45%, средняя – увеличилась на 5%, высокая – снизилась на 50%. В группе сравнения IIа женщин в постменопаузе без ЗГТ через 12 месяцев наблюдения стали доминировать расстройства высокой степени (60%) (рис. 10). Таким образом, на фоне приема как Джес, так и Анжелик, нами было отмечено существенное положительное влияние на выраженность тревожных расстройств и депрессии.
На фоне назначения гормональной терапии не наблюдалось существенной динамики показателей креатинина, АСТ и АЛТ, калия, гемостазиограммы. Побочных эффектов, связанных с приемом препарата, не выявлено, абсолютное большинство пациентов отметили хорошую переносимость препарата и отсутствие нежелательных явлений при его назначении.
Обсуждение результатов
Результаты анализа нашей работы показали благоприятное влияние гормональной терапии комбинированными препаратами, содержащими низкие дозы эстрогена и дроспиренон, на уровень АД, висцеральное ожирение, метаболический статус и вегетативные и психоэмоциональные симптомы – как у женщин в пременопаузе, принимавших Джес, так и у женщин в ранние сроки постменопаузы с климактерическим синдромом, принимавших Анжелик. Уменьшение проявлений МС и АГ у женщин в пременопаузе и ранней постменопаузе в нашем исследовании, вероятно, обусловлено, в большей мере, воздействием прогестагена дроспиренона. В ходе работы было выявлено, что дроспиренон, как селективный блокатор альдостерона, в сочетании с натуральным эстрогеном, вероятно, обеспечивает достоверное снижение как систолического, так и диастолического АД у женщин в постменопаузе с АГ. Особенно важно снижение систолического АД, так как именно оно связано с более высоким сердечно-сосудистым риском по сравнению с диастолическим АД у женщин с АГ [17, 18]. Как известно, активация РААС под влиянием различных синтетических эстрогенов и прогестагенов способствует повышению содержания в организме натрия [19]. Повышенный уровень АД нормализуется, если эстрогены используются в комбинации с тиазидными диуретиками или спиронолактоном, что свидетельствует о том, что эти сдвиги АД могут быть связаны с задержкой натрия. При использовании дроспиренона в терапевтической дозе происходит немедленная активация натрийуреза. Помимо потери натрия, снижение уровня АД свидетельствует о непосредственном влиянии дроспиренона на РААС сосудов, заключающемся в повышении растяжимости артериальной стенки. Эти свойства особенно важны у женщин в пре- и постменопаузе с АГ, развитие которой у них, как известно, в определенной степени связано с повышением жесткости стенок артерий [20]. В рандомизированных плацебоконтролируемых исследованиях было показано, что дроспиренон, являясь антагонистом альдостерона, оказывает значимое влияние на уровень АД у женщин в постменопаузе, страдающих АГ. Исходно у женщин с нормальным уровнем АД не обнаружено значимых изменений показателей АД [19, 26].
В некоторых исследованиях с участием женщин в постменопаузе было показано, что применение ЗГТ связано с благоприятным воздействием на липидный профиль [21]. В нашем исследовании также через 12 месяцев на фоне заместительной гормональной терапии, содержащей дроспиренон, отмечалась тенденция к снижению атерогенных фракций липидов и повышению ХС ЛПВП, улучшение метаболического статуса. Результаты других исследований, в которых проводилось сравнение эффективности монотерапии эстрадиолом и комбинированным препаратом Анжелик у женщин в постменопаузе с МС и АГ, показали, что только терапия препаратом Анжелик приводила к снижению массы тела, в то время как монотерапия эстрадиолом, напротив, вызывала повышение веса тела. Кроме того, была отмечена более существенная положительная динамика уровня АД и показателей липидного обмена на фоне терапии препаратом Анжелик в сравнении с монотерапией эстрадиолом. В то же время применение оральных контрацептивов оказывает как благоприятное, так и отрицательное влияние на липидный профиль и, следовательно, на риск возникновения атеросклероза. По данным K. Fotherby, при применении орального контрацептива, содержащего 30 мкг этинилэстрадиола и 150 мкг левоноргестрела, было выявлено снижение ХС ЛПНП в 12 и отсутствие изменений этого показателя в 13 исследованиях [22]. В другом исследовании с трехфазным оральным контрацептивом, содержащем этинилэстрадиол и левоноргестрел, не было выявлено изменений в показателях ХС ЛПНП и ХС ЛПВП. При изучении влияния этинилэстрадиола в комбинации с 150 мкг дезогестрела в 15 исследованиях было показано повышение сывороточного ХС ЛПВП, в 4 не было выявлено изменений, а в 9 исследованиях не было выявлено изменений в показателях ХС ЛПНП, в 2 наблюдалось его снижение. Кроме того, дальнейшее изучение показало, что изменения в липидном спектре не увеличиваются во время приема оральных контрацептивов и возвращаются к своему исходному уровню после отмены препарата [23]. В нашем исследовании отмечалась тенденция к повышению ХС ЛПВП в группе женщин, принимавших оральный контрацептив Джес, что обусловлено положительным действием эстрогена и отсутствием антиандрогенной активности дроспиренона. Похожие результаты по влиянию на липидный спектр были получены в исследовании S. Taneepanichskul и соавт. при изучении комбинации 30 мкг этинилэстрадиола и 3 мг дроспиренона [24], где выявили достоверное увеличение ХС ЛПВП на 25,7%, а также достоверное снижение ХС ЛПНП на 9,9% в сравнении с исходным уровнем через 6 месяцев.
Таким образом, наша работа показала положительное влияние приема орального контрацептива Джес и препарата для ЗГТ Анжелик на уровень АД, метаболический статус, выраженность климактерического синдрома, липидный профиль у наблюдаемых женщин в пременопаузе и ранней постменопаузе. Наше исследование продемонстрировало благоприятное влияние гормональной терапии, содержащей низкий уровень эстрогена и прогестаген дроспиренон, на снижение выраженности основных факторов риска ишемической болезни сердца.
В настоящее время в Европе средняя продолжительность жизни женщин превышает 80 лет, а поскольку возраст наступления менопаузы значительно не меняется (в среднем 51,3 года), длительность постменопаузы составляет примерно 30–40% общей продолжительности их жизни. Несмотря на то что своевременная менопауза относится к числу физиологических явлений, она является предвестником многих потенциальных проблем со здоровьем, которые могут повлиять не только на качество, но подчас и на продолжительность жизни женщины. Специфическими проявлениями в этот период могут быть вазомоторная нестабильность, психологические, психосоматические расстройства и урогенитальные симптомы, появление которых заставляет многих женщин обращаться за медицинской помощью. Однако большинство не подозревают о долгосрочных последствиях дефицита эстрогенов, к которым в первую очередь относятся ССЗ и остеопороз. Исследования последних лет свидетельствуют о том, что эти нарушения могут быть «запрограммированы» уже in utero. Таким образом, многие женщины в постменопаузе уже имеют латентные признаки этих заболеваний и нередко такие серьезные события, как инфаркт миокарда или переломы вследствие остеопороза, возникают до первого обращения к гинекологу с вазомоторными жалобами.
У многих женщин уже в переходный период (в пременопаузе) начинают развиваться взаимосвязанные сосудистые и метаболические изменения, такие как увеличение веса, нарушение липидного и углеводного обмена, а также эндотелиальная дисфункция [2]. Андроидное ожирение, связанное с наступлением менопаузы, способствует повышению резистентности к инсулину на периферии наряду с повышением уровня артериального давления (АД) и ухудшением липидного профиля. Прослеживается четкая взаимосвязь между длительностью постменопаузы и уровнем АД, поскольку параллельно с изменением гормонального статуса происходит увеличение симпатического тонуса, активация ренин-ангиотензин-альдостероновой системы (РААС) и повышение чувствительности к соли у женщин. С клинической точки зрения отсутствие контроля над высоким уровнем АД является одним из самых важных сердечно-сосудистых факторов риска у женщин в постменопаузе, так как риск развития ССЗ повышается в 4 раза по сравнению с лицами того же возраста с нормальным уровнем АД. Только что опубликованные результаты крупного популяционного исследования еще раз подтверждают важность снижения уровня АД у женщин для сокращения сердечно-сосудистого риска по сравнению с мужчинами [3].
В последние годы в ряде работ получены интересные результаты, свидетельствующие о том, что наличие вазомоторных симптомов у женщин в постменопаузе коррелирует с повышенным риском ССЗ, углеводными и липидными нарушениями. Так, G.-C. M. Gast и соавт. [4], наблюдавшие с 1995 по 2000 г. когорту женщин (n = 10 787) в возрасте 46–64 лет в Швеции и Дании, выявили, что вазомоторные проявления коррелировали с повышением риска ССЗ с величиной индекса массы тела (ИМТ), уровнем холестерина и гипертензией по сравнению с теми, у кого эти симптомы отсутствовали. В исследовании SWAN (Women’s Health Across the Nation) у женщин с приливами с большей вероятностью выявлялись такие латентные нарушения, как эндотелиальная дисфункция или кальцификация аорты, по сравнению с женщинами без приливов [5]. Кроме того, женщины в постменопаузе с вазомоторными симптомами демонстрировали более высокий уровень систолического АД не только в дневное время, но также и во время ночного сна, по сравнению со сверстницами, не имевшими симптомов. Показано, что у женщин с менопаузальными проявлениями наблюдается более низкий уровень антиоксидантной активности плазмы, а именно: сниженные концентрации сульфгидрильных групп и более высокие значения липопероксидов, чем у женщин без приливов. Таким образом, приливы у женщин в постменопаузе коррелируют с наличием оксидативного стресса, в свою очередь связанного с повышением риска ССЗ.
Можно предположить, что наличие выраженных приливов является индикатором латентно протекающих ССЗ и способствует значительно более высокому пожизненному риску неблагоприятных событий со стороны сердечно-сосудистой системы у женщин в постменопаузе [6]. Этот факт может объяснять, по крайней мере частично, отрицательное влияние или отсутствие какого-либо эффекта заместительной гормональной терапии (ЗГТ) на ССЗ в тех испытаниях, где терапия была назначена в основном пожилым женщинам без вазомоторных симптомов, в то время как результаты ЗГТ были положительными (значимое снижение числа сердечно-сосудистых осложнений) в наблюдательных исследованиях, в которых здоровые женщины в переходном периоде получали терапию в связи с вазомоторными симптомами.
Эстрогены могут оказывать как положительное, так и отрицательное действие на сердечно-сосудистую систему [7]. Так, эстрогены оказывают позитивное влияние на липидный профиль в виде снижения уровня общего холестерина (ХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), липопротеина (а) и аполипопротеина, повышения уровня холестерина липопротеидов высокой плотности (ХС ЛПВП). На эндотелиальную функцию эстрогены воздействуют следующим образом:
- подавляют апоптоз и пролиферацию гладкомышечных клеток стенки сосуда, возникающую в ответ на повреждение;
- оказывают противовоспалительное и антиоксидантное действие;
- увеличивают продукцию простациклина и оксида азота;
- блокируют кальциевые каналы.
Несмотря на имеющиеся данные, многие аспекты влияния эстрогенов на сердечно-сосудистую систему остаются невыясненными. Особенно важно дальнейшее изучение влияния гормонов в пре- и постменопаузальном периоде. По данным Фрамингемского исследования было выявлено, что число сердечно-сосудистых осложнений в период постменопаузы увеличилось в 2,6 раза в сравнении с пременопаузой [10]. Риск развития ССЗ, связанный с наступлением хирургической менопаузы, увеличивался в 2,7 раза по сравнению с периодом пременопаузы у женщин того же возраста (p < 0,01) и был в 2,2 раза выше, чем у женщин с естественной менопаузой. Применение гормональной терапии в этом периоде, возможно, обеспечит дополнительные преимущества в снижении риска сердечно-сосудистых осложнений. Так как современные препараты для гормональной терапии отличаются по содержанию эстрогенов и прогестинового компонента, требуется дальнейшие изучение их влияния на сердечно-сосудистую систему. В состав препаратов для комбинированной гормональной терапии входят прогестагены, необходимые для профилактики гиперплазии эндометрия (циклический или постоянный режим), которые могут ослаблять или нивелировать благоприятные эффекты эстрогенов. Важно отметить, что именно прогестагеновый компонент определяет различия общих метаболических и клинических эффектов, вызываемых комбинированными гормональными препаратами, что влияет на выбор того или иного средства [11–13]. Недавние обзорные исследования показывают, что идеальные фармакологические свойства синтетического прогестина должны как можно больше соответствовать свойствам прогестерона [14–16].
Прогестерон – гормон желтого тела – снижает тонус артериол, пролиферацию гладкомышечных клеток коронарных артерий, блокирует медленные кальциевые каналы. В почках прогестерон уменьшает реабсорбцию ионов натрия. Кроме того, он оказывает позитивное влияние на липидный обмен, снижает уровни триглицеридов (ТГ) и холестерина липопротеидов очень низкой плотности (ХС ЛПОНП). Прогестерон, также участвуя в регуляции свертывающей системы крови, снижает уровень антитромбина III и концентрацию фактора VIII. Прогестерон взаимодействует с PPARγ рецепторами адипоцитов висцерального жира, повышая таким образом чувствительность периферических тканей к инсулину. Кроме того, он участвует в дифференцировке адипоцитов, препятствуя развитию висцерального ожирения.
Наиболее близок к прогестерону дроспиренон – прогестин, обладающий антиминералокортикоидными и антиандрогенными свойствами. Известно, что его антиминералокортикоидная активность превосходит таковую известного антагониста альдостерона – спиронолактона. Не менее важным свойством дроспиренона является воздействие на висцеральную жировую ткань и дифференцировку адипоцитов, которое препятствует увеличению объема висцерального жира, нормализует чувствительность к инсулину и липидный обмен. Эти свойства дроспиренона крайне важны для профилактики метаболического синдрома (МС) и артериальной гипертонии (АГ) у женщин в ранней постменопаузе. В связи с этим представляет интерес исследование влияния комбинированной гормональной терапии, включающей наряду с эстрогеном дроспиренон, на АД, липидный обмен, состояние микроциркуляции и сосудистой стенки у женщин в пре- и постменопаузе.
Целью нашего исследования явилось изучение влияния гормональной терапии, содержащей низкодозированный эстроген и дроспиренон, на уровень АД, метаболический статус, психоэмоциональные, вегетативные расстройства и липидный профиль у женщин в пре- и постменопаузе.
Материалы и методы
Было обследовано 178 женщин с диагностированным нарушением менструальной функции (пременопауза, постменопауза) в сочетании с климактерическим синдромом. Средний возраст пациенток составил 49,6 ± 5,63 года. Средняя продолжительность менопаузы составила 5,02 ± 4,39 года. Критерии включения: возраст от 43 до 58 лет; дефицит эстрогенов, подтвержденный повышением уровня ФСГ более 30 мМЕ/л; наличие жалоб, представленных симптомокомплексом дефицита эстрогенов; согласие женщин на использование гормональной терапии и отсутствие противопоказаний для ЗГТ.
Для комплексной оценки изменений в психоэмоциональной сфере, оценки состояния сердечно-сосудистой системы, вегетативной регуляции, качества жизни с учетом особенностей гормонального профиля при применении различных режимов ЗГТ, установления корреляционных связей, а также для обоснования выбора оптимальных режимов ЗГТ обследованные женщины были распределены на группы в соответствии с характером проводимой терапии.
Первую (I) группу составили 64 женщины в пременопаузе, желающие принимать оральный контрацептив, с жалобами на вазомоторные, психоэмоциональные нарушения. Средний возраст пациенток составил 43,0 ± 5,9 года. Терапия в данной группе проводилась препаратом Джес (Schering, Германия). Джес содержит этинилэстрадиол 20 мкг и дроспиренон 3 мг. Препарат Джес принимают по 1 таблетке в день в течение 28 дней, по схеме 24 + 4.
Во вторую (II) группу вошли 43 женщины в постменопаузе, предъявляющие урогенитальные, вазомоторные, психоэмоциональные жалобы, желающие принимать ЗГТ и не имеющие противопоказаний к ней. Средний возраст пациенток составил 52,0 ± 5,03 года. Терапия в данной группе проводилась препаратом Анжелик (Schering, Германия). Анжелик представляет собой комбинацию 1мг 17-β-эстрадиола и 2 мг дроспиренона. Схема приема – по 1 таблетке ежедневно в непрерывном режиме.
Курс проводимой терапии в обеих группах составил 12 месяцев. Каждая группа включала в себя группы контроля (Ia, IIa), состоящие из пациенток, не получающих гормональную терапию. В Ia группу вошли 46 пациенток, средний возраст которых составил 45,0 ± 4,9 года. Во IIа группу вошли 25 пациенток, средний возраст которых составил 52,6 ± 6,01 года. Женщины в этих группах не получали гормональную терапию.
При изучении анамнеза пациенток I группы было установлено, что средний возраст наступления пременопаузы составил 49,0 ± 2,6 года, в группе сравнения Ia составил 48,3 ± 5,0 года. Средний возраст наступления менопаузы во II группе составил 47,1 ± 5,9 года, во IIа группе – 43,8 ± 4,6 года. Продолжительность постменопаузы во II группе составляла 3,8 ± 3,2 года, во IIа группе – 8,8 ± 5,1 года (табл. 1).
Все наблюдаемые женщины находились в состоянии пременопаузы и постменопаузы и имели соответствующие жалобы, обусловленные дефицитом эстрогенов. Среди жалоб преобладали приливы жара (90%), потливость (65%), головные боли напряжения (50%), перебои в работе сердца, гипервентиляционный синдром (35%) (чувство нехватки воздуха), гастроинтестинальный дискомфорт. Отмечались также психоэмоциональные нарушения в виде снижения фона настроения, раздражительности, выраженной слабости, немотивированной тревоги в той или иной степени. Астенические жалобы и нарушенный сон беспокоили 70% больных.
В исследование не были включены пациентки с АГ III степени (АД > 180/110 мм рт. ст.); симптоматическими артериальными гипертензиями; ишемической болезнью сердца; острым нарушением мозгового кровообращения или преходящим нарушением мозгового кровообращения в анамнезе; сахарным диабетом 1 и 2 типа; сопутствующими заболеваниями, требующими дополнительной терапии и затрудняющими оценку эффективности и переносимости препаратов; тяжелыми заболеваниями печени; уровнем креатинина сыворотки крови 200 мкмоль/л и выше, уровнем калия сыворотки крови более 5,0 ммоль/л; с подтвержденным или предполагаемым диагнозом рака молочной железы; подтвержденным или предполагаемым диагнозом эстрогензависимого предракового заболевания или эстрогензависимой злокачественной опухоли; венозными и артериальными тромбозами и тромбоэмболиями в анамнезе; кровотечениями из половых путей неясной этиологии; выраженной гипертриглицеридемией (более 5 ммоль/л).
Всем пациентам проводилось стандартное общеклиническое обследование с определением антропометрических параметров, гинекологическое обследование (включая мазок на онкоцитологию). Лабораторные исследования включали изучение липидного спектра, уровня глюкозы, мочевой кислоты, аспарагиновой и аланиновой печеночных трансаминаз, креатинфосфокиназы, пероральный тест на толерантность к глюкозе, общий анализ крови, гормональный анализ крови, исследовалась гемостазиограмма.
При гинекологическом исследовании дополнительно проводилась маммография, УЗИ органов малого таза для определения противопоказаний к назначению гормональной терапии. При обследовании также проводили офисное измерение АД, ЭКГ. Всем женщинам проводилось анкетирование с использованием теста Бека для оценки выраженности депрессивных расстройств, теста Спилбергера, вопросник для выявления признаков вегетативных изменений, изучение модифицированного менопаузального индекса.
Статистическую обработку данных проводили с использованием пакета программ Stat Soft Ins. (США) Statistica 6,0 для Microsoft Windows. Все показатели проверяли на соответствие нормальному распределению. Использовали параметрический t-критерий Стьюдента. Результаты представлены в виде среднего арифметического значения и его среднеквадратичного отклонения (М ± σ) в виде медианы, или в виде процента больных из анализируемой группы. Сравнение групп по количественным и порядковым признакам проводилось непараметрическим методом с использованием критерия Манна – Уитни. Сравнение результатов лечения внутри групп проводилось с использованием критерия Вилкоксона. Различия считали достоверными при уровне значимости р ≤ 0,05.
Результаты
Исходно выявлено, что в I группе (пациенты, принимавшие Джес) до начала исследования АГ I степени зарегистрирована у 50%, через 12 месяцев количество пациентов с АГ уменьшилось до 38%. АГ II степени в этой группе пациентов исходно зарегистрирована у 9% пациенток, через 12 месяцев наблюдения уже у 5%. Во II исследуемой группе (пациенты, принимавшие Анжелик) наблюдалась положительная динамика на фоне приема ЗГТ. Так, АГ I степени исходно отмечена в 54%, через 12 месяцев наблюдения – в 49% случаев; АГ II степени исходно выявлена в 6%, через 12 месяцев – в 4% случаев. Таким образом, количество женщин в I и II группах с АГ (АД ≥ 140/90 мм рт. ст.) достоверно уменьшилось через 12 месяцев приема гормональной терапии, содержащей низкодозированный эстроген и дроспиренон (p < 0,005). Положительная динамика АД связана, по всей вероятности, с влиянием эстрогенов на реактивность сосудистой стенки и с антиминералокортикоидным эффектом дроспиренона, входящего в состав назначаемых препаратов.
При анализе динамики показателей АД в группах сравнения (Iа, IIа) установлена тенденция к его повышению. Нормальные показатели до начала исследования наблюдались у 43% в Iа группе женщин в пременопаузе и у 55% женщин во IIа группе у женщин в постменопаузе. Через 12 месяцев наблюдения в данных группах нормальные показатели АД составили 42% в Ia группе и 50% во IIа группе соответственно. При этом АГ I степени в Iа группе исходно наблюдалась у 50% пациентов, через 12 месяцев наблюдения уже у 52%. Количество женщин в контрольной Iа группе пациенток в пременопаузе с АГ II степени через 12 месяцев наблюдения увеличилось на 1%. АД у пациенток в IIa группе контроля в постменопаузе, которые не принимали ЗГТ, также имело тенденцию к увеличению. Количество женщин с АГ I степени возросло на 2%, с АГ II степени увеличилось на 1% (рис. 1).
При офисном измерении АД в среднем уровень САД в I группе пациенток, принимавших Джес, снизился на 7,5 мм рт. ст., уровень ДАД в среднем уменьшился на 1,9 мм рт. ст., в то время как в Iа группе контроля женщин в пременопаузе выявлено увеличение САД в среднем на 1,6 мм рт. ст. и ДАД в среднем повысилось на 0,3 мм рт. ст. Во II группе на фоне приема препарата Анжелик отмечалось снижение САД в среднем на 8,2 мм рт. ст., ДАД в среднем уменьшилось на 2,5 мм рт. ст. В контрольной IIа группе пациенток, не принимавших ЗГТ, отмечалось увеличение САД в среднем на 0,9 мм рт. ст. и ДАД в среднем на 1,8 мм рт. ст. (p < 0,005) (рис. 2).
Через 12 месяцев в I и во II группах также выявлено достоверное снижение массы тела. В I группе пациенток в пременопаузе, принимавших Джес, вес снизился в среднем на 3,0 кг, напротив, в Ia группе масса тела повысилась в среднем на 4,9 кг (p < 0,005). У женщин в постменопаузе во II группе пациенток, принимавших Анжелик, вес уменьшился в среднем на 3,3 кг (p < 0,005). В контрольной IIа группе женщин в постменопаузе отмечалось увеличение массы тела в среднем на 3,2 кг (p < 0,005) (рис. 3).
В целом анализ динамики изменения веса показал, что на фоне приема орального контрацептива Джес и препарата для ЗГТ Анжелик вес у женщин не только не увеличивался, но и отмечалось достоверное снижение данного показателя в отличие от женщин, которые не принимали гормональную терапию, содержащую эстроген/дроспиренон.
При исследовании динамики показателя окружности талии (ОТ) выявлено, что в I группе у женщин в пременопаузе на фоне приема препарата Джес через 12 месяцев показатель ОТ снизился в среднем на 3,7 см (p < 0,005), и напротив, в Iа группе контроля пременопаузальных женщин показатель ОТ через 12 месяцев наблюдения увеличился на 2,8 см (p < 0,005). Во II группе у женщин в постменопаузе, получавших препарат Анжелик, показатель ОТ через 12 месяцев уменьшился на 5,2 см (p < 0,005); в контрольной IIа группе (женщины в постменопаузе, не принимавшие ЗГТ) показатель ОТ увеличился в среднем на 7,8 см (p < 0,005) (рис. 4).
При исследовании показателя ИМТ в группах в I группе женщин в пременопаузе отмечалось уменьшение в среднем с 25,2 ± 1,7 кг/м2 до 24,8 ± 1,0 кг/м2. Во II группе женщин, принимавших Анжелик, через 12 месяцев наблюдения также отмечалось снижение показателя ИМТ в среднем с 27,3 ± 1,4кг/м2 до 25,6 ± 1,2 кг/м2 (р < 0,005). В группе сравнения Ia женщин в пременопаузе показатель ИМТ увеличился в среднем с 26,0 ± 1,0 кг/м2 до 26,8 ± 1,2 кг/м2. Во IIа группе контроля женщин в постменопаузе показатель ИМТ через 12 месяцев наблюдения увеличился в среднем с 26,6 ± 1,5 кг/м2 до 28,0 ± 1,5 кг/м2 (р < 0,005).
Мы также оценивали влияние гормональной терапии на липидный спектр крови у наших пациенток. У женщин, получавших гормональную терапию в I и во II группах, отмечено достоверное снижение показателей общего холестерина (ХС), холестерина липопротеидов низкой плотности (ХС ЛПНП). При оценке динамики через 12 месяцев в липидном спектре отмечалось снижение уровня общего ХС в I группе у женщин в пременопаузе на 8% (в среднем на 0,45 ммоль/л). В Iа группе сравнения женщин в пременопаузе выявлено увеличение показателя общего холестерина на 0,2% (в среднем на 0,01 ммоль/л) (р < 0,005). Во II группе женщин в постменопаузе, принимавших Анжелик, отмечалось снижение показателя общего ХС на 4% (0,27 ммоль/л) (р < 0,005), а в группе IIа контроля женщин в постменопаузе отмечалось увеличение этого показателя на 2% (0,1 ммоль/л) (р < 0,005). При анализе динамики показателя ХС ЛПНП в I группе женщин в пременопаузе, принимающих Джес, отмечено снижение этого показателя через 12 месяцев на 5% (0,2 ммоль/л) (р < 0,005), когда в Iа группе женщин в пременопаузе отмечено увеличение ХС ЛПНП на 3% (в среднем 0,1 ммоль/л) (р < 0,005). Во II группе женщин, принимающих Анжелик, через 12 месяцев выявлено увеличение ХС ЛПНП на 12% (0,45 ммоль/л) (р < 0,005). В IIа группе женщин в постменопаузе наблюдалось увеличение уровня ХС ЛПНП на 11% (0,35 ммоль/л) (р < 0,005). В группах пациенток, получавших Джес и Анжелик, также отмечена тенденция к увеличению уровня холестерина липопротеидов высокой плотности (ХС ЛПВП) и снижение уровня триглицеридов (ТГ), которые не имели статистической значимости. Так, показатель ХС ЛПВП в I группе женщин в пременопаузе увеличился на 19%, во II группе женщин, принимающих Анжелик, увеличился на 9% через 12 месяцев. Уровень ТГ также имел тенденцию к снижению в I и II группах: в I группе женщин в пременопаузе, принимавших Джес, этот показатель через 12 месяцев снизился в среднем с 1,1 ± 0,4 ммоль/л до 1,1 ± 0,5 ммоль/л, во II группе женщин в постменопаузе, принимавших Анжелик, уровень ТГ снизился в среднем с 1,3 ± 1,1ммоль/л до 1,4 ± 0,7ммоль/л. В Iа группе женщин в пременопаузе уровень ТГ увеличился с 1,2 ± 0,6ммоль/л до 1,3 ± 0,47 ммоль, в IIа группе женщин в постменопаузе не принимавших ЗГТ, уровень ТГ увеличился в среднем с 1,4 ± 0,2 ммоль/л до 1,5 ± 0,4 ммоль/л через 12 месяцев. Таким образом, в Ia и IIa группах сравнения пациенток отмечалось достоверное увеличение уровня атерогенных фракций и недостоверное снижение уровня ЛПВП-холестерина (рис. 5). В проведенном исследовании не было обнаружено достоверных изменений уровня глюкозы натощак, а также изменений постпрандиального уровня глюкозы при проведении перорального теста толерантности к глюкозе.
В задачи нашего исследования также входила оценка влияния приема орального контрацептива Джес и препарата для ЗГТ Анжелик на выраженность климактерического синдрома. Оценка тяжести климактерического синдрома проводилась при помощи модифицированного менопаузального индекса (ММИ) в баллах, симптомокомплексы которого оценивались по отдельности. При анализе данных было выявлено отсутствие достоверных различий между группами по нейровегетативным симптомам, обменно-эндокринные преобладали у пациенток I и IIа групп, а психоэмоциональные у пациенток II и IIа групп. Через 12 месяцев у пациенток в пременопаузе I группы, принимавших Джес, нейровегетативные нарушения у 93% (60) практически отсутствовали, при этом средний балл выраженности нейровегетативных симптомов снизился с 15,2 ± 0,7 до 1,2 ± 0,4 балла (р < 0,05). Психоэмоциональные нарушения в этой группе через 12 месяцев отсутствовали у 80% (51) женщин, средний балл уменьшился с 10,0 ± 0,7 баллов до 1,5 ± 0,2 баллов. Обменно-эндокринные нарушения у женщин в пременопаузе, принимавших Джес, через 12 месяцев уменьшились с 4,3 ± 0,2 до 1,1 ± 0,2 балла (р < 0,05). В Iа группе сравнения женщин в пременопаузе через 12 месяцев при анализе динамики нейровегетативных, психоэмоциональных и обменно-эндокринных нарушений положительной динамики не наблюдалось. Средний балл нейровегетативных нарушений остался приблизительно на прежнем уровне при исходном значении в среднем 16,4 ± 0,5 балла и через 12 месяцев равном 16,6 ± 0,5 балла. Через 12 месяцев наблюдения отмечено, что уровень выраженности обменно-эндокринных нарушений увеличился в среднем с 3,8 ± 0,5 до 4,2 ± 0,4 балла, средний балл психоэмоциональных нарушений увеличился с 11,6 ± 0,4 до 15,0 ± 0,3 балла (р < 0,05). Во II группе женщин в постменопаузе, принимавших Анжелик, через 12 месяцев наблюдалось уменьшение нейровегетативных, психоэмоциональных и обменно-эндокринных нарушений. Средний балл нейровегетативных нарушений через 12 месяцев снизился с 19,4 ± 0,4 до 3,3 ± 0,5 балла, обменно-эндокринных нарушений в среднем уменьшился с 4,3 ± 0,4 до 1,1 ± 0,2 балла, психоэмоциональных нарушений в среднем снизился с 13,0 ± 0,6 до 1,6 ± 0,3 балла (р < 0,05). В IIа группе женщин, не принимавших заместительную гормональную терапию, через 12 месяцев средний балл нейровегетативных нарушений повысился с 20,0 ± 0,5 балла до 25 ± 0,5 балла, средний балл обменно-эндокринных нарушений увеличился с 4,8 ± 0,5 балла до 6,0 ± 0,5 балла, средний балл психоэмоциональных нарушений через 12 месяцев увеличился с 12,4 ± 0,5 балла до 18,0 ± 0,5 (р < 0,05). Таким образом, через год наблюдения выраженность всех симптомов в группе женщин в постменопаузе без ЗГТ значительно увеличилась. При анализе общего среднего балла ММИ в I группе женщин, принимающих Джес, при исходном среднем значении 29,5 ± 1,7 балла через 12 месяцев отмечалось его снижение до 3,8 ± 0,3 (р < 0,05). В Iа группе наблюдения исходно общий средний балл ММИ исходно составил 31,8 ± 0,5 балла, через 12 месяцев наблюдения увеличился до 35,8 ± 0,8 балла (р < 0,05). Во II группе женщин в постменопаузе, принимавших Анжелик, исходно этот показатель составил 36,7 ± 0,2 балла, а через 12 месяцев снизился до 6,0 ± 0,3 (р < 0,05). В группе контроля IIа женщин в постменопаузе отмечалось увеличение общего среднего балла ММИ с 37,2 ± 0,2 балла до 11,8 ± 0,5 баллов (р < 0,05) (рис. 6).
Помимо ММИ для оценки вегетативных расстройств нами использовался вопросник, разработанный в отделе патологии вегетативной нервной системы под руководством А.М. Вейна. До начала исследования все женщины, по данным опросника, набрали более 15 баллов, что является показателем вегето-сосудистой дисфункции. Средний балл вегетативной дисфункции исходно в I группе, принимавших Джес, составил 17,5 ± 2,26, а через 12 месяцев снизился до 11,4 ± 0,34 (р < 0,05). В Iа группе женщин в пременопаузе через 12 месяцев наблюдения средний балл увеличился с 16,5 ± 3,5 до 16,9 ± 3,7 (р < 0,05). Во II группе пациентов, принимавших Анжелик, выявлено снижение показателя вегетативной дисфункции в среднем с 20,8 ± 4,2 до 12,7 ± 3,8 (р < 0,05). В группе сравнения IIа женщин, не получавших ЗГТ, средний балл через 12 месяцев увеличился с 19,4 ± 1,6 до 20,2 ± 4,2 (р < 0,05) (рис. 7).
Манифестация климактерического синдрома в виде приливов, повышенной потливости, раздражительности, эмоциональной лабильности, вызывает развитие психосоциального стресса, который характеризуется головными болями напряжения, пониженной концентрацией внимания, бессонницей, депрессивными симптомами [25]. В нашем исследовании мы оценивали эмоциональное состояние пациенток и степень выраженности депрессивных расстройств с помощью анкеты Бека. При оценке психологического статуса мы выявили, что в исследуемых группах у большинства пациенток наблюдаются депрессивные расстройства различной степени выраженности. Наличие депрессивных расстройств в период пре- и постменопаузы можно объяснить как прямым эффектом гипоэстрогении вследствие недостаточного эстрогенного влияния на структуры центральной нервной системы, так и выраженностью вазомоторных симптомов. Через 12 месяцев выраженность депрессивных расстройств уменьшилась в группах пациентов, принимавших Джес и Анжелик. Положительный эффект наблюдался уже через 3 месяца. Средний балл в I группе женщин, принимавших Джес, снизился с 19,14 ± 0,09, что соответствует умеренно-мягкой степени выраженности, до 13,3 ± 0,1 (р < 0,05) (мягкая степень выраженности расстройств). Во II группе пациентов в постменопаузе, принимавших Анжелик, средний балл через 12 месяцев снизился с 28,2 ± 0,03 до 14,9 ± 0,03 (р < 0,05) (умеренно-мягкая степень выраженности). В группах сравнения Iа, IIа степень выраженности депрессивных расстройств через 12 месяцев практически не изменилась (рис. 8).
Для выявления личностной и реактивной тревожности пациенток нами применялся тест Спилбергера. Мы установили наличие той или иной степени тревожности у всех пациенток в исследуемых группах. В I и Iа группах преобладала тревожность средней степени выраженности, во II и IIа группах – высокая степень. Через 12 месяцев средний балл реактивной тревожности в I группе женщин в пременопаузе, принимавших Джес, снизился с 40,6 ± 0,8 до 29,3 ± 0,2 балла. В группе сравнения Iа женщин в пременопаузе не отмечалось существенных изменений этого показателя: исходно средний балл составил 41,2 ± 1,0, через 12 месяцев – 40,2 ± 0,5. Во II группе пациенток в постменопаузе, принимавших Анжелик, средний балл снизился с 42,8 ± 0,4 до 30,0 ± 0,4. Во IIа группе сравнения женщин в постменопаузе показатель реактивной тревожности в среднем увеличился с 35,5 ± 0,1 до 36,0 ± 0,1 балла (рис. 9). В I группе, где исходно преобладали тревожные расстройства средней степени выраженности (64%), через 12 месяцев стали преобладать расстройства низкой степени (70%). Средняя степень тревожности в этой группе, принимавших Джес, снизилась на 39%. Высокая степень тревожности исходно составила 16% в этой группе пациенток, через 12 месяцев высокая степень тревожности наблюдалась лишь у 5%. В группе сравнения Iа женщин в пременопаузе степень выраженности тревожных расстройств увеличилась через 12 месяцев. При этом низкая степень тревожности уменьшилась на 8%, средняя – увеличилась на 6%, высокая – увеличилась на 2%. В постменопаузе в группе пациенток, получающих Анжелик, низкая степень увеличилась на 45%, средняя – увеличилась на 5%, высокая – снизилась на 50%. В группе сравнения IIа женщин в постменопаузе без ЗГТ через 12 месяцев наблюдения стали доминировать расстройства высокой степени (60%) (рис. 10). Таким образом, на фоне приема как Джес, так и Анжелик, нами было отмечено существенное положительное влияние на выраженность тревожных расстройств и депрессии.
На фоне назначения гормональной терапии не наблюдалось существенной динамики показателей креатинина, АСТ и АЛТ, калия, гемостазиограммы. Побочных эффектов, связанных с приемом препарата, не выявлено, абсолютное большинство пациентов отметили хорошую переносимость препарата и отсутствие нежелательных явлений при его назначении.
Обсуждение результатов
Результаты анализа нашей работы показали благоприятное влияние гормональной терапии комбинированными препаратами, содержащими низкие дозы эстрогена и дроспиренон, на уровень АД, висцеральное ожирение, метаболический статус и вегетативные и психоэмоциональные симптомы – как у женщин в пременопаузе, принимавших Джес, так и у женщин в ранние сроки постменопаузы с климактерическим синдромом, принимавших Анжелик. Уменьшение проявлений МС и АГ у женщин в пременопаузе и ранней постменопаузе в нашем исследовании, вероятно, обусловлено, в большей мере, воздействием прогестагена дроспиренона. В ходе работы было выявлено, что дроспиренон, как селективный блокатор альдостерона, в сочетании с натуральным эстрогеном, вероятно, обеспечивает достоверное снижение как систолического, так и диастолического АД у женщин в постменопаузе с АГ. Особенно важно снижение систолического АД, так как именно оно связано с более высоким сердечно-сосудистым риском по сравнению с диастолическим АД у женщин с АГ [17, 18]. Как известно, активация РААС под влиянием различных синтетических эстрогенов и прогестагенов способствует повышению содержания в организме натрия [19]. Повышенный уровень АД нормализуется, если эстрогены используются в комбинации с тиазидными диуретиками или спиронолактоном, что свидетельствует о том, что эти сдвиги АД могут быть связаны с задержкой натрия. При использовании дроспиренона в терапевтической дозе происходит немедленная активация натрийуреза. Помимо потери натрия, снижение уровня АД свидетельствует о непосредственном влиянии дроспиренона на РААС сосудов, заключающемся в повышении растяжимости артериальной стенки. Эти свойства особенно важны у женщин в пре- и постменопаузе с АГ, развитие которой у них, как известно, в определенной степени связано с повышением жесткости стенок артерий [20]. В рандомизированных плацебоконтролируемых исследованиях было показано, что дроспиренон, являясь антагонистом альдостерона, оказывает значимое влияние на уровень АД у женщин в постменопаузе, страдающих АГ. Исходно у женщин с нормальным уровнем АД не обнаружено значимых изменений показателей АД [19, 26].
В некоторых исследованиях с участием женщин в постменопаузе было показано, что применение ЗГТ связано с благоприятным воздействием на липидный профиль [21]. В нашем исследовании также через 12 месяцев на фоне заместительной гормональной терапии, содержащей дроспиренон, отмечалась тенденция к снижению атерогенных фракций липидов и повышению ХС ЛПВП, улучшение метаболического статуса. Результаты других исследований, в которых проводилось сравнение эффективности монотерапии эстрадиолом и комбинированным препаратом Анжелик у женщин в постменопаузе с МС и АГ, показали, что только терапия препаратом Анжелик приводила к снижению массы тела, в то время как монотерапия эстрадиолом, напротив, вызывала повышение веса тела. Кроме того, была отмечена более существенная положительная динамика уровня АД и показателей липидного обмена на фоне терапии препаратом Анжелик в сравнении с монотерапией эстрадиолом. В то же время применение оральных контрацептивов оказывает как благоприятное, так и отрицательное влияние на липидный профиль и, следовательно, на риск возникновения атеросклероза. По данным K. Fotherby, при применении орального контрацептива, содержащего 30 мкг этинилэстрадиола и 150 мкг левоноргестрела, было выявлено снижение ХС ЛПНП в 12 и отсутствие изменений этого показателя в 13 исследованиях [22]. В другом исследовании с трехфазным оральным контрацептивом, содержащем этинилэстрадиол и левоноргестрел, не было выявлено изменений в показателях ХС ЛПНП и ХС ЛПВП. При изучении влияния этинилэстрадиола в комбинации с 150 мкг дезогестрела в 15 исследованиях было показано повышение сывороточного ХС ЛПВП, в 4 не было выявлено изменений, а в 9 исследованиях не было выявлено изменений в показателях ХС ЛПНП, в 2 наблюдалось его снижение. Кроме того, дальнейшее изучение показало, что изменения в липидном спектре не увеличиваются во время приема оральных контрацептивов и возвращаются к своему исходному уровню после отмены препарата [23]. В нашем исследовании отмечалась тенденция к повышению ХС ЛПВП в группе женщин, принимавших оральный контрацептив Джес, что обусловлено положительным действием эстрогена и отсутствием антиандрогенной активности дроспиренона. Похожие результаты по влиянию на липидный спектр были получены в исследовании S. Taneepanichskul и соавт. при изучении комбинации 30 мкг этинилэстрадиола и 3 мг дроспиренона [24], где выявили достоверное увеличение ХС ЛПВП на 25,7%, а также достоверное снижение ХС ЛПНП на 9,9% в сравнении с исходным уровнем через 6 месяцев.
Таким образом, наша работа показала положительное влияние приема орального контрацептива Джес и препарата для ЗГТ Анжелик на уровень АД, метаболический статус, выраженность климактерического синдрома, липидный профиль у наблюдаемых женщин в пременопаузе и ранней постменопаузе. Наше исследование продемонстрировало благоприятное влияние гормональной терапии, содержащей низкий уровень эстрогена и прогестаген дроспиренон, на снижение выраженности основных факторов риска ишемической болезни сердца.
1. Kannel W.B., Wilson P.W. Risk factors that attenuate the female coronary disease advantage // Arch. Intern. Med. 1995. Vol. 155. № 1. P. 57–61.
2. Rosano G.M., Vitale C., Tulli A. Managing cardiovascular risk in menopausal women // Climacteric. 2006. Vol. 9. Suppl. 1. P. 19–27.
3. Boggia J., Thijs L., Hansen T.W., Li Y., Kikuya M., Björklund-Bodegård K., Richart T., Ohkubo T., Jeppesen J., Torp-Pedersen C., Dolan E., Kuznetsova T., Olszanecka A., Tikhonoff V., Malyutina S., Casiglia E., Nikitin Y., Lind L., Maestre G., Sandoya E., Kawecka-Jaszcz K., Imai Y., Wang J., Ibsen H., O'Brien E., Staessen J.A.; International Database on Ambulatory blood pressure in relation to Cardiovascular Outcomes Investigators. Ambulatory blood pressure monitoring in 9357 subjects from 11 populations highlights missed opportunities for cardiovascular prevention in women // Hypertension. 2011. Vol. 57. № 3. P. 397–405.
4. VasomGast G.C., Pop V.J., Samsioe G.N., Grobbee D.E., Nilsson P.M., Keyzer J.J., Wijnands-van Gent C.J., van der Schouw Y.T. Vasomotor menopausal symptoms are associated with increased risk of coronary heart disease // Menopause. 2011. Vol. 18. № 2. P. 146–151.
5. Thurston R.C., Sutton-Tyrrell K., Everson-Rose S.A., Hess R., Matthews K.A. Hot flashes and subclinical cardiovascular disease: findings from the Study of Women's Health Across the Nation Heart Study // Circulation. 2008. Vol. 118. № 12. P. 1234–1240.
6. Gambacciani М., Pepe А. Vasomotor symptoms and cardiovascular risk // Climacteric. 2009. Vol. 12. Suppl. 1. P. 32–35.
7. Mendelsohn M.E., Karas R.H. Molecular and cellular basis of cardiovascular gender differences // Science. 2005. Vol. 308. № 5728. P. 1583–1577.
8. Losordo D.W., Kearney M., Kim E.A., Jekanowski J., Isner J.M. Variable expression of the estrogen receptor in normal and atherosclerotic coronary arteries of premenopausal women // Circulation. 1994. Vol. 89. № 4. P. 1501–1510.
9. Karas R., Clarkson T.B. Considerations in interpreting the cardiovascular effects of hormone replacement therapy observed in the WHI timing is everything // Menopausal Medicine. 2003. Vol. 10. P. 8–12.
10. Kannel W.B., Hjortland M.C., McNamara P.M., Gordon T. Menopause and risk of cardiovascular disease the Framingham study // Ann. Intern. Med. 1976. Vol. 85. № 4. P. 447–452.
11. Borgelt-Hansen L. Oral contraceptives: an update on health benefits and risks // J. Am. Pharm. Assoc. 2001. Vol. 41. № 6. P. 875–886.
12. Burkman R.T., Shulman L.P. Oral contraceptive practice guidelines // Contraception. 1998. Vol. 58. № 3. Suppl. P. 35S–43S.
13. Association of Reproductive Health Professionals. Clinical Proceedings®: understanding low-dose oral contraceptives, 2001 //www.arhp.org/clinical/CP_low_dose/index.html.
14. Krattenmacher R. Drospirenone: pharmacology and pharmacokinetics of a unique progestogen // Contraception. 2000. Vol. 62. № 1. P. 29-38.
15. Foidart J.M. The contraceptive profile of a new oral contraceptive with antimineralocorticoid and antiandrogenic effects // Eur. J. Contracept. Reprod. Health Care. 2000. Vol. 5. Suppl. 3. P. 25–33.
16. Mansour D. Yasmin – new oral contraceptive, a new progestogen: the reasons why // Eur. J. Сontracept. Reprod. Health Care. 2000. Vol. 5. Suppl. 3. P. 9–16.
17. Vasan R.S., Larson M.G., Leip E.P., Evans J.C., O'Donnell C.J., Kannel W.B., Levy D. Impact of high normal blood pressure on the risk of cardiovascular disease // N. Engl. J. Med. 2001. Vol. 345. № 18. P. 1291–1297.
18. White W.B., Hanes V., Chauhan V., Pitt B. Effects of a new hormone therapy, drospirenone and 17-beta-estradiol, in postmenopausal women with hypertension // Hypertension. 2006. Vol. 48. № 2. P. 246–253.
19. Elger W., Beier S., Pollow K., Garfield R., Shi S.Q., Hillisch A. Conception and pharmacodynamic profile of drospirenone // Steroids. 2003. Vol. 68. № 10–13. P. 891–905.
20. Berry K.L., Cameron J.D., Dart A.M., Dewar E.M., Gatzka C.D., Jennings G.L., Liang Y.L., Reid C.M., Kingwell B.A. Large-artery stiffness contributes to the greater prevalence of systolic hypertension in elderly women // J. Am. Geriatr. Soc. 2004. Vol. 52. № 3. P. 368–373.21.
21. Saranyaratana W., Sakondhavat C., Silaruks S., Soontrapa S., Kaewrudee S. Effect of hormone therapy on lipid profile in menopausal women // J. Med. Assoc. Thai. 2006. Vol. 89. Suppl. 4. P. S37–S41.
22. Fotherby K. Clinical pharmacology of gestagens // Femalecontraception / Ed. by B. Runnebauum, T. Rabe, L. Kiesel. Berlin: Springer-Verlag, 1988. P. 122–128.
23. Taneepanichskul S., Phupong V. Influence of a new oral contraceptive with drospirenone on lipid metabolism // Gynecol. Endocrinol. 2007. Vol. 23. № 6. P. 347–350.
24. Diabetes and heart disease / Ed. by R.J. Jarrett. Amsterdam: Elsevier Science, 1984. P. 1–23.
25. Kuznetsova I.V., Mychka V.B., Akarazkova E.S. et al. The influence of the hormonal replacement therapy on cardiovascular and vegetative nervous system in women in peri- and postmenopause // Giornale Italiano di Ostetricia e Ginecologia. 2009. Supplemento AL. Vol. XXXI. № 6/7.
26. Kuznetsova I.V., Mychka V.B., Voichenko N.A. et al. Cardiovascular diseases prevention in postmenopausal women. Menopause Selected papers of the 13th World Congress on Menopause Rome, June 8–11, 2011. P. 352–354.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Сердечно-сосудистые заболевания (ССЗ) занимают первое место в структуре смертности среди женщин, поэтому меры, направленные на эффективную первичную и вторичную профилактику, имеют большое социальное значение.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
