Применение индол-3-карбинола и эпигаллокатехин-3-галлата при простатической интраэпителиальной неоплазии для профилактики рака предстательной железы
- Аннотация
- Статья
- Ссылки


Заболеваемость РПЖ стабильно растет и в США, и в Европе. РПЖ стал второй основной причиной всех связанных с раком случаев смертности мужчин в западных странах, что представляет большую и прогрессирующую медицинскую и социальную проблему. Неблагоприятный прогноз развития локализованных и распространенных опухолей повышает интерес к программам ранней идентификации потенциально излечимых стадий злокачественного процесса. Скрининг РПЖ остается предметом дискуссии. При этом в большинстве исследований не удалось показать, что скрининг РПЖ снижает смертность мужчин от этого заболевания. Лишь в последние годы стали появляться работы, указывающие на возможность снижения смертности от РПЖ до 20% в результате скрининга (29).
Известно, что в большинстве эпителиальных тканей, включая предстательную железу, со временем наблюдается ряд генетических нарушений, приводящих к потере контроля за функциями клетки, изменению клеточного и тканевого фенотипа от нормальной тканевой структуры до начальной дисплазии (LPIN), затем все более усугубляясь до тяжелой дисплазии (HPIN), поверхностного и, наконец, инвазивного рака. Простатическая интраэпителиальная неоплазия, или PIN, – доказанный гистологический предшественник РПЖ. PIN сопутствует ДГПЖ в 43% случаев. У больных с PIN при повторной биопсии через 6 месяцев инвазивный РПЖ выявляется в 35%. При наличии дисплазии высокой степени риск обнаружения РПЖ в течение ближайших 3-5 лет достигает 30-50%, а риск выявления инвазивного РПЖ в течение 10 лет – 80%.
Описанные тканевые трансформации в предстательной железе протекают в течение длительного времени: для развития PIN требуется не менее 20 лет. Необходимый срок от возникновения LPIN до HPIN и раннего латентного рака составляет 10 и более лет, а клинически значимая карцинома после этого иногда может не определяться еще от 3 до 15 лет. Указанные особенности течения патологического процесса в предстательной железе представляют хорошую возможность для попыток коррекции предраковых состояний.
Химиопрофилактика – это использование средств, замедляющих прогрессирование, вызывающих реверсию или ингибицию процессов канцерогенеза с целью снижения риска развития инвазивного или клинически значимого рака. Для этой цели в качестве перспективных расматриваются вещества природного происхождения: содержащийся в овощах семейства крестоцветных индол-3-карбинол (I3C) и наиболее активный из катехинов зеленого чая – эпигаллокатехин-3-галлат (EGCG), которые являются двумя действующими компонентами препарата Индигал.
К настоящему времени в мире накоплен интересный экспериментальный и практический материал, свидетельствующий о потенциальной значимости противоопухолевой активности I3C и EGCG в отношении опухолей эпителиального происхождения (2, 4, 6, 10, 16, 27). Экспериментально и клинически обоснована их способность осуществлять множественное блокирование молекулярных механизмов, стимулирующих патологическую клеточную пролиферацию и последующий канцерогенез.
При комбинированном использовании I3C и EGCG эффективно блокируют основные (в том числе гормон-независимые) сигнальные пути, приводящие к патологической клеточной пролиферации, стимулируют апоптоз трансформированных клеток, подавляют патологический ангиогенез. К настоящему моменту идентифицировано большое число молекулярных мишеней, опосредующих неопластические процессы в эпителиальных тканях и ингибируемых I3C и EGCG .
Экспериментальными исследованиями показано, что I3C и его основное метаболическое производное – 3,3’-дииндолилметан – проявляют высокую противоопухолевую эффективность в отношении РПЖ (18, 21, 22). Установлено, что в условиях in vitro I3C дозо- и времязависимым образом ингибирует рост андроген-зависимых и андроген-независимых клеточных культур предстательной железы. При этом подавляется экспрессия стимуляторов клеточного цикла – циклинов и циклин-зависимых киназ и, напротив, повышается уровень белков-ингибиторов клеточного деления – р21, р27 (4, 28). Важнейшим биологическим свойством I3C является способность блокировать проведение в клетках предстательной железы андроген-зависимых пролиферативных сигналов на самых первых этапах их реализации посредством ингибирования экспрессии андрогеновых рецепторов (9). Как и в других клеточных системах, I3C индуцирует апоптоз простатических клеток (18, 19, 22), опосредованный системой белков Bax/Bcl, а также блокирует сигнальные каскады, активируемые факторами роста и осуществляемые посредством ядерного фактора транскрипции NF-kB (4) и протеинкиназы Akt (5). Данные сигнальные пути регулируют баланс между клеточной выживаемостью и гибелью и рассматриваются как дополнительная возможность реализации апоптоза в простатических клетках (25).
Второй компонент препарата Индигал – эпигаллокатехин-3-галлат – не уступает индол-3-карбинолу в антипролиферативных и проапоптотических свойствах. Достоверно установлено, что EGCG, так же как и I3C, блокирует внутриклеточные сигнальные пути, индуцируемые полипептидными ростовыми факторами (20, 24). Способность EGCG блокировать цитокин-зависимые пути стимуляции опухолевого роста, а следовательно, подавлять таким образом и патологические воспалительные реакции, доказана еще более убедительно, чем для I3C. На эпителиальных опухолевых клетках различного происхождения установлено, что EGCG в физиологических концентрациях эффективно ингибирует экспрессию ключевого фермента цикла арахидоновой кислоты – циклооксигеназы 2 (COX-2), стимулируемого под действием митогенных форболовых эфиров (8, 14). Кроме того, есть данные, что EGCG ингибирует TNF-индуцируемую активацию ядерного фактора транскрипции NF-kB, который является конечным эффектором сигнальных путей, индуцируемых не только ростовыми факторами, но и провоспалительными цитокинами.
Что касается проапоптотических свойств EGCG, то для него так же, как и для I3C, показана способность к коммитированию опухолевых клеток к апоптозу.
Селективная проапоптотическая активность EGCG (20-100 мкМ) была показана на клеточных моделях гормон-чувствительных и гормон-резистентных клеток РПЖ (7, 12). При этом инициировался тот же каскад событий, что и в случае с индол-3-карбинолом.
Следует отметить, что в большинстве работ, касающихся этой проблемы, проапоптотические свойства EGCG в отношении опухолевых клеток тесно увязывались с его прооксидантной активностью, а именно со способностью EGCG образовывать реактивные кислородные радикалы (анион-супероксид О2- и перекись водорода Н2О2), вызывающие последующую гибель опухолевых клеток посредством активации процесса перекисного окисления липидов, входящих в состав клеточных мембран (1, 23).
Еще одной важной составляющей противоопухолевой активности препарата Индигал является способность входящих в его состав компонентов подавлять патологический рост кровеносных сосудов, часто сопровождающий гиперпластические клеточные процессы. В ряде экспериментальных исследований было показано, что эпигаллокатехин-3-галлат является эффективным ингибитором фактора роста эндотелия сосудов VEGF – ключевого индуктора ангиогенных процессов (11, 26) – и его рецептора VEGFR (15, 17). Кроме того, EGCG препятствует собственно самому процессу взаимодействия фактора VEGF с рецептором VEGFR (13).
Из всего вышесказанного можно заключить, что активные действующие компоненты препарата Индигал – I3C и EGCG – эффективно блокируют основные сигнальные механизмы патологической клеточной пролиферации, индуцируют апоптоз трансформированных клеток, а также подавляют воспалительные реакции и патологический рост кровеносных сосудов, т.е. осуществляют множественное блокирование основных звеньев патогенеза гиперпластических процессов в тканях предстательной железы.
В настоящее время I3C и EGCG разрешены к применению в России в качестве биологически активных добавок (БАД). Однако, несмотря на доказанную в преклинических исследованиях эффективность данных соединений в отношении неопластических образований предстательной железы, клинических исследований в этом направлении до настоящего времени проведено не было. Есть все основания рассчитывать на успешное применение комбинированного препарата Индигал с целью фармакологической коррекции ДГПЖ и профилактики РПЖ.
Материалы и методы
В 2008 г. в НИИ Урологии начата работа по изучению клинической эффективности, морфологических эффектов и безопасности Индигала в сравнении с плацебо у больных ДГПЖ и PIN. Оценивали влияние приема препарата на динамику симптомов нарушения функции нижних мочевых путей, качество жизни больных, основные уродинамические показатели (максимальную скорость потока мочи и объем остаточной мочи), уровень ПСА, объем предстательной железы и характер морфологических эффектов Индигала в сравнении с плацебо. Также оценивали безопасность Индигала на основании анализа частоты нежелательных явлений, побочных эффектов и динамики основных параметров сыворотки крови.
Для оценки клинической эффективности, морфологических эффектов и безопасности Индигала в исследование было включено 34 пациента с ДГПЖ и PIN, которые были рандомизированы на две группы: группа I (18 пациентов) принимала Индигал по 2 капсулы 2 раза в день, группа II (16 пациентов) – плацебо также по 2 капсулы 2 раза в день. Средний возраст пациентов I группы составил 64,11 ± 4,96 года, II группы – 62,13 ± 5,20 года.
Критериями включения в исследование были:
- возраст пациентов – старше 50 лет;
- наличие симптоматической, клинически и морфологически доказанной ДГПЖ;
- морфологически доказанное наличие HPIN или LPIN;
- выраженность симптомов по шкале I-PSS – более 7 баллов;
- максимальная скорость потока мочи (Qmax) – более 5 и менее 15 мл/с;
- объем остаточной мочи – не более 200 мл;
- объем простаты – более 25 см3;
- уровень ПСА – до 10 нг/мл.
Все пациенты дали письменное согласие на участие в исследовании и соблюдали указания врача относительно назначенной терапии. При этом были исключены пациенты, ранее подвергавшиеся хирургическим вмешательствам на органах малого таза, термотерапии, лучевой терапии органов таза, имеющие склероз шейки мочевого пузыря, увеличение средней доли простаты, стриктуру уретры, осложненное течение ДГПЖ (в том числе камни и дивертикулы мочевого пузыря, рецидивирующая мочевая инфекция, ХПН, нарушение функции верхних мочевых путей), онкологические заболевания (в том числе рак простаты), значимые кардио- или цереброваскулярные нарушения, психические заболевания и поражения ЦНС, диабетическую нейропатию, нейрогенные расстройства мочеиспускания, почечную и печеночную недостаточность, а также другие угрожающие жизни состояния. Также были исключены пациенты, принимающие препараты, влияющие на качество мочеиспускания, к моменту исследования или менее чем за 2 месяца до него (ингибиторы 5-a-редуктазы, a1-адреноблокаторы, растительные экстракты, холинолитики, антидепрессанты, диуретики).
Первичное обследование (V1) включало: сбор анамнеза, клинический осмотр, пальцевое ректальное исследование предстательной железы, стандартизированную оценку симптомов по шкалам I-PSS и качества жизни (QOL), анализ крови на ПСА, общий анализ крови, общий анализ мочи, биохимический анализ крови (креатинин, билирубин, холестерин, ACT, ГГТ, глюкоза), урофлоуметрию с определением остаточной мочи ультразвуковым методом, трансректальную ультрасонографию с определением объема предстательной железы.
Каждому пациенту производилась мультифокальная биопсия предстательной железы минимум из 6 точек. Биопсия выполнялась не ранее чем за 3 месяца до начала приема препарата. Были применены следующие методы морфологического исследования биоптатов: светооптический, морфометрический, иммуногистохимический, цитоспектрофотометрический.
Если пациент удовлетворял всем критериям включения и не попадал ни под один из критериев исключения, то его включали в исследование, проводили этап рандомизации и выдавали исследуемый препарат на 3 месяца. Больные информировались о необходимости правильного и регулярного приема препарата.
Через 3 месяца после начала приема препарата назначался второй визит (V2). Обследование в целом соответствовало таковому при V1, за исключением анализа на ПСА, анализа мочи и биопсии предстательной железы, которые не проводились. Оценивали нежелательные явления и побочные реакции. Пациенту выдавался препарат на последующие 3 месяца.
Визит 3 (V3) назначался через 6 месяцев после начала приема исследуемого препарата. Обследование соответствовало таковому при V1. Также оценивали нежелательные явления и побочные реакции.
Результаты и обсуждение
Целью проведенного исследования была попытка доказать на клиническом материале профилактическое действие Индигала на развитие РПЖ у пациентов с ДГПЖ и PIN. При оценке результатов морфологических изменений важно отметить, что распределение больных в основной и контрольной группах было случайным и происходило методом рандомизации. Исследование было двойным слепым и плацебо-контролируемым: ни исследователь, ни специалист-морфолог, ни пациент не знали – принимается Индигал или плацебо.
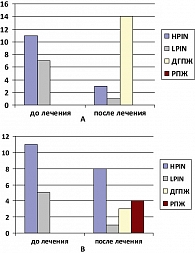
Изначально в I группу (Индигал) было включено 7 пациентов с простатической интраэпитальной неоплазией низкой степени (LPIN) и 11 пациентов с простатической интраэпитальной неоплазией высокой степени (HPIN). II группа (плацебо) включала 5 пациентов с LPIN и также 11 пациентов с HPIN. Межгрупповые отличия в исходных долях больных с LPIN и HPIN были статистически незначимы (р > 0,05, критерий Фишера). После 6 месяцев лечения повторная биопсия простаты выявила следующие изменения:
- в группе больных, которые принимали Индигал, из 7 пациентов с LPIN у 1 больного выявлена повторно LPIN, у 2 пациентов – HPIN, у 4 пациентов – только ДГПЖ;
- в группе, получавшей Индигал, из 11 пациентов с HPIN у 1 больного повторно выявлена HPIN, а у 10 – только ДГПЖ;
- в группе плацебо из 5 пациентов с LPIN в 1 случае повторно диагностирована LPIN, в 1 – HPIN, еще в 1 – только ДГПЖ, а у 2 больных выявлен РПЖ;
- в группе плацебо из 11 пациентов с HPIN у 7 больных повторно выявлена HPIN, у 2 – ДГПЖ, а еще у 2 – РПЖ.
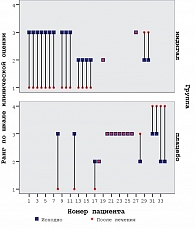
Анализ полученных результатов свидетельствует, что на первом визите в обеих группах были зафиксированы две морфологические характеристики: LPIN и HPIN. В результате лечения (Индигал или плацебо) морфологическая картина ухудшилась, улучшилась или осталась неизменной. Для более детального анализа каждому из четырех возможных морфологических диагнозов по результатам биопсии простаты был присвоен свой ранг: 1 – ДГПЖ, 2 – LPIN, 3 – HPIN, 4 – РПЖ. Всего возможно было 7 вариантов клинического ответа в интервале времени между первым и третьим визитами (см. таблицу 1).
Таким образом, используя данную порядковую шкалу, можно провести оценку и наглядно представить динамику морфологических изменений между первым и третьим визитами (рисунок 1).
По результатам воздействия назначенной терапии группы, получавшие Индигал и плацебо, значимо различались (р = 0,002, критерий Манн-Уитни).
Отдельно изучалось различие частоты малигнизации в исследуемых группах. Характерно, что в основной группе случаев малигнизации не отмечено. В контрольной группе (плацебо) зарегистрировано 4 случая развития РПЖ (25,0%). Различия по частоте малигнизации между исследуемыми группами оказались статистически значимыми (р = 0,039, критерий Фишера).
Как видно из рисунка 1 и таблицы 2, существенное улучшение морфологической структуры ткани предстательной железы в основной группе наблюдалось у 10 из 11 пациентов с HPIN (90,9%), а улучшение – у 57,1% пациентов с LPIN. В группе плацебо отмечалась обратная картина. Полученные данные достоверно указывают на возможность достижения регрессии простатической интраэпителиальной неоплазии (дисплазии) у пациентов с ДГПЖ в результате применения Индигала.
В целом изменение распределения пациентов в группах, в зависимости от морфологической структуры ткани предстательной железы, наглядно демонстрирует рисунок 2.
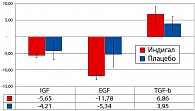
С целью уточнения механизмов влияния Индигала на процесс пролиферации нами проведены иммуногистохимические исследования биопсийных образцов, полученных до и после лечения (у четырех пациентов из каждой группы). Оценивались следующие показатели: фактор IGF (инсулиноподобный фактор роста); фактор EGF (эпидермальный фактор роста); регулирующий фактор TGF-b (трансформирующий фактор роста бета).
Уровень экспрессии изучаемого фактора определялся в процентах, вычислялись его изменения между визитами 1 и 3 (рисунок 3).
При статистически однородных исходных значениях уровня экспрессии IGF, EGF и TGF-b выявлено статистически значимое снижение факторов роста IGF (p = 0,004, критерий Фишера) и EGF (p = 0,002, критерий Фишера), а также повышение уровня TGF-b (p = 0,047, критерий Фишера) в группе пациентов, принимавших Индигал. В контрольной группе статистически значимых изменений экспрессии факторов роста не выявлено.
Таким образом, применение Индигала способствует снижению экспрессии факторов IGF и EGF, стимулирующих пролиферативные процессы в ткани предстательной железы. В то же время происходит увеличение экспрессии TGF-b (трансформирующего ростового фактора бета), усиливающего апоптоз. Полученные данные достоверного снижения экспрессии факторов роста IGF и EGF и повышения уровня TGF-b на фоне приема Индигала говорят о влиянии действующих веществ препарата на основные сигнальные механизмы патологической клеточной пролиферации, а также на индукцию апоптоза трансформированных клеток. Данные изменения, по-видимому, являются одним из механизмов антипролиферативного воздействия Индигала у больных с простатической интраэпителиальной неоплазией.
При анализе основных общеклинических параметров (I-PSS, QOL, Qmax, объемы простаты и остаточной мочи, ПСА) отмечалась некоторая положительная динамика, однако достоверных различий, как при сравнении показателей в группах до и после лечения, так и между группами, выявлено не было.
Принципиально важно отметить, что в ходе лечения побочных эффектов и нежелательных явлений у пациентов как I, так и II групп зарегистрировано не было.
Выводы
- Достоверно продемонстрирована антипролиферативная активность Индигала у больных ДГПЖ и сопутствующей простатической интраэпителиальной неоплазией, что подтверждено снижением экспресии IGF и EGF и повышением экспрессии TGF-b в ткани предстательной железы по сравнению с плацебо.
- На фоне применения Индигала отмечено снижение частоты развития РПЖ по сравнению с контрольной группой.
- Полученные данные достоверно указывают на возможность достижения регрессии простатической интраэпителиальной неоплазии (дисплазии) на фоне применения Индигала.
- Индигал является безопасным средством у пациентов с ДГПЖ и сопутствующей простатической дисплазией ввиду отсутствия побочных эффектов и нежелательных явлений в ходе лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.