количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Применение кларитромицина в педиатрии: вопросы фармакодинамики, фармакокинетики и безопасности
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №1
- Аннотация
- Статья
- Ссылки
Кларитромицин – полусинтетический антибиотик, относящийся к 14-членным макролидам, – успешно используется в клинической практике уже более 20 лет. Активность в отношении многих возбудителей и наличие дополнительных неантибактериальных свойств позволяют широко использовать препарат у детей при различных заболеваниях.
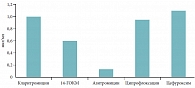
Рис. 1. Концентрации антибиотиков через 6 часов после перорального приема в сыворотке крови
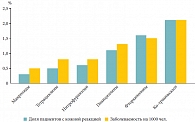
Рис. 2. Кожная реакция при использовании антибактериальных препаратов
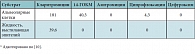
Таблица 1. Концентрации антибиотиков через 6 часов после перорального приема в альвеолярных клетках и жидкости, выстилающей эпителий
Особенностью кларитромицина является образование в организме активного метаболита – 14-гидроксикларитромицина (14-ГОКМ), который также обладает антибактериальной активностью. В отношении чувствительных возбудителей у кларитромицина и его активного метаболита наблюдается аддитивный или синергический эффект. В связи с этим эффект антибиотика in vivo может быть выше, чем in vitro [1, 2]. Кларитромицин, как и другие макролиды, обладает высокой активностью в отношении клинически значимых грамположительных бактерий – стафилококков (метициллинчувствительных), стрептококков (включая пенициллинчувствительные Streptococcus pneumoniae и ванкомицинчувствительные энтерококки), Listeria monocytogenes, Corynebacterium diphtheriae. К кларитромицину чувствительны некоторые грамотрицательные бактерии – Moraxella catarrhalis, Bordetella pertussis, нейссерии, Campylobacter jejuni, Helicobacter pylori (активность против последнего микроорганизма выше, чем у других макролидов). Кларитромицин является одним из двух макролидов (наряду с азитромицином) со значимой эффективностью в отношении Haemophilus influenzae.
При этом активность самого кларитромицина против гемофильной палочки in vitro невелика, однако она усиливается in vivo за счет действия 14-ГОКМ. Как и другие макролиды, кларитромицин высокоактивен в отношении атипичных бактерий – микоплазм, уреаплазм, хламидий, легионелл, риккетсий. Важной особенностью кларитромицина является высокая активность в отношении атипичных микобактерий (Mycobacterium avium complex). Также препарат активен в отношении некоторых анаэробных бактерий, токсоплазм [1, 2]. Кларитромицин обладает преимущественно бактериостатическим эффектом, однако в высоких дозах на ряд бактериальных возбудителей респираторных инфекций – S. pyogenes, S. pneumoniae, H. influenzae, M. catarrhalis, L. pneumophila и M. avium – препарат может оказывать бактерицидное действие. Помимо основного эффекта, обусловленного нарушением синтеза белка на рибосомах бактерий, у кларитромицина ярко выражены дополнительные антимикробные свойства – постантибиотический эффект и воздействие на биопленки. Кларитромицин и 14-ГОКМ обладают постантибиотическим эффектом в отношении некоторых бактерий, в том числе S. pneumoniae, H. influenzae и M. catarrhalis [1, 2]. В последние годы большое клиническое значение придается влиянию некоторых макролидов на факторы вирулентности Pseudomonas aeruginosa. Установлено, что кларитромицин способен подавлять у данного возбудителя двигательную активность и способность к формированию биопленок [3].
Неантибактериальные эффекты
В экспериментальных исследованиях показаны неантибактериальные свойства кларитромицина – иммуномодулирующее, противовоспалительное и мукорегуляторное, – которые имеют важное значение для лечения респираторных заболеваний не только бактериальной, но и вирусной этиологии, а также заболеваний неинфекционной природы. Установлены механизмы действия, приводящие к указанным эффектам:
- усиление фагоцитоза апоптотических нейтрофилов альвеолярными макрофагами ведет к предотвращению выделения нейтрофильных протеаз и их воздействия на дыхательные пути [4];
- ингибирование активации ядерного фактора транскрипции (NF-κB) в мононуклеарных клетках крови и клетках легочного эпителия сопровождается подавлением выработки провоспалительных цитокинов – ФНО-α, ИЛ-6, ИЛ-8 и др. [5];
- подавление экспрессии генов, кодирующих индуцибельную синтазу оксида азота (INOS), ведет к снижению образования NO в эпителии дыхательных путей и альвеолярных макрофагах [6];
- снижение уровня ИЛ-4 с повышением соотношения Т-хелперов 1 и 2 типа (Th1/Th2) [7];
- снижение влияние липополисахарида (бактериального эндотоксина) на бокаловидные клетки эпителия дыхательных путей ведет к уменьшению гиперсекреции слизи [8];
- торможение гиперплазии бокаловидных клеток в дыхательных путях, индуцируемой ИЛ-13, также ведет к уменьшению гиперсекреции слизи [9].
Фармакокинетика
Биодоступность кларитромицина после приема внутрь составляет 52–55%, при этом пища не снижает этот показатель. Максимальная концентрация препарата в крови после приема внутрь наблюдается в среднем через 2–3 часа. Кларитромицин активно метаболизируется в печени при участии цитохрома P450 с образованием различных метаболитов, основным из которых является 14-ГОКМ. Связывание препарата с белками плазмы находится в обратной зависимости от концентрации в крови и составляет от 42 до 70%. Кларитромицин и 14-ГОКМ создают высокие концентрации в органах, тканях и биологических жидкостях, в том числе в назальном секрете, миндалинах, жидкости среднего уха, легочной ткани, мокроте. Большие концентрации препарата, а также его активного метаболита наблюдаются в фагоцитах [1, 2].
Большой интерес представляет исследование внутрилегочной фармакокинетики кларитромицина в сравнении с азитромицином, ципрофлоксацином и цефуроксимом у 68 добровольцев. Через 6 часов после однократного приема стандартной дозы препаратов (500 мг для каждого) у кларитромицина и 14-ГОКМ отмечались очень высокие концентрации в альвеолярных клетках (азитромицин был обнаружен в них только через 12 часов). При этом высокие концентрации кларитромицина и 14-ГОКМ сохранялись и в сыворотке крови (в сумме они превышали концентрации всех остальных антибиотиков). Кроме того, кларитромицин был единственным антибиотиком, обнаруженным в жидкости, выстилающей легочный эпителий (рис. 1, табл. 1) [10]. Период полувыведения кларитромицина составляет от 3 до 8 часов, что зависит от дозы. От 20 до 40% препарата выводится с мочой в неизмененном виде, около 40% – со стулом, 10–15% – в виде метаболитов [1, 2].
Безопасность
Вопросы безопасности лекарственных препаратов имеют особое значение в педиатрической практике, поскольку у детей возможно развитие специфических нежелательных реакций, несвойственных для пациентов во взрослом возрасте. Макролиды относятся к числу наиболее безопасных антибактериальных препаратов. Они крайне редко вызывают тяжелые нежелательные реакции. Безопасность кларитромицина, в том числе в педиатрической практике, хорошо изучена в многочисленных клинических исследованиях. У детей чаще всего отмечаются нежелательные реакции со стороны желудочно-кишечного тракта (диарея, тошнота и рвота, боли в животе) – их частота около 15%, а также головные боли – их частота около 1,6%. При использовании кларитромицина также может отмечаться повышение уровня трансаминаз. Остальные реакции встречались в единичных случаях. Нежелательные реакции при использовании препарата обычно носят легкий непродолжительный характер и редко требуют отмены препарата [1, 2].
В ретроспективном когортном исследовании большой популяции (около 150 тыс. человек), проводившемся в течение полутора лет, был оценен риск кожной реакции на различные антибактериальные препараты. За указанный период более 13 тыс. человек (в том числе более 2000 детей) получили почти 20 тыс. курсов антибактериальной терапии. В целом кожная реакция отмечалась у 135 пациентов, что составило примерно 1%. Однако частота кожных реакций на отдельные группы препаратов имела отличия – реже всего она отмечалась при использовании макролидов, она была существенно меньше (в 3 и более раза), чем на пенициллины, фторхинолоны и ко-тримоксазол (рис. 2). В другом ретроспективном исследовании были проанализированы 300 пациентов с аллергическими реакциями на антибиотики. Показано, что в реальной клинической практике пациенты с аллергией на макролиды встречаются существенно реже, чем пациенты с аллергией на пенициллины [12].
Особым вопросом безопасности макролидов является их гепатотоксичность, поскольку в научной литературе описаны случаи серьезного поражения печени при их использовании [1]. В представленном недавно обзоре были проанализированы данные о безопасности различных антибиотиков для печени. Установлено, что гепатотоксические реакции при использовании фторхинолонов, тетрациклинов, макролидов и пенициллина наблюдаются существенно реже, чем при использовании амоксициллина/клавуланата, ко-тримоксазола, сульфаниламидов, препаратов для лечения туберкулеза. В частности, частота нежелательных эффектов со стороны печени при использовании эритромицина и кларитромицина составляет менее 4 случаев на 100 тыс. назначений, что меньше средней частоты гепатотоксических реакций на антибактериальные препараты в целом. При этом отмечено, что гепатотоксичность антибиотиков обычно проявляется при длительном курсе применения, использовании высоких доз препарата, у пожилых людей, у пациентов с исходной патологией печени, при одновременном применении гепатотоксических лекарственных средств и алкоголя [13].
При использовании кларитромицина необходимо учитывать, что он оказывает ингибирующее действие на цитохром P450, который участвует в метаболизме многих лекарственных средств. При одновременном использовании с такими средствами может, с одной стороны, повышаться их концентрация в крови и возникать риск токсического эффекта, а с другой стороны, снижаться эффективность кларитромицина [1, 2].
Рекомендации по применению в педиатрии
В России оригинальный препарат кларитромицина – Клацид® – зарегистрирован для использования у детей в виде таблеток, покрытых оболочкой (250 и 500 мг), и порошка для приготовления суспензии для приема внутрь (125 мг/5 мл и 250 мг/5 мл). Препарат в пероральной форме не имеет возрастных ограничений, но таблетки могут использоваться у детей с 3-летнего возраста. У детей до 12 лет предпочтительно применение суспензии в дозе 7,5 мг/кг каждые 12 часов (не более 500 мг в сутки), старше 12 лет – по 250–500 мг каждые 12 часов. Обычный курс лечения составляет от 5 до 14 дней. В педиатрии кларитромицин рекомендован для применения при инфекциях различной локализации, вызванных чувствительными бактериями:
- заболевания верхних дыхательных путей и ЛОР-органов – стрептококковый тонзиллофарингит, бактериальный риносинусит, острый средний отит [1, 2, 14];
- заболевания нижних дыхательных путей – острый бронхит, обострение хронического бронхита, пневмония (препарат включен в стандарты медицинской помощи больным острым бронхитом и пневмонией Минздравсоцразвития для взрослых и детей в амбулаторно-поликлинических условиях) [1, 2, 15–17];
- заболевания желудочно-кишечного тракта, ассоциированные с H. pylori (в составе эрадикационной терапии) [1, 2];
- заболевания кожи и мягких тканей [1, 2];
- заболевания, вызванные M. avium (профилактика и лечение) [1, 2].
1. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. Смоленск: Русич, 1998. 303 с.
2. Рачина С.А., Страчунский Л.С., Козлов Р.С. Кларитромицин: есть ли потенциал для клинического применения в XXI веке? // Клин. микробиол. антимикроб. химиотер. 2005. Т. 7. № 4. С. 369–392.
3. Wozniak D.J., Keyser R. Effects of subinhibitory concentrations of macrolide antibiotics on Pseudomonas aeruginosa // Chest. 2004. Vol. 125. Suppl. 2. P. 62–69.
4. Yamaryo T., Oishi K., Yoshimine H. et al. Fourteen-member macrolides promote the phosphatidylserine receptor-dependent phagocytosis of apoptotic neutrophils by alveolar macrophages // Antimicrob. Agents Chemother. 2003. Vol. 47. № 1. Р. 48–53.
5. Ichiyama T., Nishikawa M., Yoshitomi T. et al. Clarithromycin inhibits NF-kappa B activation in human peripheral blood mononuclear cells and pulmonary epithelial cells // Antimicrob. Agents Chemother. 2001. Vol. 45. № 1. Р. 44–47.
6. Tamaoki J. The effects of macrolides on inflammatory cells // Chest. 2004. Vol. 125. Suppl. 2. P. 41–50.
7. Williams A.C., Galley H.F., Watt A.M., Webster N.R. Differential effects of three antibiotics on T helper cell cytokine expression // J. Antimicrob. Chemother. 2005. Vol. 56. № 3. Р. 502–506.
8. Tamaoki J., Takeyama K., Yamawaki I. et al. Lipopolysaccharide-induced goblet cell hypersecretion in the guinea pig trachea: inhibition by macrolides //Am. J. Physiol. 1997. Vol. 272. P. 15–19.
9. Tanabe T., Kanoh S., Tsushima K. et al. Clarithromycin inhibits interleukin-13-induced goblet cell hyperplasia in human airway cells // Am. J. Respir. Cell. Mol. Biol. 2011. Vol. 45. № 5. Р. 1075–1083.
10. Conte J.E. Jr., Golden J., Duncan S. et al. Single-dose intrapulmonary pharmacokinetics of azithromycin, clarithromycin, ciprofloxacin, and cefuroxime in volunteer subjects // Antimicrob. Agents Chemother. 1996. Vol. 40. № 7. Р. 1617–1622.
11. Van der Linden P.D., van der Lei J., Vlug A.E., Stricker B.H. Skin reactions to antibacterial agents in general practice // J. Clin. Epidemiol. 1998. Vol. 51. № 8. P. 703–708.
12. Lutomski D.M., Lafollette J.A., Biaglow M.A., Haglund L.A. Antibiotic allergies in the medical record: effect on drug selection and assessment of validity // Pharmacotherapy. 2008. Vol. 28. № 11. P. 1348–1353.
13. Andrade R.J., Tulkens P.M. Hepatic safety of antibiotics used in primary car // J. Antimicrob. Chemother. 2011. Vol. 66. № 7. P. 1431–1446.
14. Баранов А.А., Богомильский М.Р., Волков И.К. и др. Применение антибиотиков у детей в амбулаторной практике: практические рекомендации // КМАХ. 2007. Т. 9. № 3. C. 200–210.
15. Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно-практическая программа. М.: Оригинал-макет, 2011. 64 с.
16. Приказ Министерства здравоохранения и социального развития Российской Федерации от 12 февраля 2007 г. № 108 "Об утверждении стандарта медицинской помощи больным с острым бронхитом".
17. Приказ Министерства здравоохранения и социального развития Российской Федерации от 8 июня 2007 г. № 411 "Об утверждении стандарта медицинской помощи больным с пневмонией, вызванной Streptococcus pneumoniae; пневмонией, вызванной Haemophilus influenzae [палочкой Афанасьева-Пфейффера]; бактериальной пневмонией, неклассифицированной в других рубриках; пневмонией, вызванной другими инфекционными возбудителями, неклассифицированной в других рубриках; пневмонией без уточнения возбудителя; абсцессом легкого с пневмонией (при оказании специализированной помощи)".
Новости на тему
24.03.2022 16:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.