Применение отечественного аналога пролонгированного соматостатина Октреотид-депо™ в дозах 20–40 мг у больных НЭО. Опыт отделения химиотерапии РОНЦ
- Аннотация
- Статья
- Ссылки
По данным реестра SEER (Surveillance, Epidemiology, and End Results), в США заболеваемость НЭО на 1 января 2004 г. составила 35 случаев на 100 000 населения. За последние 30 лет отмечается значительное увеличение заболеваемости НЭО всех локализаций. При анализе базы данных SEER было отмечено увеличение продолжительности жизни больных с метастатическими нейроэндокринными опухолями за период с 1988 по 2004 г. Авторы предположили, что одной из возможных причин послужило внедрение в 1987 г. в практику октреотида, который применялся для купирования карциноидного криза [1]. В России до сегодняшнего дня нет статистических данных по заболеваемости нейроэндокринными опухолями. Это затрудняет анализ результатов лечения и выработку диагностического алгоритма.
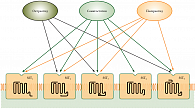
Особое место в лечении больных с функционально активными НЭО имеют аналоги природного соматостатина (октреотид, ланреотид, пасиреотид). Влияние соматостатина на эндокринные клетки осуществляется различными механизмами, что приводит к угнетению таких клеточных функций, как секреция, подвижность и пролиферация. Осуществление биологических эффектов соматостатина происходит через специфические соматостатиновые рецепторы (ССР) [2]. Всего выделено 5 подтипов ССР (рис. 1). Биологические эффекты аналогов соматостатина связаны с их сродством к определенному типу рецепторов. Торможение секреции связано со SSTR2. Сродством к этому типу рецепторов обладают все синтетические аналоги соматостатина, применяемые в настоящее время. Рецепторы соматостатина представлены и в первичных опухолях, и в их метастазах [3].
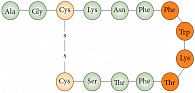
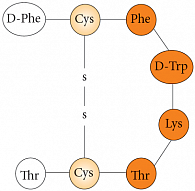
Соматостатин в организме человека существует в двух формах (SRIF – somatotropin release-inhibiting factor – фактор, угнетающий выделение соматотропина): SRIF-14, состоящий из 14 аминокислот (рис. 2), и SRIF-28, состоящий из 28 аминокислот. Природный соматостатин имеет короткий период полураспада – 3 минуты, поэтому не может быть использован для лечения нейроэндокринных опухолей. Для этих целей используется аналог соматостатина – октреотид, полураспад которого составляет 2 часа (рис. 3). Октреотид – синтетический аналог соматостатина, обладающий сходными с ним фармакологическими эффектами, но значительно большей продолжительностью действия. Октреотид подавляет секрецию гормона роста (соматотропина), инсулина, глюкагона, гастрина, серотонина, как патологически повышенную, так и вызванную приемом пищи; также подавляет секрецию инсулина и глюкагона, стимулированную аргинином. Октреотид подавляет секрецию тиреотропина, вызываемую тиреолиберином.
Применяется в дозе 100 мкг 3 раза в день ежедневно. Возможно назначение до 1200 мкг в сутки с использованием внутривенного пути введения. В настоящее время создана депо-форма октреотида. Кроме удобства (поскольку применяется один раз в месяц), она имеет преимущества перед короткоживущим октреотидом за счет поддержания непрерывной концентрации препарата в организме, что увеличивает симптоматический и противоопухолевый эффекты.
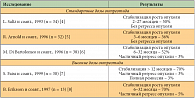
Октреотид оказывает симптоматический эффект, понижая секрецию гормонов и пептидов. Антипролиферативное действие аналогов соматостатина в отношении высокодифференцированных метастатических НЭО остается предметом дискуссий. В таблице 1 представлены сводные литературные данные, демонстрирующие эффект препарата при НЭО в стандартных и высоких дозах. Стабилизация опухоли отмечалась в 36–70% случаев. Регрессия опухоли отмечалась лишь в 3–5% случаев при использовании высоких доз препарата.
В 2009 г. было проведено плацебоконтролируемое двойное слепое исследование III B фазы (PROMID), в котором участвовали больные с высокодифференцированными НЭО из производных средней кишки (тонкая кишка, аппендикс, слепая и восходящий отдел ободочной кишки). Проверялась гипотеза о том, что октреотид обладает антипролиферативным эффектом, удлиняет время до прогрессирования опухоли и продолжительность жизни. Больных, ранее не получавших лечения, случайным образом распределили на группы приема плацебо и октреотида ЛАР в дозе 30 мг в/м; инъекции повторяли ежемесячно до наступления прогрессирования опухоли или смерти пациента. Основным оцениваемым показателем эффективности было время до прогрессирования, дополнительными показателями служили продолжительность жизни и противоопухолевый ответ. В исследовании участвовали 85 пациентов: 42 человека – в группе приема октреотида и 43 – в группе плацебо.
Медиана времени до прогрессирования в группах октреотида ЛАР и плацебо составила 14,3 и 6 месяцев соответственно (отношение рисков (ОР) 0,34; 95%-ный доверительный интервал (ДИ) 0,20–0,59; p = 0,000072). Через 6 месяцев лечения стабилизация заболевания отмечена у 66,7% пациентов из группы октреотида ЛАР и у 37,2 % – из группы плацебо. Функционально активные и неактивные опухоли реагировали на терапию сходным образом. Наиболее благоприятные результаты лечения отмечены при низкой степени метастатического поражения печени, а также после удаления первичной опухоли. Авторами был сделан вывод о том, что октреотид статистически значимо увеличивает время до прогрессирования по сравнению с плацебо у больных с функционально активными и неактивными метастатическими НЭО средней кишки [9].
Характеристика больных и методы исследования
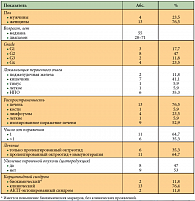
В нашем исследовании изучался Октреотид-депо™ – синтетический пролонгированный аналог соматостатина отечественного производства (выпускается компанией «Фарм-Синтез»), зарегистрированный в России в 2006 г. В исследование вошли больные с морфологически подтвержденным диагнозом нейроэндокринной опухоли, в основном G1 и G2, ранее получавшие лечение, у которых зарегистрировано прогрессирование либо отмечалось повышение биохимических маркеров и недостаточный контроль симптомов карциноидного синдрома. Все больные имели диссеминированный опухолевый процесс.
Всего препарат Октреотид-депо™ получали 47 больных. У 30 человек препарат использовался в сочетании с химиотерапией в режиме XELOX для купирования симптомов карциноидного синдрома. 17 больных получали биотерапию как самостоятельный вид лечения. В нашей статье анализируется эффективность препарата именно в этой группе больных. Все больные получали препарат Октреотид-депо™ в дозах от 20 до 40 мг в/м 1 раз в 28 дней. Характеристика больных представлена в таблице 2.
Результаты
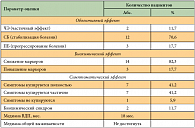
Основным оцениваемым показателем была медиана времени до прогрессирования (ВДП), отсчет времени происходил от момента начала лечения препаратом Октреотид-депо™. Кроме этого оценивалась медиана выживаемости, а также объективный эффект. Дополнительным оцениваемым показателем была переносимость лечения. Оценку эффекта проводили с помощью КТ, УЗИ и рентгенографии, а также по биохимическим маркерам и динамике клинических проявлений карциноидного синдрома. Объективный эффект оценен у 17 больных. Частичный эффект отмечен у 2 больных, получавших Октреотид-депо™ в сочетании с интерферонами. У одного пациента с НЭО тимуса и АКТГ-эктопированным синдромом биохимического и клинического эффекта отмечено не было.
Симптоматический эффект был отмечен практически у всех из 30 больных, получающих Октреотид-депо™ в сочетании с химиотерапией, и был подтвержден биохимическим эффектом (снижением уровня гормонов) [10]. Нежелательных побочных явлений, связанных с применением препарата Октреотид-депо™, отмечено не было. Гриппоподобный синдром, связанный с применением интерферона, отмечался у 3 из 11 пациентов (27,3%), получавших Октреотид-депо™ в сочетании с интерфероном.
Вывод
Октреотид-депо™ в дозах 20–40 мг позволяет контролировать симптомы карциноидного синдрома опухоли у больных диссеминированными формами нейроэндокринных опухолей как при совместном применении с иммунотерапией и химиотерапией, так и в монотерапии и имеет хорошую переносимость. Добавление препарата Октреотид-депо™ не увеличивало токсичность иммунотерапии и химиотерапии.
