Нейроэндокринные опухоли
- Аннотация
- Статья
- Ссылки
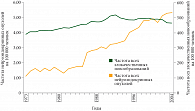
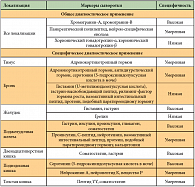


Нейроэндокринные опухоли могут развиваться в различных органах и тканях и обладают свойствами, отличающими их от классических опухолевых образований. Это продукция определенных маркеров крови, экспрессия специфических маркеров в ткани. Данные свойства нейроэндокринных опухолей активно используются в современной диагностике – определение опухолевых маркеров в крови (табл. 1) и тканях (табл. 2), рентгенодиагностические методы, основанные на взаимодействии меченных радионуклидами лигандов со специфическими рецепторами (октреоскан, ПЭТ с меченным различными радионуклидами октреотидом) или с использованием меченых предшественников аминов, способных усваиваться нейроэндокринными клетками (ПЭТ с 11С-5-гидрокситриптофаном или 18F-ДОФА). В последние десятилетия в мире отмечается рост заболеваемости НЭО. Так, база данных SEER (the Surveillance Epidemiology and End Results Database) США свидетельствует о 5-кратном увеличении заболеваемости НЭО за последние 30 лет (рис. 1) [6]. Подходы к терапии НЭО различны и зависят от степени дифференцировки опухоли. Всемирная организация здравоохранения (ВОЗ) разработала классификацию нейроэндокринных опухолей, основываясь на степени потенциала злокачественности [10]:
- высокодифференцированная эндокринная опухоль (индекс пролиферации ИП ≤ 2%);
- высокодифференцированная эндокринная карцинома (ИП > 2%, но < 15%);
- низкодифференцированная эндокринная карцинома (ИП > 15%);
- смешанные экзокринно-эндокринные опухоли;
- опухолеподобные образования [7].
При высокодифференцированных опухолях с высоким потенциалом злокачественности (G2) возможно применение цитотоксической терапии. По-прежнему остаются актуальными комбинации на основе доксорубицина, фторурацила и стрептозотоцина, которые используются с 1970-х гг., объективный эффект при лечении данными комбинациями составляет от 16 до 33% [10–12, 13]. В последнее время основными альтернативными схемами лечения стали комбинации темозоломида с капецитабином [14] и оксалиплатина с капецитабином [15]. При низкодифференцированной эндокринной карциноме основной и наиболее эффективной схемой химиотерапии является комбинация этопозида с цисплатином, при которой частота объективного эффекта достигает 67% [16]. Ниже представлены основные достижения терапии отдельных типов нейроэндокринных опухолей за последнее время. На 11-м Всемирном конгрессе по колоректальному раку в Барселоне были представлены результаты рандомизированного исследования сравнительной эффективности эверолимуса в монотерапии и в комбинации с сандостатином ЛАР у пациентов с эндокринными опухолями поджелудочной железы при прогрессировании на химиотерапии (исследование RADIANT 1) [17]. Добавление эверолимуса к сандостатину ЛАР способствовало улучшению как непосредственной эффективности (контроль роста опухоли составил 84,4% в группе комбинированной терапии и 77% в группе монотерапии эверолимусом), так и отдаленных результатов лечения (безрецидивная выживаемость составила 16,7 и 9,7 мес. соответственно).
На конференции Европейского общества клинической онкологии (ESMO) были представлены результаты еще двух рандомизированных исследований по изучению эверолимуса – RADIANT 2 и RADIANT 3. RADIANT 2 – это открытое рандомизированное исследование по сравнению эффективности и переносимости эверолимуса в монотерапии и в комбинированной терапии с октреотидом ЛАР у пациентов с высокодифференцированными диссеминированными НЭО (с высоким (G2) и низким (G1) злокачественным потенциалом), прогрессирующими на химиотерапии, или с выраженным карциноидным синдромом. Результаты лечения продемонстрировали преимущества комбинированной терапии. Медиана безрецидивной выживаемости составила 16,4 мес. в группе «эверолимус + октреотид ЛАР» и 11,3 мес. в группе монотерапии эверолимусом. Основными побочными эффектами были стоматит, сыпь, слабость и диарея [18]. RADIANT 3 – открытое рандомизированное исследование эффективности и переносимости эверолимуса в сравнении с плацебо у пациентов с эндокринными опухолями поджелудочной железы, прогрессирующими на химиотерапии. Безрецидивная выживаемость составила 4,6 мес. в группе плацебо и 11 мес. в группе эверолимуса. Основными побочными эффектами были стоматит, сыпь, диарея и слабость [19].
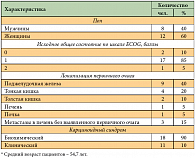
Все указанные выше препараты (эверолимус, сунитиниб и вандетаниб) были одобрены для клинического применения в США и Европе. В отделении химиотерапии РОНЦ им. Н.Н. Блохина изучается эффективность отечественного противоопухолевого препарата Араноза (арабинопиранозилметил нитрозомочевина) при НЭО. Предпосылкой к его изучению стало сходство химической структуры Аранозы со структурой стрептозотоцина, который входит в стандарты лечения НЭО в зарубежных странах. Как и стрептозотоцин, Араноза является сахаросодержащим производным нитрозомочевины. Препарат разрешен для применения у взрослых и детей в качестве противоопухолевого средства при меланоме кожи как в монотерапии, так и в комбинации с другими противоопухолевыми препаратами. В исследование за период 2010–2011 гг. включено 20 пациентов с метастатическими нейроэндокринными опухолями. Характеристика пациентов представлена в таблице 3. Доза Аранозы в монорежиме составила 480–690 мг/м2 с 1-го по 3-й день каждые 3 недели. Эффективность Аранозы в монорежиме при метастатических НЭО оценена у 16 больных: частичный эффект достигнут у 4 (25%) больных, стабилизация – у 10 больных (62%). Минимальный эффект в группе со стабилизацией наблюдался в диапазоне от 1 до 14% и от 15 до 29% по шкале RECIST у 4 и 6 пациентов соответственно. Прогрессирование зафиксировано у двух больных (13%) (табл. 4).
Десять пациентов получали аналоги соматостатина на фоне проведения химиотерапии в дозе от 20 до 40 мг 1 раз в 28 дней: 6 пациентов – в дозе 20 мг (из них у трех пациентов установлен частичный эффект и у трех – стабилизация заболевания), 2 пациента – в дозе 30 мг (установлена стабилизация заболевания у обоих пациентов) и 2 пациента – в дозе 40 мг (диагностирована стабилизация заболевания у обоих пациентов). Препарат продемонстрировал умеренную токсичность. Наиболее частым побочным эффектом при проведении химиотерапии с Аранозой была гематологическая токсичность: тромбоцитопения и нейтропения. Гематологические осложнения были обратимыми и не требовали прекращения химиотерапии. Объективный эффект при применении Аранозы в монорежиме был достигнут в 25% случаев, контроль роста опухоли – в 87% случаев; лечение продемонстрировало приемлемый уровень токсичности в первой и последующих линиях терапии при метастатических НЭО с различной локализацией первичного очага.
Существует много проблем, связанных с диагностикой и лечением НЭО в России. В первую очередь, это отсутствие национального регистра по учету НЭО и хотя бы приблизительных данных о распространенности патологии. В настоящее время нейроэндокринный рак включается в общую статистику злокачественных новообразований по органной принадлежности. А некоторые НЭО, такие как эндокринные опухоли поджелудочной железы (инсулиномы, гастриномы и т.п.), даже не относят к злокачественным. Другими словами, в национальном регистре злокачественных опухолей не существует диагноза «нейроэндокринная опухоль». Такое положение препятствует распространению знаний о НЭО среди врачей-онкологов в регионах. Отсутствуют образовательные программы по патоморфологической, рентгенологической диагностике и терапии НЭО. Большинство патологоанатомических и биохимических лабораторий не располагают возможностями для диагностики НЭО, соответственно, об опыте лечения вообще говорить не приходится. Новые препараты, эффективность которых при НЭО была доказана в международных клинических исследованиях, длительное время проходят регистрацию в России, что также ограничивает возможности терапии НЭО на современном уровне.
Изучение возможностей современной цитостатической и таргетной терапии при нейроэндокринных опухолях только сейчас выходит на должный уровень. Дело в том, что в связи с редкостью данного заболевания трудно проводить рандомизированные клинические исследования, результаты которых могли бы дать ответы на многие накопившиеся вопросы. Перспективным направлением является изучение комбинированной терапии цитостатиками и таргетными препаратами: темозоламид + эверолимус, FOLFOX + бевацизумаб, XELOX + бевацизумаб, циклофосфамид + сорафениб. Изучаются комбинации двух таргетных препаратов, например, сорафениб + эверолимус, пасиреотид ЛАР + эверолимус, эверолимус + эрлотиниб и циксутумумаб + октреотид. Это далеко не полный список комбинированной терапии НЭО, изучаемой в данное время в мире. Низкая осведомленность врачей онкологов и патоморфологов об этих заболеваниях, а также недостаточная оснащенность диагностической базы клиник препятствует проведению международных клинических исследований на территории России, что, в свою очередь, осложняет процесс регистрации новых эффективных препаратов для лечения этих сложных заболеваний. Совершенно очевидна необходимость разработки и внедрения национальной программы по диагностике и лечению НЭО, а также популяризации знаний о НЭО среди врачей различных специальностей, поскольку именно мультидисциплинарный подход является залогом успеха в лечении этих заболеваний.
