Роль трастузумаба (Герцептина) в персонализации лекарственной терапии рака желудка
- Аннотация
- Статья
- Ссылки


Рак желудка занимает второе место в структуре онкологической смертности в мире. Восточная Европа по заболеваемости находится на третьем месте после Японии и Китая. В России ежегодно регистрируются 40 000 новых случаев и 25 000 смертей от рака желудка. В развитии лекарственного лечения рака желудка наблюдаются тенденции, характерные для лечения чувствительных к химиотерапии опухолей. Метаанализ рандомизированных исследований при раке желудка показал, что комбинированная химиотерапия приводит к существенному повышению показателей общей выживаемости по сравнению с монохимиотерапией или наилучшей поддерживающей терапией [1].
Режим DCF (доцетаксел, цисплатин, 5-фторурацил (5-ФУ)) признан стандартом лечения на современном этапе в США. Однако этот режим обладает выраженной миелотоксичностью: по зарубежным данным, нейтропения 3–4-й степени развивается в 82,3% случаев. Была предложена следующая модификация режима DCF: доцетаксел (Таксотер) 75 мг/м2 во 2-й день, цисплатин 75 мг/м2 во 2-й день, 5-ФУ 500 мг/м2 – 3-часовая инфузия в 1, 2, 3-й дни каждые 21 день (TPF), что позволило сохранить эффективность терапии (ОЭ = 48,1%, МВДП = 5,5 мес.; МОВ = 11,5 мес.; 1-годичная выживаемость – 46,6%) и снизить частоту побочных эффектов: нейтропения 3–4-й степени – с 82,3% до 57,1%, фебрильная нейтропения 3–4-й степени – с 30% до 10,3% [2].
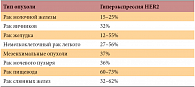
Наиболее эффективные режимы комбинированной химиотерапии, такие как DCF, EOX (эпирубицин, оксалиплатин, капецитабин), ХР (капецитабин, цисплатин), позволили увеличить медиану выживаемости больных с диссеминированным раком желудка до 9,2–11,2 мес. (рис. 1) [2, 3, 4]. Фундаментальные исследования подтвердили наличие амплификации и гиперэкспрессии гена HER2 не только при раке молочной железы, но и при ряде других солидных опухолей (табл. 1) [5]. Учитывая усиливающийся интерес к возможностям таргетной терапии и известные с 1994 г. данные о частоте гиперэкспрессии HER2 при раке желудка (по разным данным, у 12–55% больных), начато изучение Герцептина у больных с HER2-положительным раком желудка.
С этой целью было организовано международное рандомизированное исследование III фазы ToGA (Trastuzumab for Gastric Adenocarcinoma) [6]. В качестве схемы химиотерапии был выбран режим: 5-фторурацил или капецитабин с цисплатином ± трастузумаб (Герцептин). Данный режим был выбран как один из наиболее эффективных, хорошо переносимых, универсальных, используемых в качестве схемы сравнения во многих исследованиях. В качестве факторов стратификации рассматривались: распространенность процесса, локализация опухоли (желудок или пищеводно-желудочный переход – ПЖП), измеряемая или неизмеряемая опухоль, общее состояние больного по шкале ECOG (0–2), какой фторпиримидиновый препарат был использован – 5-фторурацил или капецитабин.
Критериям включения соответствовали мужчины и женщины старше 18 лет с гистологически подтвержденной неоперабельной местнораспространенной рецидивной или метастатической аденокарциномой желудка или гастроэзофагеального перехода; с общим статусом пациента 0–2 по критериям ECOG; с ненарушенной функцией печени, измеряемыми или неизмеряемыми очагами. HER2-статус опухолей определялся централизованно с помощью иммуногистохимии (HercepTest, Dako, Denmark) и флуоресцентной гибридизации in situ (FISH; HER2 FISH pharmDx, Dako). Вследствие биологических различий, характерных для опухолей молочных желез и желудка, особенно из-за гетерогенности опухолей, для рака желудка была разработана новая классификация иммуногистохимических критериев, специфичных для рака желудка. Эти критерии были скорректированы согласно исследованию Hofmann и соавт. [7].
Главной целью исследования ToGA являлось сравнение общей выживаемости больных. Был проведен скрининг 3807 больных, у 810 из них (22,1%) выявили HER2-положительный статус опухоли. В исследовании участвовали 584 пациента, удовлетворявшие всем критериям включения. Больные были рандомизированы на 2 группы: 290 больных получали 5-фторурацил или капецитабин с цисплатином, а 294 пациента – те же схемы + трастузумаб.
В качестве примера успешного лечения больного, получавшего в соответствии с протоколом лечение Герцептином в комбинации с Кселодой и цисплатином, приводим выписку из истории болезни. Больной А., 71 год, обратился в РОНЦ им. Н.Н. Блохина РАМН в январе 2006 г. с жалобами на чувство жжения в эпигастральной области, болезненность в правом подреберье. Был поставлен диагноз рака желудка T3N2M1 IV стадии с метастазами в печени и забрюшинных лимфоузлах. Гистологически опухоль представляла собой высокодифференцированную аденокарциному HER2+++ (ИГХ3+).
С марта по июль 2006 г. проведено 6 курсов химиотерапии Кселодой и цисплатином в комбинации с Герцептином. В результате 4 курсов терапии отмечена частичная регрессия опухоли: при ЭГДС от 24.04.2006 на месте изъязвленной опухоли в средней трети тела желудка определяется рубцующийся дефект 1,0 х 1,2 см. ФВЛЖ – 55%. Метастаз в левой доле, размер которого до лечения составлял 6,5 х 3,8 см, распался на 2 очага – 1,2 х 1,2 см и 1,2 х 0,8 см. Метастаз в правой доле 7,8 х 7,0 см уменьшился до 4,2 х 2,2 см. Забрюшинные лимфоузлы уменьшились с 1,2 см в диаметре до 0,8 см. С июня 2006 г. больному продолжена поддерживающая терапия Герцептином по 6 мг/кг 1 раз в 3 недели. При ЭГДС от 24.11.2007 на месте опухоли определяются рубцовые изменения, при цитологическом и гистологическом исследованиях элементов опухоли не получено.
При КТ от 18.08.2008 сохраняется частичная регрессия: метастазы в левой доле печени – 0,7 х 0,7 см и 0,2 х 0,3 см (контуры нечеткие, возможен фиброз), метастаз в правой доле – 2,0 х 1,1 см (контуры нечеткие и тяжистые, возможен фиброз). В связи с острым инсультом, случившимся 20.01.2009, лечение Герцептином было прекращено. После восстановления состояния пациента с 05.02.2009 возобновлена поддерживающая терапия Герцептином, и 26.02.2009 выполнена пункционная биопсия очагового образования в печени. При цитологическом исследовании получены клетки рака, что подтвердило частичную, но не полную ремиссию заболевания у пациента. Однако 10.06.2009 при КТ выявлено прогрессирование процесса.
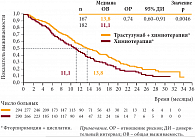
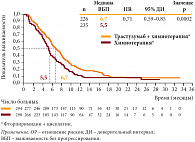
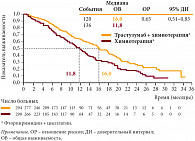
В дальнейшем проводилась химиотерапия Кселодой (со стабилизацией процесса), от которой больной был вынужден отказаться в связи с плохой переносимостью лечения. Продолжительность частичной ремиссии составила 36 мес. Продолжительность жизни от момента начала лечения – более 60 мес. Таким образом, итоги исследования ToGA показали, что в результате добавления Герцептина к комбинированной химиотерапии 5-фторурацилом или капецитабином и цисплатином достигнуто увеличение медианы выживаемости примерно на 3 мес. (с 11,1 до 13,8 мес., р = 0,0046) у больных с HER2-положительным раком желудка. Применение Герцептина у больных раком желудка с опухолевой гиперэкспрессией HER2 позволило увеличить медиану общей выживаемости до 16 мес. (рис. 5).
Трастузумаб в сочетании с химиотерапией уменьшает риск смерти на 26% (HR = 0,74). Получено достоверное улучшение ВБП и ОЭ. Добавление трастузумаба к химиотерапии не привело к увеличению частоты побочных эффектов. Лечение хорошо переносилось больными. При распространенной аденокарциноме желудка или пищеводно-желудочного перехода с опухолевой гиперэкспрессией HER2 Герцептин зарегистрирован в комбинации с капецитабином или внутривенным введением 5-фторурацила и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по поводу метастатической болезни.
