Проблемы коморбидного пациента: как выбрать правильный статин
- Аннотация
- Статья
- Ссылки
- English

Сердечно-сосудистые (ССЗ) и цереброваскулярные заболевания (ЦВЗ), представленные в официальной международной статистике как болезни системы кровообращения, являются ведущими причинами смертности населения практически во всех странах мира, в частности в России, – 55% летальных исходов от всех причин как среди мужчин, так и среди женщин [1].
Единство патофизиологических процессов, приводящих к развитию и прогрессированию ССЗ и ЦВЗ, подтверждается общими для них факторами риска – артериальной гипертензией (АГ), атерогенной дислипидемией, гипергликемией, сахарным диабетом (СД), ожирением, особенно абдоминального типа, метаболическим синдромом (МС), инсулинорезистентностью (ИР), хронической болезнью почек (ХБП), а также курением и гиподинамией.
Многие из названных факторов риска являются самостоятельными заболеваниями, приводящими к развитию сосуществующих с ними болезней или ухудшению их прогноза. Такая клиническая картина взаимодействия нескольких патологий у одного больного хорошо известна всем врачам. Сегодня только одно заболевание у пациента, особенно среднего и пожилого возраста, – явление достаточно редкое.
Термин «коморбидность» (от лат. со – вместе, morbus – болезнь) предложил в 1970 г. A. Feinstein – врач, исследователь и эпидемиолог, оказавший большое влияние на технику проведения клинических исследований, особенно в области клинической эпидемиологии. Он вкладывал в этот термин идею о наличии дополнительной клинической картины, которая уже существует или может появиться самостоятельно помимо текущего заболевания и всегда отличается от него [2]. Однако принципиальное уточнение в термин коморбидности внесли H.C. Kraemer и M. Akker, определив ее как сочетание у одного больного нескольких хронических заболеваний. Они же предложили первую классификацию коморбидности [3, 4]. Согласно данным этих авторов, факторами, влияющими на развитие коморбидности, могут быть хроническая инфекция, воспаление, инволютивные и системные метаболические изменения, ятрогения, социальный статус, экологическая обстановка и генетическая предрасположенность [5].
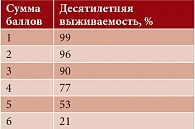
Количество больных с пятью и более сопутствующими заболеваниями увеличилось с 42% в 1988–1994 гг. до 58% в 2003–2008 гг. [6, 7]. Среди современных систем оценки коморбидности наиболее распространен индекс Charlson, предложенный в 1987 г. для определения отдаленного прогноза больных. Данный индекс, представляющий собой балльную систему оценки (от 0 до 40) наличия сопутствующих заболеваний, используется для прогноза летальности [8]. При его расчете суммируются баллы, соответствующие сопутствующим заболеваниям, а также прибавляется 1 балл на каждые десять лет жизни при превышении пациентом 40-летнего возраста (то есть 50 лет – 1 балл, 60 лет – 2 балла и т.д.) (табл. 1 и 2). Рассмотрим наиболее распространенные варианты коморбидности.
Варианты коморбидности, распространенные в клинической практике терапевта
Артериальная гипертензия – одна из актуальных проблем современной терапии, кардиологии и неврологии. Распространенность АГ в европейских странах, в том числе России, достигает 30–45% от общей популяции и резко возрастает по мере старения населения. АГ обычно не только сопровождает, но и является признанным ведущим фактором развития:
- ССЗ: инфаркта миокарда (ИМ), инсульта, ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН) и др.;
- ЦВЗ: хронической ишемии головного мозга, гипертонической энцефалопатии, ишемического или геморрагического инсульта, транзиторной ишемической атаки;
- почечных заболеваний: хронической болезни почек и терминальной почечной недостаточности.
АГ является самым частым компонентом коморбидности в практике любого врача. В терапевтической практике АГ имеет место в 90% случаев всех возможных сочетаний заболеваний [9]. Наиболее распространенный вариант – АГ с атеросклерозом или дислипидемией.
Атеросклероз – заболевание, поражающее артерии эластического типа. Это динамичный процесс, для которого характерно как прогрессирование, так и регрессирование изменений в стенке артерии. Однако без лечения с течением времени атеросклероз прогрессирует, приводя в конечном итоге к появлению клинических проявлений заболевания. Основным осложнением атеросклероза коронарных артерий считается ИБС, клинически проявляющаяся стенокардией, ИМ и кардиосклерозом, приводящим к прогрессирующей сердечной недостаточности. Поражение магистральных артерий головного мозга проявляется симптомами церебральной хронической ишемии с последующим развитием атеросклеротической энцефалопатии и инсульта. Атеросклероз артерий нижних конечностей сопровождается клинической картиной перемежающей хромоты и последующей критической ишемии. В отсутствие соответствующего лечения заболевание прогрессирует и может завершиться развитием гангрены нижних конечностей [8, 9].
ХБП – наднозологическое понятие, объединяющее всех пациентов с сохраняющимися в течение трех и более месяцев признаками повреждения почек и/или их функции. Концепция ХБП, сформулированная в 2002 г. экспертами Национального почечного фонда США, к настоящему времени получила признание международного медицинского сообщества, а в 2007 г. была введена в Международную классификацию болезней 10-го пересмотра и заменила устаревший термин «хроническая почечная недостаточность» [10]. Снижение скорости клубочковой фильтрации в процессе формирования ХБП рассматривается в качестве маркера неблагоприятного прогноза распространенных в популяции заболеваний, прежде всего ССЗ, что соответствует признанной концепции пяти типов кардиоренальных взаимоотношений [11–13]. По данным различных популяционных регистров и исследований, распространенность почечной патологии составляет 10–13%. В группах риска она достигает 20%.
ССЗ и ХБП имеют общие традиционные факторы риска – ожирение, дислипидемию, МС, СД и др. При этом численность популяции пациентов с почечными нарушениями в настоящее время возрастает в основном за счет вторичного повреждения почек в рамках ССЗ: АГ, атеросклероза, ИБС, ХСН и фибрилляции предсердий (ФП) [14].
Еще одно заболевание, входящее в самые частые коморбидные ассоциации, – СД. Действительно, сегодня СД приобрел максимальную распространенность. К 2030 г., по данным экспертов Всемирной организации здравоохранения (ВОЗ), число больных с данной патологией в мире возрастет до 552 млн, свыше 90% составят больные СД 2-го типа [15].
Согласно данным, озвученным на съезде Международной федерации диабета, в России в 2011 г. насчитывалось 12,5 млн пациентов с СД 2-го типа (почти 10% населения страны). Сегодня СД 2-го типа рассматривают как эквивалент присутствия у пациента клинически выраженного ССЗ. Собственно ССЗ встречаются у пациентов с СД 2-го типа в 2–5 раз чаще, чем у лиц без СД. При этом высок риск развития таких состояний, как ИБС, ИМ, АГ, инсульт. В структуре коморбидности у пациентов с СД на долю АГ приходится 80%, на долю атеросклероза – 70%, диастолической дисфункции миокарда – 50–75%, ХСН – 12–22%.
Смертность от ИМ среди больных СД в 1,5–2 раза выше, чем среди лиц, не страдающих этим заболеванием, как в острой стадии ИМ, так и при продолжительном наблюдении. Внезапная сердечная смерть пациентов с СД 2-го типа в структуре сердечно-сосудистой смертности составляет 50%. Центральное место занимает аритмогенный характер внезапной смерти [16]. Дополнительной проблемой при СД является вопрос компенсации гликемии, связанной с риском резко развивающихся гипогликемических состояний. Как известно, индекс гипогликемии возрастает в том случае, если длительность СД превышает шесть лет. При этом у пациентов выраженные гипогликемии ассоциированы с высоким риском внезапной сердечно-сосудистой смерти, развитием ИМ, инсульта, деменции [17].
Исходя из современных представлений, нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН) – состояния, способные прогрессировать с развитием СД 2-го типа. В 1990-х гг. эксперты ВОЗ предложили использовать новый термин – «предиабет», объединяющий НТГ и НГН. Сегодня в мире около 314 млн человек имеют предиабет, через 20 лет их число увеличится в 1,5 раза и составит около 500 млн человек. Именно они пополнят многомиллионную армию больных СД 2-го типа уже в ближайшем будущем [15].
Установлено, что частота развития СД у пациентов с НТГ и НГН примерно одинакова. НТГ более распространенное состояние по сравнению с НГН, и с ним связано большинство новых случаев СД. По данным эпидемиологических исследований, в группе пациентов с предиабетом переход в СД 2-го типа зависит от возраста, расовой принадлежности, степени ожирения и в среднем составляет 5% в год (от 3,6 до 8,7%). При пятилетнем наблюдении за такими пациентами СД 2-го типа разовьется в 35–40% случаев, а при сочетании НТГ и НГН – в 65% [17].
Кроме того, известно, что СД 2-го типа и гипергликемия без СД (предиабет) являются независимыми факторами риска быстрого развития системного атеросклероза с поражением сосудов различной локализации, в том числе мозговых. Не случайно изучению особенностей течения предиабета, его ранней диагностике и возможности первичной и вторичной профилактики придается особое значение. Врачу любой специальности, особенно терапевту, рекомендуется выявлять факторы риска развития СД 2-го типа и проводить скрининг (табл. 3), поскольку рано выявленный предиабет и адекватные профилактические меры могут изменить судьбу пациента.
Как видно из табл. 3, главным фактором развития СД 2-го типа является наличие избыточного веса, особенно при отложении жира в абдоминальной области, что характерно для МС. Таким образом, вариантом раннего скрининга на коморбидность будет выявление МС. Клиническая значимость различных видов патологии, объединенных в рамки синдрома, заключается в том, что их сочетание в значительной степени ускоряет развитие и прогрессирование заболеваний, связанных с атеросклерозом, – СД 2-го типа, ИБС, инсульта, ИМ, ХСН. В современном обществе эти заболевания имеют не только медицинское, но и социальное значение. Почему подобные состояния так тесно связаны друг с другом? Ответ – в единстве патогенеза и состояния, которое инициирует и постоянно поддерживает развитие патологических состояний, – инсулинорезистентности.
Инсулинорезистентность – звено патогенеза атеросклероза, артериальной гипертензии и сахарного диабета
Исходя из современных представлений, ключевым звеном патогенеза МС являются первичная ИР и компенсаторная гиперинсулинемия (ГИ).
ИР – нарушение опосредованной инсулином утилизации глюкозы клетками. Это состояние сопровождает целый ряд физиологических и патологических процессов. Физиологическая ИР выявляется в пубертатном периоде, при беременности, в климактерическом периоде, во время ночного сна, после приема богатой жиром пищи.
Метаболическая ИР характерна для МС, СД 2-го типа, декомпенсированного СД 1-го типа, диабетического кетоацидоза, ожирения, выраженной недостаточности питания, гиперурикемии, а также гипогликемии, индуцированной инсулином и злоупотреблением алкоголем. Эндокринная ИР отмечается при гипотиреозе, синдроме Кушинга, акромегалии, феохромоцитоме.
Неэндокринная ИР типична для гипертонической болезни, хронической почечной недостаточности, цирроза печени, сердечной недостаточности, ревматоидного артрита, черного акантоза, миотонической дистрофии, травм, ожогов, сепсиса, состояния после хирургических вмешательств, раковой кахексии [18].
Наибольшее клиническое значение при ИР имеет потеря мышечной, жировой и печеночной тканями чувствительности к инсулину. Предполагают, что причиной ускоренного атерогенеза и высокой летальности от ИБС и инсультов у больных СД 2-го типа также могут быть ИР и сопутствующая ей ГИ. У пациентов с ИР имеют место различные генетические дефекты компонентов процесса обмена глюкозы, липидов и инсулина. Генетическая предрасположенность к ИР может не реализоваться и не проявиться клинически (в виде МС и/или СД 2-го типа) в отсутствие необходимых для этого внешних факторов: избыточного калорийного питания (особенно жирной пищи) и низкой физической активности. Такие факторы сами по себе способствуют увеличению абдоминального ожирения, накоплению свободных жирных кислот (СЖК) и, следовательно, усилению имеющейся ИР.
Развивающаяся при ИР компенсаторная ГИ, с одной стороны, позволяет вначале поддерживать углеводный обмен в норме, с другой – способствует развитию метаболических, гемодинамических и органных нарушений, приводящих в конечном итоге к развитию ССЗ и СД 2-го типа [19].
ИР мышечной ткани проявляется в снижении поступления глюкозы из крови в миоциты и ее утилизации в мышечных тканях, ИР жировой ткани – в резистентности к антилиполитическому действию инсулина, приводящему к накоплению СЖК и глицерина. СЖК поступают в печень, где становятся основным источником формирования атерогенных липопротеинов очень низкой плотности. ИР ткани печени характеризуется снижением синтеза гликогена и активацией процессов распада гликогена до глюкозы (гликогенолиз) и синтеза глюкозы de novo из аминокислот, лактата, пирувата, глицерина (глюконеогенез), в результате чего кислота из печени поступает в кровоток.
В целом ИР – эволюционно закрепленный механизм выживания в неблагоприятных условиях. Когда периоды изобилия чередовались с периодами голода, ИР обеспечивала накопление энергии в виде отложений жира, запасов которого хватало для того, чтобы пережить голод. В современных условиях в странах с высоким экономическим развитием, постоянным изобилием и склонностью к малоподвижному образу жизни сохранившиеся в генетической памяти механизмы ИР продолжают работать на накопление энергии. Как следствие – развитие абдоминального ожирения, дислипидемии, раннего атеросклероза, АГ и СД 2-го типа [20].
К настоящему времени опубликованы результаты более десяти клинических исследований с участием не менее 15 000 пациентов. Полученные данные позволяют утверждать, что ИР и сопутствующая ей ГИ – факторы риска ускоренного атерогенеза и высокой летальности от ИБС. Кроме того, достаточно клинических доказательств того, что ГИ является независимым фактором риска ИБС у лиц без СД 2-го типа [21]. В последние годы это подтверждено и у больных СД 2-го типа. Приведенные данные экспериментально обоснованы. Работы R. Stout свидетельствуют о том, что инсулин оказывает прямое атерогенное действие на стенки сосудов, вызывая пролиферацию и миграцию гладкомышечных клеток, синтез липидов в них, пролиферацию фибробластов. Таким образом, ИР и ГИ вносят весомый вклад в прогрессирование атеросклероза как у лиц без СД, так и у больных СД 2-го типа [22].
ИР играет существенную роль в развитии АГ. Взаимосвязь гиперинсулинемии (маркера ИР) и эссенциальной АГ настолько прочна, что при высокой концентрации инсулина плазмы можно прогнозировать в скором времени развитие АГ. Причем эта связь прослеживается как у пациентов с ожирением, так и у лиц с нормальной массой тела. Существует несколько механизмов, объясняющих повышение артериального давления (АД) при ГИ.
Инсулин способствует активации симпатической нервной системы (СНС), повышению АД при ГИ, реабсорбции Na и воды в почечных канальцах, внутриклеточному накоплению Na и Са. Инсулин как митогенный фактор активирует пролиферацию гладкомышечных клеток сосудов, что приводит к утолщению их стенок. Механизм влияния инсулина на СНС до конца не изучен. Предполагают, что инсулин активирует СНС за счет прямого воздействия на центральную нервную систему, проникая через гематоэнцефалический барьер в перивентрикулярную область гипоталамуса, где, связываясь со своими рецепторами на поверхности нейронов, блокирует активность парасимпатической нервной системы. G.M. Reaven, основоположник концепции синдрома ИР, предположил, что причиной гиперактивации СНС в условиях гипергликемии может быть повышенный метаболизм глюкозы в ядрах гипоталамуса, что тормозит передачу блокирующих импульсов на симпатические центры продолговатого мозга.
Стимуляция СНС при ГИ сопровождается увеличением сердечного выброса, повышением общего периферического сосудистого сопротивления, что неизбежно приводит к повышению АД. Одновременное снижение активности парасимпатической системы, вызванное ГИ, увеличивает частоту сердечных сокращений. Повышение реабсорбции Na и воды происходит также под влиянием ГИ. Инсулин оказывает прямое воздействие на проксимальные канальцы нефронов, повышая реабсорбцию Na и жидкости. Помимо антинатрийуреза инсулин вызывает антикалийурез и антиурикозурию. В результате увеличивается объем циркулирующей жидкости, что приводит к повышению сердечного выброса [23].
Внутриклеточное накопление Na и Ca – эффект действия инсулина. Инсулин блокирует активность Na/K- и Ca/Mg/АТФазы клеточных мембран, что способствует увеличению внутриклеточного содержания Na и Ca. Вследствие накопления этих электролитов в стенках сосудов повышается чувствительность сосудистых рецепторов к действию сосудосуживающих факторов. Под влиянием инсулина происходит утолщение стенок сосудов. В норме инсулин, связываясь с рецепторами на поверхности клеток эндотелия, действует двояко. Первый путь – активация секреции оксида азота (NO) через субстраты инсулиновых рецепторов и фосфатидилинозитол-3-киназу. Этот механизм обеспечивает сосудорасширяющие и антиатерогенные свойства инсулина, участвует в инсулинзависимом транспорте глюкозы в клетки. Второй путь – реализация митогенных свойств инсулина через каскад посредников, повышающих активность митоген-активированной протеинкиназы (МАРК), что завершается пролиферацией и миграцией гладкомышечных клеток, активацией синтеза сосудосуживающего фактора эндотелина 1 и повышением АД. Оказалось, что в условиях ИР первый механизм не работает. Этот путь резистентен к действию инсулина, следовательно, молекула NO не синтезируется. В то же время второй механизм сохраняет высокую активность. Поэтому ГИ, развивающаяся вследствие ИР (при МС, СД 2-го типа, висцеральном ожирении), не только не снижает АД, а, напротив, оказывает прогипертензивное и атерогенное действие.
Существует взаимосвязь между активностью ренин-ангиотензиновой системы (РАС), уровнем АД и чувствительностью тканей к инсулину. Известно, что гиперактивность РАС стойко поддерживает высокое АД. Однако совсем недавно, в экспериментальных условиях, получены убедительные данные о том, что ангиотензин II (AT II) дозозависимо ингибирует пострецепторную сигнальную систему инсулина, реализующую транспорт глюкозы в клетки и продукцию NO [24]. Одновременно AT II стимулирует МАРК, задействованную в осуществлении митогенной и пролиферативной активности инсулина.
Таким образом, гиперактивность РАС и AT II вызывает резистентность тканей к антиатерогенному и гипотензивному действию инсулина, что приводит к развитию АГ, прогрессированию ССЗ, а также блокирует транспорт глюкозы в клетки, что способствует развитию предиабета, который затем может прогрессировать в СД 2-го типа.
Адипонектин: механизмы защиты
В последние годы были получены доказательства, что адипонектин (АДН) также играет значительную роль в патогенезе АГ, атеросклероза и СД 2-го типа.
АДН представляет собой выделенный из адипоцитов коллагеноподобный белок, продуцируемый исключительно жировой тканью. АДН является ключевой молекулой, препятствующей развитию МС из-за наличия антиатерогенных и инсулиномиметических свойств и его влияния на окисление липидов. АДН повышает чувствительность тканей к инсулину и обладает противовоспалительным и антиатерогенным свойствами. Высвобождаясь в системную циркуляцию, он накапливается в сосудистой стенке в ответ на повреждение эндотелия и участвует в антиатерогенном процессе путем подавления связывания моноцитов с клетками эндотелия и снижения экспрессии молекул адгезии [25]. Показано, что концентрации АДН в плазме снижены у тучных пациентов, особенно у лиц с висцеральным ожирением, пациентов с СД 2-го типа и ИБС [25].
У больных АГ уровни АДН в плазме ниже, чем у нормотензивных пациентов. Гипоадипонектинемия, так же как и ГИ, является независимым предиктором развития АГ, а уровни АДН в плазме обратно коррелируют с уровнем АД. В экспериментальных исследованиях показано, что у мышей с отсутствием или низкими уровнями АДН при кормлении пищей с высоким содержанием жиров, сахарозы и соли развиваются ожирение, ИР и АГ. При этом восполнение АДН сопровождается нормализацией АД. Такое действие АДН связано с его влиянием на эндотелиальную функцию, СНС и ренин-ангиотензин-альдостероновую систему.
АДН участвует в разных клеточных механизмах антиатерогенной защиты, проявляет антиатерогенные свойства в сосудистой стенке, подавляя связывание моноцитов с клетками эндотелия путем ингибирования экспрессии молекул адгезии. АДН также уменьшает индуцированную факторами роста пролиферацию клеток гладкой мускулатуры сосудистой стенки путем ингибирования процессинга МАРК.
Фактор некроза опухоли (ФНО) альфа, образующийся в жировой ткани, также может влиять на чувствительность периферических тканей к инсулину. Результаты исследования роли провоспалительных цитокинов позволили высказать предположение об определенной роли воспаления в патогенезе ИР. Считается, что хроническое субклиническое воспаление – это часть синдрома ИР, а цитокины – предикторы сосудистых осложнений диабета [26]. ФНО-альфа является цитокином, образование которого происходит как в иммунных, так и неиммунных клетках, включая эндотелиоциты, фибробласты и адипоциты. Установлено, что высвобождение ФНО-альфа из клеток жировой ткани аналогично его высвобождению из моноцитов или макрофагов [26]. Повышение синтеза ФНО-альфа в адипоцитах животных и при ожирении у человека сопровождается повышением степени выраженности ИР. Это позволяет считать, что данный цитокин – один из ключевых медиаторов развития ИР. Гипоадипонектинемия и повышенный уровень ФНО-альфа, также связанный с висцеральным ожирением, могут быть основными факторами развития сосудистых нарушений, метаболических расстройств, включая ИР и ГИ, которые входят в состав МС [25–27]. Эти данные свидетельствуют о том, что гипоадипонектинемия – ключевой фактор МС.
Таким образом, АДН является важнейшим адипокином с выраженным кардиопротективным действием. Повышение концентрации АДН в крови больных АГ, МС, атеросклерозом, ИБС, СД 2-го типа может существенно снижать риск развития осложнений у названных больных. Повышение же концентрации АДН в крови у лиц с факторами риска указанных заболеваний может рассматриваться как один из важнейших методов их профилактики. Сложность состоит в том, что уровень АДН в плазме крови у здорового человека должен быть достаточно высоким, а поддерживать высокий уровень путем прямого введения при его недостаточной продукции в организме на сегодняшний день достаточно сложно. Кроме того, показано, что наиболее активна высокомолекулярная форма АДН, недостаток которой обнаруживается при заболеваниях сердечно-сосудистой системы. Поэтому наиболее перспективным направлением исследований представляется поиск активаторов синтеза эндогенного АДН.
Новые возможности в коррекции метаболических нарушений, ИР и гипоадипонектинемии
Статины широко применяются в лечении ССЗ и ЦВЗ, поскольку они улучшают липидный профиль, а также снижают риск возникновения ИБС и инсульта. За последние 15 лет в связи с увеличением числа коморбидных пациентов общий профиль риска применения статинов существенно изменился и усложнился. Сопутствующие дислипидемии состояния – АГ, МС, ХБП и, конечно, СД – имеют взаимное усиливающее влияние на прогноз, но их лечение связано с определенным риском ухудшения метаболических показателей. Поскольку СД рассматривается в качестве эквивалента ИБС, вопрос о частоте и риске развития СД на фоне терапии статинами имеет значение для клинической практики. Подавляющее большинство руководств по ведению пациентов с СД содержит рекомендации, обосновывающие необходимость назначения статинов, снижающих уровень холестерина с целью уменьшения риска развития ССЗ. Между тем результаты клинических исследований и их метаанализов, проведенных в последнее время, свидетельствуют о том, что терапия статинами сопровождается достоверным увеличением частоты случаев впервые выявленного СД. Причем частота варьируется от 9 до 18% [28]. При этом риск СД, связанный с использованием статинов, может зависеть от дозы препарата, исходного статуса по СД (наличие МС, ожирения и т.д.) и химической природы статинов [29].
Риск развития СД на фоне приема ловастатина, симвастатина, аторвастатина и розувастатина был показан в крупных клинических исследованиях, результаты которых подвергались многократному анализу [28, 29]. Механизм влияния статинов на развитие СД описывает возможный негативный эффект как на секрецию инсулина бета-клетками, так и на чувствительность к нему периферических тканей, то есть через усиление патологической ИР [30]. Появление в клинической практике нового статина – питавастатина впервые прервало печальную статистику негативных побочных метаболических эффектов среди всего класса. Результаты исследований применения питавастатина у пациентов с СД показали отсутствие негативного влияния на контроль уровня глюкозы в крови, в то время как под воздействием других статинов гликемический контроль ухудшался [31]. К тому же у больных СД, получавших питавастатин, существенно увеличилось содержание АДН по сравнению с исходным – 2,81 ± 0,95 мкг/мл, через три месяца – до 3,84 ± 0,84 мкг/мл, через шесть месяцев – до 4,61 ± 1,15 мкг/мл (p < 0,001). Питавастатин не только снижает уровень общего холестерина (ХС) и ХС липопротеинов низкой плотности (ЛПНП), но и влияет на уровень АДН, предотвращая прогрессирование атеросклероза у пациентов с гиперлипидемией и сопутствующим СД [32].
Новый статин – новые возможности
Согласно последним данным клинических наблюдений, количество применяемых пациентами препаратов с возрастом увеличивается. Больные вынуждены применять по пять-шесть препаратов разных групп [33].
В исследование были включены 126 000 участников программы здравоохранения TRICARE Министерства обороны США в возрасте старше 65 лет. Женщины применяли достоверно больше препаратов, чем мужчины (р < 0,001). Пациентам пожилого возраста чаще выписывали препараты по поводу ССЗ. Больные, которым назначали сердечно-сосудистые средства, в целом применяли больше препаратов. Как и ожидалось, при увеличении количества препаратов имело место линейное повышение риска взаимодействия между ними. Следовательно, при выборе лекарственных средств для пациентов, которым показано комплексное лечение, необходимо учитывать вероятность взаимодействия между препаратами. В связи с этим препараты, отличающиеся низкой способностью к взаимодействию, должны стать средством выбора.
Учитывая, что гиполипидемическая терапия обычно является постоянным компонентом терапии и профилактики ССЗ, необходимо помнить, что идеальный статин для коморбидных пациентов или пациентов с высоким риском развития СД должен обладать свойствами, позволяющими одновременно улучшать профиль липидов и снижать общий риск ССЗ, не увеличивая при этом риск СД. С точки зрения безопасности идеальный гиполипидемический препарат также должен характеризоваться низким уровнем взаимодействия с другими лекарственными средствами, что особенно важно для коморбидных пациентов, которым показано комплексное лечение. Основные категории больных, которым назначают комплексное лечение:
- пациенты пожилого возраста (13–15% населения, потребители 30% всех назначаемых лекарственных средств);
- пациенты, страдающие ССЗ (ИБС, застойная сердечная недостаточность и др.);
- пациенты, у которых диагностированы сопутствующие заболевания, кроме ССЗ (например, хронические обструктивные заболевания легких);
- пациенты с СД;
- пациенты с множественными факторами риска;
- пациенты, занимающиеся самолечением (использующие препараты, отпускаемые без рецепта).
Подбирая идеальный статин пациенту, применяющему несколько лекарственных средств, врач должен учитывать ряд ключевых факторов:
- обоснованные клинические показания;
- высокую эффективность при минимальной дозе;
- влияние на весь профиль липидов;
- низкую способность к взаимодействию с другими препаратами;
- дополнительные клинически значимые свойства.
Питавастатин обладает всеми перечисленными характеристиками. Способность питавастатина снижать уровень ХС ЛПНП в крови общепризнана [34]. По данным систематического обзора и метаанализа, в которых сравнивали эффективность шести статинов, все препараты продемонстрировали терапевтическую эффективность в сопоставимых дозах [35]. Эффективность питавастатина зависит от дозы. При введении 2 или 4 мг питавастатина уровень ХС ЛПНП снижается более чем на 40% [34]. Действие питавастатина сопоставимо с таковым аторвастатина и розувастатина. Влияние препарата отмечается у значительной части пациентов, при этом уровень ХС ЛПНП в крови достигает целевого значения [36].
С клинической точки зрения сопоставимость эффективности питавастатина и аторвастатина, а также розувастатина представляет интерес при их назначении коморбидным пациентам. Для пациентов, которым проводят комплексное лечение, низкая способность к взаимодействию с другими лекарственными средствами является одним из важнейших свойств идеального статина. С учетом благоприятного метаболического профиля питавастатина, в частности отсутствия взаимодействия с цитохромом Р450 3А4, низкая способность препарата к взаимодействию с другими лекарственными средствами общепризнана [34]. Действительно, питавастатин можно считать статином с самым низким потенциалом взаимодействия с другими препаратами. Более того, питавастатин не оказывает клинически значимого влияния на многие препараты, которые назначают пациентам [37]. Благодаря низкому потенциалу взаимодействия при использовании питавастатина побочные реакции возникают реже, чем при применении других статинов [32–37].
Безопасность питавастатина дополнительно подтверждена в исследовании его эффективности и безопасности LIVES, в котором участвовали свыше 19 000 пациентов. Продолжительность наблюдения составила два года. На фоне приема питавастатина в сочетании с другими лекарственными средствами, которые часто назначают пациентам по поводу ССЗ и/или СД, отмечалось уменьшение риска развития неблагоприятных реакций. В отсутствие питавастатина в схеме лечения риск нежелательных реакций увеличивался. При использовании питавастатина не зафиксировано значимого взаимодействия с другими препаратами [38].
Идеальный статин, который применяют в комплексном лечении, должен не только благоприятно влиять на весь профиль липидов, но и обладать дополнительными (плейотропными) свойствами, имеющими значение с клинической точки зрения для конкретных групп пациентов (например, при почечной дисфункции, сердечной недостаточности и др.).
Результаты двухлетнего наблюдения (исследование LIVES) показали, что применение у пациентов с почечной дисфункцией питавастатина существенно (p < 0,001) увеличивало скорость клубочковой фильтрации по сравнению с исходной [39]. Аналогичный эффект отмечался у больных СД и почечной недостаточностью разной степени тяжести через 12 и 52 недели лечения с применением питавастатина [40]. Более того, на фоне применения 4 мг питавастатина наблюдалось улучшение функции почек, сравнимое с таковым при использовании аторвастатина в дозах 20 или 40 мг. Важность этого наблюдения очевидна, если учесть, что аторвастатин сегодня предпочитают в качестве наиболее эффективного нефропротективного статина.
Таким образом, в отличие от других статинов питавастатин не увеличивает риск развития ИР и СД, не вступает в реакцию с цитохромом Р450 3А4, вследствие чего вероятность взаимодействия препарата с другими достаточно мала. Питавастатин хорошо переносится и способствует улучшению функций сердечно-сосудистой системы и почек (снижению протеинурии и увеличению скорости клубочковой фильтрации), а также снижению риска ССЗ и контролю уровня липидов в крови.
V.N. Shishkova, L.A. Kapustina
Center for Speech Pathology and Neurorehabilitation
City Polyclinic № 69
Contact person: Veronika Nikolayevna Shishkova, veronika-1306@mail.ru
Here we discuss a pathogenetic link of developing metabolic disorders and most common cardiovascular diseases as well as assess an opportunity for their early screening. Advantages of using pitavastatin are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.