Нестероидные противовоспалительные препараты (НПВП) – наиболее широко используемые средства в лечебной практике. Частота их применения увеличивается с возрастом пациентов. НПВП, по разным данным, получают от 20 до 40% лиц пожилого возраста, причем 6% из них – более 9 месяцев в году или постоянно [1, 2].
Спектр нарушений, при которых используются НПВП, чрезвычайно широк. Наряду с ревматическими заболеваниями (ревматоидный артрит, анкилозирующий спондилит, подагра), он включает боли различного генеза (невралгии, миалгии, головную и зубную боль, боль при первичной дисменорее), а также ишемическую болезнь сердца. НПВП, в том числе ацетилсалициловая кислота, в настоящее время активно применяются для облегчения боли, уменьшения воспаления и снижения температуры тела [3]. Основные показания к применению НПВП, по данным Всемирной организации здравоохранения (ВОЗ, 1985), приведены в табл. 1.
Большое значение имеет прием в кардиологических дозах ацетилсалициловой кислоты, относящейся к группе неселективных НПВП. Низкие дозы используются обычно для первичной и вторичной профилактики сердечно-сосудистых и цереброваскулярных заболеваний [4].
Пациенты часто занимаются самолечением, выбирают препарат исходя из собственного опыта, советов знакомых или членов семьи, рекомендаций фармацевтов. Подобные действия нередко приводят к неправильному подбору терапии, высокому риску развития побочных и нежелательных явлений, осложнению течения заболеваний.
Как показывает зарубежная практика, пациенты самостоятельно применяют НПВП преимущественно для купирования приступов соматической и головной боли.
Чаще НПВП используют пожилые больные. Опрос лиц старше 65 лет показал, что 70% из них применяют данный вид терапии как минимум один раз в неделю, а 34% пациентов из общего числа принимающих НПВП – ежедневно.
Проблема заключается в том, что НПВП оказывают повреждающее воздействие на желудочно-кишечный тракт (ЖКТ). Обычно поражается слизистая оболочка желудка и двенадцатиперстной кишки. Для обозначения данной патологии используется термин «НПВП-гастропатия», или «лекарственно индуцированное поражение желудка» (рис. 1, 2).
Как показали результаты исследования, проведенного T.M. McDonald и соавт. в 1997 г. (участвовало 126 тыс. больных, период наблюдения составил 3 года), НПВП увеличивают риск тяжелого поражения желудка и двенадцатиперстной кишки в 3,9 раза, а кровотечения и перфорации – в 8 раз [5].
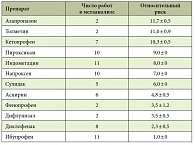
У больных разных групп была выявлена различная частота развития побочных эффектов. Факторами риска развития НПВП-гастропатии являются пожилой возраст, женский пол, язвенный анамнез, заболевания печени, сердечная и почечная недостаточность, злоупотребление алкоголем, прием лекарственных препаратов. Однако влияние и вклад каждого из факторов в развитие гастропатии различен (табл. 2) [6].
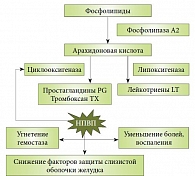
Действие НПВП основано на ингибировании фермента циклооксигеназы (ЦОГ), представленного в виде изоформ ЦОГ-1 и ЦОГ-2. Необходимый противовоспалительный эффект достигается за счет угнетения активности ЦОГ-2. Однако одновременное блокирование активности ЦОГ-1 приводит, с одной стороны, к снижению синтеза простагландинов и простациклина в слизистой оболочке желудка, а с другой – к уменьшению агрегации тромбоцитов за счет снижения синтеза тромбоксана. Функция простагландинов по отношению к гастродуоденальной слизистой оболочке является протективной. Соответственно снижаются защитные свойства слизистой и повышается риск кровотечения, связанный со снижением агрегации тромбоцитов. Именно эти процессы и признаны ведущими в развитии НПВП-гастропатии [7, 8].
НПВП оказывают на слизистую оболочку желудка как местное, так и системное воздействие. Пероральное применение препаратов в виде таблеток, не покрытых кишечнорастворимой оболочкой, приводит к более быстрому развитию поражения слизистых. Применение парентеральных или ректальных форм НПВП также сопровождается деструктивным действием на желудочно-кишечный тракт, но в более отдаленные сроки [9].
Пациентам свойственно стереотипное отношение к заболеваниям. Так, по результатам опросов, многие больные считают, что заболевание развивается под воздействием только одного повреждающего фактора – например, НПВП-гастропатия возникает исключительно вследствие медикаментозного воздействия. Между тем этиология заболеваний многофакторна. Не исключено одновременное воздействие нескольких факторов (стресс, нарушение режима питания, наличие рефлюкса и др.).
Результаты исследований последних лет однозначно не свидетельствуют о влиянии инфекции, вызванной Helicobacter pylori, на развитие НПВП-гастропатии. Поскольку частота инфицирования в популяции высока, трудно выделить группу пациентов, принимающих НПВП и являющихся негативными к хеликобактеру. После отмены препаратов клинические симптомы и изменения в слизистой оболочке желудка и двенадцатиперстной кишки обычно купируются, если они не ассоциированы с хеликобактерной инфекцией. Результаты ряда исследований демонстрируют результативность эрадикационной терапии у таких больных [10, 11].
Одна из особенностей клинической картины НПВП-гастропатии – бессимптомное течение. В ряде случаев возникают симптомы диспепсии, появляются тошнота, чувство тяжести и переполненности в эпигастрии, боли в верхней части живота и другие симптомы, типичные для поражения данного отдела ЖКТ [12].
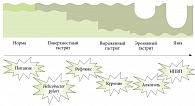
Морфологической особенностью является обширное точечное поражение слизистой оболочки, расположение дефектов преимущественно в области желудка. С клинической точки зрения выделяют 3 основных вида повреждения слизистой оболочки пищевода, желудка и двенадцатиперстной кишки: точечные кровоизлияния различной интенсивности, эрозии и язвы. Частота указанных поражений различна.
Диспепсические проявления диагностируются в 20–30% случаев, язва желудка – в 5–8%, язва двенадцатиперстной кишки – в 3–5%, осложнения язвенной болезни (кровотечение, перфорация) – в 1–1,5% случаев. На фоне продолжающегося приема НПВП гастродуоденальные изъязвления в 40% случаев осложняются кровотечением (рис. 3) [13].
Пациентам, длительно принимающим НПВП или планирующим длительный прием, следует провести эзофагогастродуоденоскопию (ЭГДС) до начала терапии и после ее окончания. Обследование необходимо проводить всем больным с высоким риском развития осложнений после приема данных препаратов, то есть с клиническими симптомами гастропатии, особенно при наличии эпигастральных болей, изжоги, тошноты, рвоты, анорексии и анемии [14, 15].
Таким образом, в программу стандартного обследования должны входить эндоскопические методы диагностики состояния слизистой верхних отделов ЖКТ, а также общий и биохимический анализы крови, исключающие наличие анемии и других дефицитных состояний.
В клинической практике имеет место иная ситуация. Пациент не информирует доктора о том, что принимает противовоспалительные препараты. Обычно больной приходит к врачу с проблемой либо для проведения обследования, сообщая доктору факты, по мнению пациента, имеющие отношение к заболеванию. По результатам медицинских социологических исследований, больные считают, что на состояние желудка влияют в основном антибактериальные и гормональные препараты, поэтому обычно не сообщают о приеме каких-либо других медикаментов врачу без дополнительных уточняющих вопросов.
При наличии диспепсических жалоб необходимо проведение дифференциальной диагностики. Если врач подробно собирает анамнез и уточняет перечень принимаемых на данный момент лекарственных препаратов, возникает предположение о роли лекарств в развитии поражения слизистой оболочки верхних отделов пищеварительной системы.
Возможна и другая ситуация, когда пациент уже прошел диагностические процедуры, в том числе эндоскопию. Заключение ЭГДС, в котором отмечены дефекты слизистой оболочки определенного отдела ЖКТ, позволяет предположить, что выявленные изменения индуцированы противовоспалительными препаратами. Здесь требуется обязательный сбор подробного лекарственного анамнеза и анализ прочих факторов (рис. 4).
Независимо от причины, вызвавшей поражения слизистой оболочки пищевода, желудка или двенадцатиперстной кишки, необходимо проведение противоязвенной терапии и определение дальнейшей тактики лечения.
Лечение НПВП-гастропатии – сложная задача, поскольку большинству больных не удается отменить прием НПВП из-за высокого риска обострения основного заболевания, по поводу которого пациент их получает.
По сути, поражение верхних отделов ЖКТ у больных, вынужденных продолжать прием НПВП, становится формой язвенной болезни. В подобной ситуации рецидивирующий характер НПВП-гастропатии определяет необходимость профилактики данной патологии в течение всего периода приема НПВП независимо от его длительности [16].
Решение о проведении профилактических мероприятий у больных следует принимать исходя из наличия названных выше факторов риска. При терапии НПВП важно тщательно выбирать препарат (табл. 3).
Принимать НПВП рекомендуется только после приема пищи. В период приема противовоспалительных средств пациент не должен употреблять алкоголь, резко повышающий частоту осложнений. Риск развития поражений желудка увеличивается также у курящих и лиц с язвенной болезнью в анамнезе.
У пациентов, принимающих несколько медикаментозных препаратов одновременно, врач должен оценивать возможность лекарственного взаимодействия и потенциального усиления ульцерогенного действия НПВП. Риск развития желудочно-кишечного кровотечения резко возрастает при одновременном приеме противовоспалительных препаратов и антикоагулянтов и/или глюкокортикостероидов. К другим средствам, повышающим риск развития НПВП-гастропатии, относятся хлорид калия, ингибиторы ангиотензинпревращающего фермента (АПФ), диуретики, гормоны щитовидной железы [17, 18].
Тактика ведения больных, у которых диагностируются гастродуоденальные осложнения или имеются факторы риска НПВП-гастропатии, включает два взаимосвязанных подхода: оптимизацию применения НПВП и противоязвенную терапию [19].
При появлении любых гастроэнтерологоческих побочных эффектов необходимо решить вопрос о целесообразности дальнейшего приема НПВП. В ряде случаев усиление этиотропной и патогенетической терапии основного заболевания позволяет ускорить достижение ремиссии и избежать назначения противовоспалительных препаратов. При приеме кардиологических дозировок ацетилсалициловой кислоты возможен перевод пациентов на терапию клопидогрелом с иным механизмом антиагрегантного действия. Если полностью отказаться от приема НПВП невозможно, надо максимально уменьшить дозу и проводить лечение под эндоскопическим контролем [20, 21].
Эффективным способом снижения риска поражения слизистых оболочек верхних отделов ЖКТ является использование НПВП с наименьшими побочными эффектами (ибупрофен, диклофенак), а также препаратов, обладающих более высокой селективностью в отношении ЦОГ-2 (мелоксикам, нимесулид).
С целью уменьшения частоты развития опасных осложнений был разработан новый класс НПВП – селективные ингибиторы ЦОГ-2. К ним относятся семейство коксибов (целекоксиб, рофекоксиб, эторикоксиб), мелоксикам, нимесулид и др. (табл. 4). В ходе крупных исследований, таких как MELISSA (Meloxicam Large-scale International Study Safety Assessment – Крупномасштабное международное исследование безопасности мелоксикама), CLASS (Celecoxib Long-term Arthritis Safety Study – Долгосрочное исследование безопасности целекоксиба при артрите), VIGOR, TARGET (Therapeutic Arthritis Research and Gastrointestinal Event Trial – Исследование терапии артрита и желудочно-кишечных осложнений), было подтверждено, что на фоне приема этих препаратов тяжелые осложнения (желудочно-кишечное кровотечение и перфорации язв) возникают значительно реже, чем при использовании традиционных неселективных НПВП. Однако считать их полностью безопасными нельзя [22].
Одним из методов профилактики НПВП-гастропатии является переход на использование селективных ингибиторов ЦОГ-2 для лечения основного заболевания у пациентов с высоким риском. Например, терапию артропатий различного генеза и болевого синдрома можно начинать с применения современных ингибиторов ЦОГ-2 [23].
Противоязвенная терапия признана стандартом лечения НПВП-гастропатии при выявлении повреждений слизистой оболочки верхних отделов ЖКТ. Установлено, что подавление кислотной продукции приводит к рубцеванию язв и эпителизации эрозий желудка даже у больных, продолжающих принимать НПВП.
Сегодня существует множество препаратов, снижающих секреторную активность. Наиболее эффективны при лечении гастродуоденальных язв и эрозий ингибиторы протонной помпы (ИПП) (уровень доказательности А). Проведен целый ряд международных клинических исследований по применению ИПП для профилактики развития лекарственных поражений желудка (NASA-1 2005, SPACE-1 2005, PLUTO 2006, VENUS 2006, NASA-2 2007, SPACE-2 2007, ASTERIX 2008 и др.). Общее число участников указанных исследований превышает 4600.
Согласно заключению международной группы экспертов, основой эффективности ИПП при повреждениях гастродуоденальной слизистой оболочки под действием НПВП является выраженное подавление желудочной секреции. То есть чем мощнее заблокирована секреция желудка, тем выше профилактический и лечебный эффект антисекреторного средства.
Для профилактики и лечения НПВП-гастропатии традиционно используют препараты ИПП в различных дозировках, которые являются самыми мощными блокаторами желудочной секреции. Они угнетают выработку желудочной секреции соляной кислоты до 100%. Известно, что пантопразол (Контролок®) – единственный из всех ИПП препарат, вызывающий не временную, а необратимую блокаду протонной помпы. Кислотность восстанавливается за счет синтеза новых протонных помп. Благодаря высокой биодоступности начиная с первого приема пантопразол быстро подавляет секрецию соляной кислоты. Например, в течение первых 3 суток лечения препаратом Контролок® (40 мг) отмечено более быстрое проявление действия и более выраженное снижение желудочной кислотной секреции по сравнению с омепразолом (20 мг) [24, 25].
Рекомендовано использовать современные ИПП в поддерживающей дозе 20–40 мг для длительной профилактики и 40–80 мг – для лечения НПВП-гастропатии.
Интересны результаты исследования D.N. Juurlink и соавт. (2009), показавшие, что у пациентов, получавших клопидогрел после острого инфаркта миокарда, сопутствующая терапия ИПП, за исключением терапии пантопразолом, сопровождалась уменьшением положительных эффектов клопидогрела и повышенным до 40% риском повторного инфаркта. В других исследованиях было установлено, что прием пантопразола не влияет на эффективность клопидогрела [26, 27].
За счет минимального среди всех препаратов данной группы лекарственного взаимодействия пантопразол (Контролок®) можно использовать совместно с НПВП, такими как диклофенак, пироксикам, напроксен, без риска нежелательного влияния на их метаболизм [28, 29].
Многие больные наряду с антисекреторными принимают и другие лекарственные средства. Наиболее существенными последствиями многокомпонентной терапии являются повышение риска развития побочных реакций и взаимодействие принимаемых препаратов.
При приеме двух препаратов потенциальный риск их взаимодействия составляет 6%, а при приеме пяти – 50%. Для предотвращения этих неблагоприятных последствий (независимо от количества одновременно принимаемых лекарств) предпочтительно принимать препарат, потенциально слабо взаимодействующий с другими медикаментами [30].
По сравнению с другими ИПП пантопразол благодаря специфичности I и II фаз биотрансформации в меньшей степени влияет на систему цитохрома Р-450. В частности, он угнетает систему цитохрома Р-450 меньше, чем омепразол или лансопразол [31– 33].
Пантопразол (Контролок®) длительно подавляет образование соляной кислоты (до 45 ч), что позволяет добиться снижения ее секреции в течение суток. Это обусловлено тем, что пантопразол связывается с цистеином (Цис) 822, погруженным в транспортный участок протонной помпы. Связывание именно с этой аминокислотой определяет самое длительное действие пантопразола по сравнению с другими ИПП. Это очень важно, поскольку восстановление продукции кислоты полностью зависит от самообновления белков протонной помпы (табл. 5) [34–37].
Пантопразол (Контролок®) – препарат, наиболее эффективный по механизму блокирования протонной помпы и имеющий минимальное лекарственное взаимодействие среди других препаратов этой группы. Его целесообразно включать в схемы профилактики и комплексную терапию НПВП-гастропатии.