Эффективность таргетной моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении острого гематогенного остеомиелита у иммунокомпрометированных детей
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить клинико-иммунологическую эффективность моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении острого гематогенного остеомиелита у детей.
Материал и методы. Проведено клинико-иммунологическое обследование детей в возрасте 8–15 лет с ОГО, в том числе с септико-пиемической формой. Оценивалась рецепторная, фагоцитарная и NADPH-оксидазная активность нейтрофильных гранулоцитов (НГ) до и после проведения разработанной моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении.
Результаты. Выявлены дисфункции НГ, наиболее выраженные при септико-пиемической форме ОГО, в частности дефекты рецепторной функции, проявляющиеся снижением содержания субпопуляции CD64-CD16+CD32+CD11b+НГ и повышением количества субпопуляции CD64+CD16+CD32+CD11b+НГ с негативно трансформированными фенотипами, что ассоциируется с нарушением эффекторных функций НГ. Разработаны дифференцированные программы иммунотерапии, демонстрирующие наиболее значимые позитивные клинико-иммунологические эффекты при использовании моноиммунотерапии гексапептидом (ГП) при нарушениях рецепторной и киллинговой функции НГ, а также при комбинированной иммунотерапии с использованием внутривенных иммуноглобулинов и ГП при сочетанных дисфункциях НГ, связанных с нарушением рецепторной функции и дефектами поглощения и переваривания, на фоне септико-пиемической формы ОГО.
Заключение. Патогенетически обоснованное и дифференцированное использование моно- и комбинированной иммунотерапии в комплексном этиопатогенетическом лечении ОГО способствует восстановлению нарушенных механизмов антибактериального иммунитета, в частности адекватного функционирования НГ, и, как следствие, своевременной элиминации патогенов, улучшению клинического течения заболевания.
Цель исследования – оценить клинико-иммунологическую эффективность моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении острого гематогенного остеомиелита у детей.
Материал и методы. Проведено клинико-иммунологическое обследование детей в возрасте 8–15 лет с ОГО, в том числе с септико-пиемической формой. Оценивалась рецепторная, фагоцитарная и NADPH-оксидазная активность нейтрофильных гранулоцитов (НГ) до и после проведения разработанной моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении.
Результаты. Выявлены дисфункции НГ, наиболее выраженные при септико-пиемической форме ОГО, в частности дефекты рецепторной функции, проявляющиеся снижением содержания субпопуляции CD64-CD16+CD32+CD11b+НГ и повышением количества субпопуляции CD64+CD16+CD32+CD11b+НГ с негативно трансформированными фенотипами, что ассоциируется с нарушением эффекторных функций НГ. Разработаны дифференцированные программы иммунотерапии, демонстрирующие наиболее значимые позитивные клинико-иммунологические эффекты при использовании моноиммунотерапии гексапептидом (ГП) при нарушениях рецепторной и киллинговой функции НГ, а также при комбинированной иммунотерапии с использованием внутривенных иммуноглобулинов и ГП при сочетанных дисфункциях НГ, связанных с нарушением рецепторной функции и дефектами поглощения и переваривания, на фоне септико-пиемической формы ОГО.
Заключение. Патогенетически обоснованное и дифференцированное использование моно- и комбинированной иммунотерапии в комплексном этиопатогенетическом лечении ОГО способствует восстановлению нарушенных механизмов антибактериального иммунитета, в частности адекватного функционирования НГ, и, как следствие, своевременной элиминации патогенов, улучшению клинического течения заболевания.





Введение
Гнойно-воспалительные заболевания у детей представляют серьезную медицинскую, экономическую и социальную проблему. По частоте встречаемости они занимают одно из лидирующих мест среди всех болезней детей, что во многом обусловлено возрастными анатомо-физиологическими особенностями детского организма, снижением сопротивляемости бактериальным инфекциям, его низкими компенсаторными возможностями. Гнойно-воспалительные заболевания практически не имеют тенденции к снижению, несмотря на расширение спектра используемых антибактериальных препаратов, улучшение стратегий лечебно-профилактических мероприятий [1, 2].
Серьезной проблемой здравоохранения во всем мире остаются трудно поддающиеся лечению глубокие инфекции, такие как остеомиелит [3, 4]. В структуре гнойно-септических заболеваний последствия острого гематогенного остеомиелита составляют 8,6–12,0%, а среди ортопедической патологии – 3–6% [3]. Распространенность остеомиелита среди детей Краснодарского края на 2016–2021 гг. составляла 15,4 случая на 100 тыс. населения, преобладающей формой был острый гематогенный остеомиелит (ОГО) – 63% [5], что соответствует результатам аналогичных эпидемиологических исследований в Германии, Швеции, США, Южной Корее [6–9].
Острый гематогенный остеомиелит – острый гнойно-воспалительный процесс костного мозга, кости и подлежащих мягких тканей различной этиологии. В детском возрасте течение ОГО сопровождается различными патологоанатомическими изменениями, приводящими к деформации пораженной кости c дальнейшей хронизацией процесса и инвалидизацией пациента [10]. Трудности при лечении ОГО у детей также связаны с развитием септических осложнений. Среди метастатических поражений внутренних органов первое место занимают поражения легочной ткани. По данным разных авторов, частота этих осложнений колеблется от 7,5 до 20%, летальность при них – от 26 до 50% [11]. Особую трудность представляет лечение детей с ОГО, протекающим нетипично, не поддающимся антибактериальной терапии, с высокой вероятностью возникновения антибиотикорезистентности, что связано с дефектами функционирования в системе нейтрофильных гранулоцитов (НГ), которые играют ведущую роль в иммунопатогенезе заболевания.
Эффекторные функции НГ находятся в прямой зависимости от экспрессии рецепторов CD16 (FcγRIII), CD32 (FcγRII), CD11b (Mac-1/CR3A), CD64 (FcγRI) на поверхностной мембране НГ, отвечающих за распознавание инфекционного агента, активацию НГ и запуск эффекторных микробицидных функций [12, 13]. В условиях нарушения работы мембранного рецепторного комплекса НГ наблюдаются недостаточность количественного их прироста в очаге воспаления, снижение числа активно фагоцитирующих клеток с киллинговой активностью, дефектность процессов захвата, неадекватное реагирование микробицидных систем, ассоциированных с дефектами активности NADPH-оксидаз, миелопероксидазы, нейтрофильной эластазы, катепсина G, дефенсинов и т.д. Такие дисфункции связаны с отсутствием или дефектами сигналов с мембранных функционально значимых рецепторов [14, 15].
В связи со сказанным ранее необходимым условием улучшения качества медицинской помощи таким пациентам является разработка новых способов лечения ОГО, включающих использование кроме традиционных методов лечения новых методов таргетной иммунотерапии с целью восстановления нормального функционирования НГ и формирования их адекватного иммунного ответа на гнойную бактериальную инфекцию.
Препаратами выбора для проведения иммунотерапии при тяжелых гнойно-септических заболеваниях являются внутривенные иммуноглобулины (ВВИГ), обогащенные антителами классов М и G, обладающие различными иммуномодулирующими свойствами: нейтрализацией и элиминацией микробных патогенов и бактериальных токсинов, активацией системы комплемента, усилением опсонизации и эффективности фагоцитоза НГ. Кроме того, ВВИГ обладают противовоспалительным действием за счет модуляции реакции воспаления, ингибирования провоспалительных цитокинов и стимуляции выработки их антагонистов [16, 17]. Установлены также позитивные клинико-иммунологические эффекты препарата Имунофан, активной субстанцией которого является гексапептид (ГП) – аргинил-α-аспартил-лизил-валил-тирозил-аргинин, являющегося синтетическим аналогом естественного гормона тимуса тимопоэтина, при различных гнойно-воспалительных заболеваниях [18]. Препарат оказывает иммунорегуляторное воздействие, связываясь с различными рецепторами на клетках иммунной системы и осуществляя запуск разных программ их функционирования, а также детоксикационное и гепатопротективное воздействие, обеспечивает инактивацию свободнорадикальных и перекисных соединений [19, 20]. ГП разрешен к применению у детей с двух лет в комплексной терапии острых и хронических инфекционно-воспалительных заболеваний, сопровождающихся вторичным иммунодефицитом, что и явилось основанием для его использования в данном исследовании как в монотерапии, так и в комбинации с ВВИГ.
Цель исследования
Цель – оценить клинико-иммунологическую эффективность моно- и комбинированной иммунотерапии в комплексном послеоперационном лечении острого гематогенного остеомиелита у детей.
Материал и методы
Наблюдали 20 детей с ОГО в возрасте от 8 до 15 лет, находившихся на стационарном лечении в ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
На основании клинических и лабораторных данных были сформированы две группы, отличающиеся тяжестью течения заболевания и объемом иммунотерапевтического воздействия.
Группа исследования 1 (ГИ1) – 12 иммунокомпрометированных детей, из них одна девочка и 11 мальчиков, с ОГО в первые сутки госпитализации, в последующем получавших в составе комплексного лечения в послеоперационном периоде моноиммунотерапию препаратом ГП, – группа исследования 1а (ГИ1а).
Группа исследования 2 (ГИ2) – восемь иммунокомпрометированных детей, из них две девочки и шесть мальчиков, с септико-пиемической формой ОГО в первые сутки госпитализации, в дальнейшем получавших в составе комплексного лечения в послеоперационном периоде комбинированную иммунотерапию ВВИГ и ГП, – группа исследования 2а (ГИ2а).
Группу сравнения (ГС) составили 13 условно здоровых детей.
Оценка клинико-иммунологического статуса в группах ГИ1 и ГИ2 проводилась при поступлении в стационар до оперативного вмешательства и до проведения иммунотерапии, а в группах ГИ1а и ГИ2а – через сутки после окончания курса иммунотерапии, перед выпиской из стационара.
Пациентам выполнялся следующий диагностический и лечебный комплекс: общий анализ крови, определение уровня С-реактивного белка (СРБ), иммунного статуса, пункция заинтересованных суставов, в том числе под ультразвуковым контролем, вскрытие параоссальных флегмон (при необходимости их дренирование) с последующим бактериологическим посевом отделяемого, иммобилизация пораженной конечности, инфузионная терапия, антибактериальная терапия курсами с учетом чувствительности к выделенным микроорганизмам, иммунотерапия.
Для оценки эффективности моно- и комбинированной иммунотерапии определяли содержание субпопуляций и фенотипа НГ – CD16+CD64-CD32+CD11b+НГ и CD16+CD64+CD32+CD11b+НГ на проточном цитометре Сytomics FC-500 (Веckman Coulter, США), фагоцитарную активность НГ с оценкой количества активно фагоцитирующих НГ (%ФАН), процессов захвата (ФЧ, ФИ) и степени завершенности фагоцитарного акта с оценкой переваривающей активности (%П, ИП) по отношению к Staphylococcus aureus (штамм № 209). В NBT-спонтанном тесте (NBTсп.) и в нагрузочном тесте в системе in vitro (NBTст.), позволяющем оценить функциональный эффекторный резерв НГ, рассчитывали средний цитохимический индекс и процент формазан-позитивных клеток (СЦИсп., %ФПКсп. и СЦИст., %ФПКст.), по соотношению %ФПК в стимулированном и спонтанном NBT-тестах – коэффициент мобилизации (КМ) – %ФПКcт./%ФПКсп. [21].
Проведенное исследование соответствовало стандартам Хельсинкской декларации, было одобрено независимым этическим комитетом ФГБОУ ВО КубГМУ Минздрава России.
Статистическую обработку полученных результатов проводили с использованием компьютерных программ Microsoft Exel 2016 и StatPlus 2010. Применяли методы непараметрической статистики – Me (Q1; Q3), U-критерий Манна – Уитни и Вилкоксона. Различия считали статистически значимыми при p < 0,05.
Результаты
При поступлении в стационар на четвертый (2,5–6,5) день от начала заболевания у пациентов ГИ1 имели место клинические признаки ОГО: острое начало после короткого продромального периода от нескольких часов или одного-двух дней, гипертермия до 39,7–40,0 °С, нарастающий интоксикационный синдром, боли распирающего характера в пораженной конечности, максимально выраженные над очагом воспаления, выраженная болевая контрактура и вынужденное положение конечности. Лабораторно отмечался высокий уровень СРБ – 60 (13–158) мг/л. Гнойно-воспалительный процесс локализовался в плечевых, локтевых и бедренных костях. До госпитализации только один пациент с ОГО принимал антибактериальный препарат (антибиотик из группы синтетических пенициллинов широкого спектра действия с ингибитором β-лактамаз).
У пациентов ГИ2 клинические проявления ОГО были более тяжелыми. На девятый (7–14) день от начала заболевания наблюдались гипертермия 38,0–38,5 °С, более выраженный интоксикационный сидром и нарушение кровообращения, проявляющееся снижением артериального давления, мраморностью кожных покровов и акроцианозом, а также респираторными нарушениями в виде нарастающей дыхательной недостаточности, сопровождающейся одышкой инспираторного характера. Септико-пиемическая форма ОГО отмечалась при следующих локализациях остеомиелитического процесса: бедренная кость, кости таза или комбинированное поражение костей таза и бедра. Уровень СРБ был резко повышен – 174 (114–207) мг/л. До госпитализации пять детей из ГИ2 принимали антибактериальные препараты (антибиотик из группы синтетических пенициллинов широкого спектра действия или цефалоспорин третьего поколения с ингибитором β-лактамаз).
Ввиду не всегда своевременной обращаемости пациентов, отсроченной постановки диагноза, недооценки тяжести состояния пациентов, неправильной маршрутизации на догоспитальном этапе сроки поступления в стационар после дебюта заболевания варьировались от двух до 16 суток, что приводило к ухудшению как местной картины в ГИ1 и ГИ2, так и общего состояния вплоть до прогрессирования неврологической симптоматики, гемодинамических нарушений и дыхательной недостаточности в ГИ2.
Анализ результатов общего количества лейкоцитов (L) и их морфологии в ГИ1 выявил неадекватный ответ на воспалительный процесс. Показатели лейкоцитов, лимфоцитов (ЛФ) и НГ не отличались от таковых в ГС (р1–3 > 0,05), однако отмечалось повышение содержания палочкоядерных форм (ПЯЛ) (р < 0,05) за счет снижения сегментоядерных форм (СЯЛ) (р < 0,05) (табл. 1).
В ГИ2 установлено повышение уровня лейкоцитов (р < 0,05), НГ с увеличением доли ПЯЛ (р1–2 < 0,05) на фоне снижения количества ЛФ (р < 0,05) (см. табл. 1).
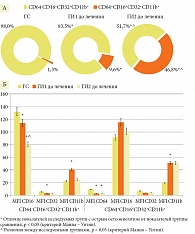
Обнаружены также общие для всех детей с ОГО дисфункции НГ. В ГИ1 выявлено снижение содержания основной субпопуляции НГ CD64-CD16+CD32+CD11b+ до 83,5 (73,1; 88,3) против 98,0 (96,9; 98,7)% в ГС (р < 0,05). Установлено уменьшение в 1,2 раза плотности экспрессии по MFI СD16-рецепторов (до 114,0 (99,4; 116,0) против 132,5 (120,5; 144,5) в ГС (р < 0,05)), в 1,9 раза плотности экспрессии по MFI СD32-рецепторов (до 3,0 (2,8; 3,4) против 5,7 (4,4; 6,2) в ГС (р < 0,05)) и повышение в 1,8 раза уровня CD11b-рецепторов (до 40,8 (33,1; 40,9) против 22,4 (20,9; 25,7) в ГС (p < 0,05)). Кроме того, показано увеличение в 7,4 раза содержания субпопуляции НГ CD64+CD16+CD32+CD11b+ (до 9,6 (6,7; 20,0) против 1,3 (0,4; 1,6) в ГС (p < 0,05)) cо сниженной в 3,2 раза концентрацией по MFI СD64 (до 2,9 (2,8; 4,1) против 9,3 (9,2; 9,6) в ГС (p < 0,05)) и повышенной в 2,6 раза концентрацией по MFI CD11b (до 51,0 (35,1; 54,0) против 19,8 (16,4; 26,9) в ГС (p < 0,05)) (рис. 1).
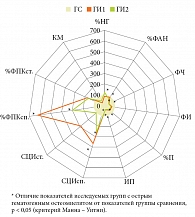
При этом в ГИ1 наблюдалось уменьшение количества активно фагоцитирующих НГ (%ФАН – 51,0 (42,8; 52,6) против 55,7 (54,0; 57,0) в ГС (р < 0,05)), нарушение функций захвата (ФЧ – 2,9 (2,7; 3,1) против 4,4 (3,8; 4,7) в ГС (р < 0,05)) и процессов киллинга (%П – 41,9 (37,8; 44,8), ИП – 0,6 (0,3; 0,7) против 62,6 (57,9; 62,9) и 1,6 (1,3; 1,9) в ГС соответственно (р1, 2 < 0,05)), обусловленных дефектами рецепторной функции НГ. В ГИ1 также зафиксирована активация NADPH-оксидаз: повышение %ФПКсп. – 12,5 (4,8; 21,0) против 2,0 (1,0; 3,7)% в ГС (р1, 2 < 0,05), СЦИсп. – 0,37 (0,12; 0,62) против 0,09 (0,06; 0,11) в ГС (р1, 2 < 0,05) без сохранения резервных возможностей при дополнительной антигенной нагрузке in vitro в NBT-стимулированном тесте (%ФПКст. – 7,5 (5,5; 14,0) против 4,3 (2,5; 10,0)% в ГС (р1, 2 < 0,05), СЦИст. – 0,46 (0,14; 0,75) против 0,16 (0,08; 0,29) в ГС (р1, 2 < 0,05)) (рис. 2).
В ГИ2 отмечались еще более глубокие нарушения функционирования НГ. Так, показано снижение в 1,9 раза по отношению к значениям ГС и в 1,6 раза по сравнению с ГИ1 (р1, 2 < 0,05) НГ субпопуляции CD64-CD16+CD32+CD11b+ – до 51,0 (32,8; 79,5)%. При этом значительно увеличилась доля НГ субпопуляции CD64+CD16+CD32+CD11b+ – до 46,8 (21,1; 63,1)%, что в 36 раз оказалось выше значений в ГС (p < 0,05) и в 4,9 раза – в ГИ1 (см. рис. 1А). Выявлены также изменения фенотипа: более выраженное снижение плотности экспрессии по MFI СD16-рецепторов – до 80,3 (46,3; 97,4), что было в 1,6 раза больше, чем в ГС (р < 0,05), и в 1,4 раза, чем в ГИ1 (р < 0,05), в субпопуляции CD64-CD16+CD32+CD11b+НГ и в 3,3 раза снижение плотности экспрессии по MFI CD64-рецепторов – до 2,83 (2,70; 3,10) против 9,30 (9,20; 9,60) в ГС (p < 0,05) в субпопуляции CD64+CD16+CD32+CD11b+НГ (см. рис. 1Б).
При оценке фагоцитарной функции в ГИ2 отмечено сокращение %ФАН в 1,4 раза по отношению к показателям ГС и в 1,2 раза по отношению к показателям ГИ1 – до 41,0 (39,8; 42,3)% (р1, 2 < 0,05), а также ФЧ, характеризующего процесс захвата S. aureus, в 2,3 раза по отношению к показателям ГС и 1,5 раза по отношению к показателям ГИ1 (р1, 2 < 0,05). Было также зафиксировано значительное уменьшение %П – до 37,9 (37,5; 42,4) против 62,6 (57,9; 62,9) в ГС (р < 0,05) и 41,9 (37,8; 44,8) в ГИ1 (p > 0,05) (см. рис. 2). При этом наблюдалось истощение микробицидной NADPH-оксидазной активности НГ, о чем свидетельствовали умеренно повышенные уровни %ФПКсп., СЦИсп. и отсутствие ответа на дополнительную антигенную нагрузку в NBTст.-тесте (см. рис. 2).
Разные по степени выраженности комбинированные дефекты функционирования НГ у детей с ОГО в ГИ1 и ГИ2 послужили основанием для разработки двух дифференцированных программ моно- и комбинированной иммунотерапии, нацеленных на коррекцию (рис. 3).
Дети в ГИ1 получали ГП в дозе 45 мкг/мл внутримышечно ежедневно в течение трех дней, далее – три дня через каждые 48 часов, затем четыре дня ежедневно, всего десять инъекций при курсовой дозе 450 мкг.
Дети в ГИ2 получали ВВИГ, обогащенные иммуноглобулином G (IgG), в дозе 0,4–0,8 г/кг массы тела со скоростью 8–10 капель/мин через инфузомат один раз в день, курс – три инфузии, и ГП 45 мкг/мл внутримышечно ежедневно в течение трех дней, далее – три раза через каждые 48 часов, затем четыре раза каждые 24 часа. Всего десять инъекций, курсовая доза – 450 мкг.
Применение ГП в комплексе со стандартным лечением сопровождалось позитивными клиническими эффектами и восстановлением иммунологических показателей, характеризующих функцию НГ.
Так, в ГИ1а отмечалось увеличение содержания основной субпопуляции CD64-CD16+CD32+CD11b+ и снижение субпопуляции CD64+CD16+CD32+CD11b+НГ до показателей ГС (p1, 2 < 0,05). В ГИ1 также наметилась выраженная тенденция к восстановлению трансформированного фенотипа в виде повышения по MFI CD16 (р > 0,05) и снижения по MFI CD11b (р > 0,05) в субпопуляции CD64-CD16+CD32+CD11b+НГ и повышения по MFI CD64 (р > 0,05) в субпопуляции CD64+CD16+CD32+CD11b+НГ (табл. 2).
После курса комплексного лечения с включением ГП в ГИ1а отмечено повышение в 1,3 раза %ФАН (р < 0,05), ФЧ – 3,9 (3,3; 4,4) против 2,9 (2,7; 3,1) (р < 0,05) и, что особенно важно, восстановление %П до показателей ГС – 58,8 (57,4; 60,6) против 41,9 (37,8; 44,8)% до лечения (р < 0,05) (табл. 3).
Кроме того, в ГИ1а на фоне терапии с включением ГП продемонстрировано адекватное повышение активности NADPH-оксидаз с восстановлением ответа на дополнительную антигенную нагрузку в NBT-стимулированном тесте (см. табл. 3).
В ГИ2а у находившихся на комплексной терапии с включением ВВИГ и ГП выявлено восстановление количественного баланса субпопуляций, отвечающих за эффекторные функции НГ, до показателей ГС (см. табл. 2).
Так, отмечено повышение в 1,9 раза доли основной субпопуляции НГ CD64-CD16+CD32+CD11b+ (до 97,6 (96,1; 98,5) против 51,7 (32,8; 72,5)% до лечения (р < 0,05)) за счет снижения доли субпопуляции НГ CD64+CD16+CD32+CD11b+ (до 1,7 (1,4; 3,3) против 46,8 (21,1; 63,1) до лечения (р < 0,05)). В субпопуляции CD64-CD16+CD32+CD11b+ наблюдалась нормализация плотности экспрессии по MFI CD16 и CD32 (р1, 2 < 0,05), сниженной до лечения, до значений ГС, а также тенденция к повышению MFI CD64 (p > 0,05) в субпопуляции CD64+CD16+CD32+CD11b+, при этом в обеих субпопуляциях сохранялся повышенный уровень по MFI CD11b (см. табл. 2).
Восстановление рецепторных функций НГ способствовало усилению фагоцитарной и микробицидных функций. Было показано увеличение в 1,5 раза %ФАН, в 1,9 раза ФЧ (до значений ГС (р1, 2 < 0,05)), в 1,2 раза %П, в 1,5 раза ИП (p1, 2 > 0,05) (по сравнению с показателями до лечения). При этом отмечалось восстановление микробицидной функции НГ как в спонтанном, так и в стимулированном NBT-тестах (см. табл. 2)
Включение программ моно- и комбинированной иммунотерапии в комплексное послеоперационное лечение детей с ОГО и септико-пиемическими формами ОГО способствовало восстановлению иммунологических показателей и улучшению клинического течения патологии. Так, в ГИ1а после курса комплексной терапии с включением иммуномодулирующей терапии ГП нормализация температурной реакции наблюдалась на четвертые – восьмые сутки, в ГИ2а после комплексной послеоперационной терапии с добавлением комбинированной терапии с использованием ВВИГ и ГП – на 5–28-е сутки (табл. 4).
Местный гнойно-воспалительный процесс (отек, гиперемия, отделяемое из послеоперационной раны) у пациентов в ГИ1а купировался на 6–13-е сутки, в ГИ2а – на 24–28-е. Восстановление функции в пораженной конечности у детей ГИ1а наблюдалось на 8–14-е сутки, в ГИ2а – на 26–40-е. В зависимости от сроков поступления в стационар, степени тяжести заболевания, локализации основного процесса дети ГИ1а находились на стационарном лечении от 11 до 20 суток, дети ГИ2а – от 26 до 41 суток, что связано с купированием септических проявлений заболевания, а именно с регрессом дыхательной недостаточности, гемодинамических нарушений и неврологической симптоматики. В ГИ1а у детей отсутствовали ранние послеоперационные осложнения, в ГИ2а у двух пациентов наблюдались параоссальные флегмоны. В обеих группах летальность составила 0%.
Обсуждение
Получены данные о существовании до начала заболевания иммунной недостаточности, ставшей причиной возникновения и прогрессирования очага поражения в костной ткани при хроническом остеомиелите [22]. Ранее у детей с ОГО нами были выявлены общие дисфункции клеточного звена иммунной системы: снижение количества Т-лимфоцитов с параллельным уменьшением доли Т-хелперов и цитотоксических Т-лимфоцитов, NK-клеток на фоне неменяющегося содержания В-лимфоцитов. Установлено также, что при ОГО уровень иммуноглобулинов основных классов не меняется и не отличается от показателей условно здоровых детей или снижен [23], что свидетельствует о нарушении антибактериального иммунитета. Полученные данные отчасти совпадают с тенденциями, отмечаемыми другими авторами у детей с ОГО других возрастных групп [24, 25].
Результаты настоящего исследования позволили выявить дисфункцию НГ, наиболее выраженную при септико-пиемической форме ОГО, в частности дефекты рецепторной функции, проявляющиеся снижением содержания субпопуляции CD64-CD16+CD32+CD11b+НГ и повышением содержания субпопуляции CD64+CD16+CD32+CD11b+НГ с негативно трансформированными фенотипами, что ассоциируется с нарушением эффекторных функций НГ.
С учетом иммунопатогенеза ОГО нами были разработаны дифференцированные программы иммунотерапии, демонстрирующие наиболее значимые позитивные клинико-иммунологические эффекты при использовании моноиммунотерапии ГП при нарушениях рецепторной и киллинговой функции НГ, при комбинированной иммунотерапии с использованием ВВИГ и ГП при сочетанных дисфункциях НГ, связанных с нарушением рецепторной функции и дефектами поглощения и переваривания, на фоне септико-пиемической формы ОГО. Данный подход отражает таргетное иммуномодулирующее влияние на дефектно функционирующие НГ и способствует коррекции выявленных нарушений, а также более быстрой регенерации тканей, поврежденных остеомиелитическим процессом, что оптимизирует лечение больных с ОГО.
Заключение
Получены позитивные клинико-иммунологические эффекты иммунотерапии в комплексном послеоперационном лечении детей с ОГО, демонстрирующие целесообразность использования иммуномодулирующей таргетной терапии для коррекции дефектного функционирования НГ – моноиммунотерапии Имунофаном, а при развитии септико-пиемической формы ОГО и выраженной дисфункции НГ – комбинированной иммунотерапии с включением ВВИГ и Имунофана. Патогенетически обоснованное использование иммунотропных препаратов в комплексном этиопатогенетическом лечении ОГО способствует восстановлению нарушенных механизмов антибактериального иммунитета и, как следствие, своевременной элиминации патогенов, улучшению клинического течения заболевания, а также будет препятствовать хронизации воспалительного процесса и усугублению дисфункции НГ.
Финансирование
Исследование выполнено в рамках государственного задания Министерства здравоохранения Российской Федерации № 121031000071-4.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
I.V. Nesterova, MD, PhD, Prof., G.A. Chudilova, DBS, E.A. Chicherev, S.V. Kovaleva, MD, PhD, V.N. Chapurina, PhD, L.V. Lomtatidze, PhD, N.K. Barova, PhD, Yu.V. Teterin
Kuban State Medical University
Patrice Lumumba Peoples' Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Acute hematogenous osteomyelitis (AHO) remains a serious health problem worldwide, and therefore the development of new treatment methods is urgent.
Purpose of the study – to evaluate the clinical and immunological effectiveness of mono- and combined immunotherapy in the postoperative complex treatment of acute hematogenous osteomyelitis in children.
Material and methods. A clinical and immunological study of children with AHO aged 8–15 years, including those with the septicopyemic form, was carried out. The receptor, phagocytic and NADPH oxidase activity of neutrophil granulocytes (NG) was assessed before and after the developed mono- and combination immunotherapy in complex postoperative treatment.
Results. The results of the study made it possible to identify NG dysfunctions, which are most pronounced in the septicopyemic form of AHO, in particular, defects in receptor function, manifested by a decrease in the content of the subpopulation CD64-CD16+CD32+CD11b+NG and an increase in the number of CD64+CD16+CD32+CD11b+NG with negatively transformed phenotypes, which are associated with impaired NG effector functions. Differentiated immunotherapy programs have been developed that demonstrate the most significant positive clinical and immunological effects when using monoimmunotherapy with hexapeptide (HP) for disorders of the receptor and killing functions of NG, and combined immunotherapy using intravenous immunoglobulins and HP for combined dysfunctions of NG associated with impaired receptor function and defects in absorption and digestion, against the background of the septic-pyemic form of AHO.
Conclusion. The pathogenetically substantiated and differentiated use of mono- and combined immunotherapy in the complex etiopathogenetic treatment of AHO contributes to the restoration of impaired mechanisms of antibacterial immunity, in particular the adequate functioning of NG, and, as a consequence, the timely elimination of pathogens and improvement of the clinical course of diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.