Разработка электрохимического аптасенсора для выявления возбудителя коронавирусной инфекции
- Аннотация
- Статья
- Ссылки
- English
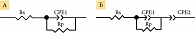





Введение
Вирус SARS-CoV-2, индуцировавший пандемию COVID-19, эволюционировал в сторону менее смертельно опасных для человека, но более контагиозных и угрожающих здоровью штаммов [1]. Создание эффективных средств раннего выявления вируса остается актуальным, а полученные при этом знания и опыт могут быть использованы для разработки новых препаратов, приборов и методов борьбы с иными вирусными инфекциями. Одними из наиболее перспективных и чувствительных методов диагностики, в том числе вирусных инфекций, являются электрохимические методы [2, 3]. Электрохимические сенсоры обладают рядом преимуществ перед традиционными аналитическими методами, включая высокую селективность, чувствительность, надежность, простоту эксплуатации, кратковременность измерения, портативность, низкую стоимость и т.д. [4].
Сенсоры, состоящие из аптамеров в качестве элемента распознавания, называются аптасенсорами. Аптамеры – одноцепочечные ДНК/РНК-олигонуклеотиды, которые отбираются путем систематической эволюции лигандов за счет экспоненциального обогащения (SELEX) in vitro [5]. Аптамеры обладают высокой специфичностью и сродством к широкому спектру веществ-мишеней, включая ионы металлов, биологические малые молекулы, белки, экзосомы, клетки и патогенные микроорганизмы [6]. Таким образом, они представляют собой многообещающий альтернативный элемент биомолекулярного распознавания. Уникальные особенности аптамеров, в том числе простой синтез, мультиплексированная функционализация и высокая стабильность, способствуют их широкому применению в области аналитической химии. Электрохимические аптасенсоры обеспечивают высокую чувствительность, специфичность и скорость отклика. Они просты, надежны и имеют относительно низкую стоимость [7]. Принцип их функционирования обусловлен изменением тока, импеданса или потенциала в ответ на событие распознавания на преобразователе датчика [8].
В рамках борьбы с новой коронавирусной инфекцией получено большое число аптамеров, специфичных к их двум важным структурным белкам – белку шипа (S) и белку нуклеокапсида (N), потенциально пригодных для разработки диагностических тестов [9, 10].
В работе исследованы перспективы получения электрохимических аптасенсоров и их применения в сочетании с методом спектроскопии электрохимического импеданса (СЭИ) для индикации SARS-CoV-2 в биологических пробах. При создании аптасенсора был использован аптамер Apt31, состоящий из 31 нуклеотида, способный блокировать рецептор-связывающий домен (RBD) шиповидного белка коронавируса [10].
Материал и методы
Подготовка рабочих электродов
Подготовка рабочих золотых электродов включала в себя механическую и электрохимическую обработку поверхности. Вначале электроды шлифовали корундовой абразивной пастой, разведенной небольшим количеством воды, затем промывали раствором поверхностно-активного вещества и дистиллированной водой для удаления пасты с поверхности электродов. После этого электроды обрабатывали ультразвуком в спирте в течение десяти минут. Для травления поверхности электроды помещали в свежеприготовленный раствор H2SO4:Н2O2 (3:1) на пять минут, далее промывали и сушили в токе азота. Для электрохимической обработки использовали электрохимическую станцию CHI-660D (CH Instruments, США). Рабочий электрод, вспомогательный платиновый электрод и электрод сравнения Ag/AgCl (1 М KCl) помещали в ячейку с фосфатным буфером (рН 7,4), после чего проводили циклирование до постоянного сигнала в диапазоне потенциала от 0,8 до -1,4 В. Затем проводили электрохимическую обработку при выдерживании постоянного потенциала, снимали данные с чистых электродов и повторяли электрохимическую обработку.
Подготовка аптасенсора
Аптамер Apt31 (5’-CGGATGGAAT TTTG TTC GTTG ATTCCATCCG-3’), использованный для создания аптасенсора, разработанный методом in silico, подробно описан V. Mironov и соавт. [10]. Для связывания аптамера Apt31 с золотой поверхностью электрода использовали метод хемосорбции, который заключался в прямой иммобилизации аптамера, модифицированного тиоловой группой, на поверхность электрода. Такой метод позволял формировать прочные ковалентные связи (около 50 ккал/моль) между атомами серы и золота, в результате чего образовывался стабильный и гибкий самособирающийся монослой с повторяющимися аптамерами. Связывание аптамера с золотой поверхностью рабочего электрода проводили сразу после электрохимической обработки, для чего на электрод помещали 20 мкл аптамера Apt31 (1 мкМ). Электрод помещали в чашку Петри с влажной атмосферой, герметично закрывали и выдерживали при 4 °С в течение 12 часов. Перед формированием монослоя конформацию аптамеров Apt31 обязательно восстанавливали. Для этого аптамеры в течение десяти минут нагревали при температуре 95 °С, затем сразу охлаждали на льду в течение пяти минут.
Подготовка экспериментальных биологических образцов
В качестве биологического материала для определения возбудителей COVID-19 использовали клинические образцы, представляющие собой лизированные мазки со слизистой оболочки ротоглотки здоровых людей и больных с подтвержденным диагнозом (ПЦР-исследование) COVID-19 (30 образцов). Образцы исследовали на базе Университетской клиники семейной медицины Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого (руководитель – доцент Д.С. Каскаева). До использования клинические образцы хранили при температуре -20 °С. Перед началом эксперимента исследуемые пробы выдерживали при комнатной температуре в течение 30 минут. 0,003%-ный раствор альбумина готовили из раствора для инфузий (ГБУЗ СО «ССПК», Россия).
Электрохимические методы исследований
Для оценки качества подготовки золотой поверхности электрода – чистоты, стабильности, воспроизводимости, повторяемости и мониторинга иммобилизации аптамеров на поверхности электрода использовали метод циклической вольтамперометрии. В качестве метода диагностики использовали СЭИ, поскольку этот метод позволяет проводить безметочное высокочувствительное обнаружение малых концентраций биоаналитов и обеспечивает возможность миниатюризации аптасенсора [11].
Процедура электрохимического анализа
Электрохимические измерения и электрохимическую обработку электродов выполняли в трехэлектродной ячейке, включающей рабочий электрод (золотой дисковый электрод диаметром 2 мм, CH Instruments, США), вспомогательный электрод (платиновая проволока) и электрод сравнения (хлорид-серебряный электрод с 1 М KCl) (ООО «НПП «Томьаналит», Россия) с помощью электрохимической станции CH-600D (CH Instruments, США). Фоновым электролитом в исследовании служил фосфатный буфер (PBS) c pH 7,4 (VWR Life Science AMRESCO, США), в качестве раствора редокс-медиатора использовали 0,025 М раствор гексацианоферратов (II и III) калия (квалификация «хч», ООО «Гранхим», Россия) в фосфатном буфере. Анализ методом СЭИ начинали с предварительной 30-минутной дегазации растворов фосфатного буфера и гексацианоферрата калия (ГЦФ). Перед каждым измерением дегазацию повторяли (5–10 минут).
Измерения проводили в два этапа. На первом этапе снимали данные с аптасенсора, на втором – данные с аптасенсора после нанесения экспериментального образца и его инкубации в течение 30 минут для связывания вирусного белка с аптамерами на поверхности аптасенсора. Кроме того, для исключения мешающего влияния других компонентов пробы проводились измерения с раствором человеческого альбумина (ГБУЗ СО «Свердловская станция переливания крови», Россия) (искусственная слюна). Данные СЭИ снимали при потенциале разомкнутой цепи (для съемок в фоновом электролите фосфатного буфера) и при потенциале превращения редокс-пары (для съемок в растворе ГЦФ) с амплитудой 10 мВ и с изменением частоты в диапазоне 1–100000 Гц.
Построение эквивалентных схем
Для построения графиков в координатах Найквиста использовали программу Origin. Анализ данных СЭИ проводили путем построения эквивалентных схем и статистической обработки полученных данных с целью поиска наиболее оптимального электрохимического параметра, позволяющего отделить сигналы COVID-19(+)- и COVID-19(-)-проб.
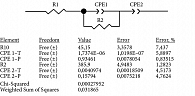
Моделирование эквивалентных схем проводили с помощью программы ZView 3.5g (Scribner Associates) [12]. Процесс моделирования начинали с подбора базовых элементов эквивалентных схем, после чего результаты вычислительного моделирования сопоставляли с результатами экспериментальных исследований. Точность полученной модели оценивали по совпадению экспериментальных графиков с fitting-графиками, построенными программой, исходя из предполагаемой эквивалентной схемы, а также с помощью критерия chi-squared, который должен превышать 10–4, и ошибки Error, процентное содержание которой не должно превышать 30%. Величины базовых параметров результатов моделирования заносили в таблицы для статистической обработки. Для анализа использовали абсолютные величины параметров, их разности и величины прироста значений после контакта аптасенсора с пробой (рис. 1).
Разность значений параметров рассчитывали по формуле:
ΔPi = (Pis - Pia) (1),
где Pi – параметр, полученный при моделировании
экспериментальных данных;
Psi – значение этого параметра для аптасенсора после контакта с пробой;
Pai – значение этого параметра для аптасенсора до контакта с пробой.
Прирост параметра рассчитывали по формуле в процентах:
Величина прироста параметра могла быть положительной (значение параметра увеличивалось) или отрицательной (значение параметра уменьшалось).
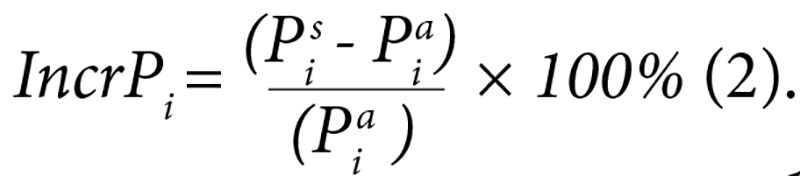
Статистические методы исследований
Достоверность отличий между параметрами оценивали по критерию Стьюдента, Q-критерию [13] или U-критерию Манна – Уитни [14] в зависимости от величины выборки.
Результаты и обсуждение
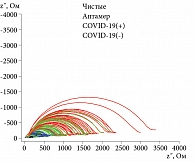
Для выбора условий электрохимического анализа использовали сравнение диаграмм Найквиста, полученных для COVID-19(+)- и COVID-19(-)-проб в растворах PBS и ГЦФ. Результаты импеданс-спектроскопии на комплексной плоскости представляли собой множество точек, каждая из которых соответствовала значению импеданса, измеренного при разных частотах – годограф импеданса. Анализ диаграмм Найквиста показал, что наиболее подходящим для измерения электрохимического сигнала является раствор гексацианоферрата калия, при котором сопротивление переноса электрона через границу «электрод – раствор» у образцов COVID-19(+) в целом оказался выше, чем у образцов COVID-19(-) (рис. 2).
Для анализа экспериментальных данных электрохимического импеданса (диаграмм Найквиста) использовали программное обеспечение ZView 3.5g, с помощью которого были построены две модели эквивалентных схем, одна из которых позволила описать процессы, происходящие при съемке электрохимического сигнала в фоновом растворе фосфатного буфера, другая – в растворе редокс-медиатора гексацианоферрата калия (рис. 3).
Эквивалентные электрические схемы представляют собой электрические схемы, в которых все влияющие на расчет элементы заменены на их идеальные эквиваленты, а все не влияющие элементы и факторы исключены. Такие схемы являются идеальным приближением реальной схемы для рассматриваемого режима работы. Данные, полученные из эквивалентных схем с помощью моделирования, обрабатывали статистически, чтобы отбросить выпадающие результаты. После этого сравнивали параметры COVID-19(+)- и COVID-19(-)-проб. Путем сопоставления экспериментальных данных и данных, полученных за счет моделирования, были выбраны две наиболее важные компоненты эквивалентных схем – сопротивление переноса электрона (Rp) и емкостный элемент (CPE).
Емкостный элемент СРЕ описывается двумя параметрами – безразмерным CPE-P и CPE-T с размерностью Ом–1 × сα. CPE-P позволяет заключить, можно ли связать параметр CPE-T с величиной двойного электрического слоя [15]. Полученные в данной работе значения для CPE-P (таблица) показали, что все значения CPE1-T истинно емкостные.
Значения CPE2-P продемонстрировали сложную природу второго компонента CPE. Поэтому при обсуждении и графическом представлении экспериментальных данных, направленных на выбор методов и параметров, позволяющих уверенно различать их значения между COVID-19(+)- и COVID-19(-)-пробами, были выбраны параметры Rp и CPE1-T. Кроме того, для анализа использовались относительные значения параметров эквивалентной схемы, такие как изменение (Δ) и прирост (Incr) параметра после контакта аптасенсора с пробой. Стоит отметить, что наиболее информативным оказался анализ параметров СЭИ, полученный при использовании раствора ГЦФ (рис. 4).
Абсолютные значения показателя СPE1-T не позволяют различить электрохимические сигналы от COVID-19(+)- и COVID-19(-)-проб (рис. 4Б), тогда как значения Rp (рис. 4А) COVID-19(+)- и COVID-19(-)-проб лежат в практически неперекрывающихся областях. Диапазон сопротивления для COVID-19(+)-проб изменялся в пределах 996,3–1437 Ом, а для COVID-19(-) – в пределах 643,8–958,4 Ом. U-критерий Манна – Уитни показал, что полученные различия между выборками достоверны. Следовательно, величина сопротивления переноса электрона Rp на границе раздела «электрод – раствор» позволяет отделить COVID-19(+)-пробы от COVID-19(-)-проб.
Следующими параметрами электрохимических сигналов, включенными в анализ возможных для использования параметров для выявления возбудителей коронавирусной инфекции, стали параметры разности значений (Δ) (рис. 5). Приведенные на рис. 5 результаты демонстрируют возможность выявления возбудителей коронавирусной инфекции как с помощью ΔRp, так и с помощью ΔCPE1-T. Диапазон изменения ΔRp для COVID-19(-) составил 446,4–728,4 Ом, а для COVID-19(+) – 688,1–2529,8 Ом. ΔCPE1-T для COVID-19(-) находился в диапазоне от -8,13 × 107 до 8,53 × 107 Ом, а для COVID-19(+)-проб – в пределах (8,55–12,9) × 107 Ом. U-критерий Манна – Уитни подтвердил достоверность различий ΔRp и ΔCPE1-T между COVID-19(+)- и COVID-19(-)-пробами.
Кроме разности параметров рассчитывали прирост (Incr) параметра – относительное изменение величины параметра после контакта аптасенсора с пробой (%). Можно отметить, что прирост сопротивления переноса электрона Incr Rp в обоих электролитах значимо различался для COVID-19(+)- и COVID-19(-)-проб (рис. 6).
Приросты для параметров Incr CPE1-T дали худшие результаты и не позволили идентифицировать COVID-19(+)-пробы (рис. 7).
В целом результаты анализа экспериментальных данных продемонстрировали, что относительные значения величин сопротивления и емкостной компоненты могут быть потенциально использованы для выявления возбудителей COVID-19 с использованием жидкостной биопсии. Самыми информативными оказались параметры ΔRp и ΔCPE1-T в растворе редокс-медиатора, а также Incr Rp в обоих растворах.
С целью проверки установленных нами закономерностей в изменении параметров был проведен эксперимент с зашифрованными пробами. Он заключался в измерении и расчете относительных величин параметров для зашифрованных проб с последующим сопоставлением полученных данных с установленными ранее диапазонами значений для отрицательных и положительных проб. Зашифровка проб состояла в присвоении номера (шифра) уже известной по своему статусу пробе с целью приближения эксперимента к реальной задаче. Исследования выполнялись в растворе редокс-медиатора. По значению разности СPE1-T и прироста Rp верно были определены четыре пробы из пяти, что говорит о принципиальной возможности использования данных параметров для диагностики COVID-19 методом СЭИ с применением электрохимического аптасенсора на основе аптамера Apt31.
Заключение
Результаты исследований показали, что, исходя из способов подготовки и контроля качества электрохимических аптасенсоров на основе аптамера Apt31, иммобилизованного на поверхности золотого рабочего электрода трехэлектродной электрохимической ячейки, могут быть разработаны:
- метод получения электрохимических аптасенсоров на основе золотых электродов, функционализированных тиолированными аптамерами;
- методы циклической вольтамперометрии для подготовки и контроля качества биосенсорного слоя.
Согласно данным, полученным при исследовании 30 образцов COVID-19(+) и COVID-19(-) пациентов, метод СЭИ позволяет находить в образцах жидкостной биопсии белок RBD, характерный для возбудителя коронавирусной инфекции. В работе определены эквивалентные схемы и установлено, что показатели сопротивления переноса электрона и емкостной компоненты являются наиболее информативными и могут быть использованы для разработки метода выявления возбудителей коронавирусной инфекции.
Исходя из полученных результатов, установлено, что:
- наиболее явное и достоверное различие между COVID-19(+)- и COVID-19(-)-пробами возможно при использовании параметров разности емкостной компоненты (∆СPE1-T) и прироста сопротивления переноса заряда (Incr Rp) при измерении показаний методами СЭИ в растворе редокс-медиатора ГЦФ;
- человеческий альбумин, присутствующий в соскобах слизистой ротоглотки, в предложенном подходе практически не влияет на результаты измерений;
- количество выпадающих результатов существенно снижается при переходе от абсолютных значений параметров (Rp и СPE) к относительным.
Таким образом, показана принципиальная возможность использования аптасенсора на основе тиолированного аптамера Apt31, иммобилизованного на золотом электроде, и метода спектроскопии электрохимического импеданса выявления возбудителей коронавирусной инфекции.
Благодарности.
Исследование выполнено при финансовой поддержке Краевого государственного автономного учреждения «Красноярский краевой фонд поддержки научной и научно-технической деятельности», конкурс научно-технических и инновационных проектов в интересах первого климатического научно-образовательного центра мирового уровня «Енисейская Сибирь», грант «Создание электрохимического аптасенсора для диагностики инфекционных и онкологических заболеваний» № 2023091509842 и при поддержке компании-партнера АО «НПП «Радиосвязь».
Ye.A. Bolshevich, A.V. Shabalina, M.M. Petrova, S.S. Zamay, T.N. Zamay, V.A. Svetlichny, R.A. Zukov, A.S. Kichkaylo, O.S. Kolovskaya
National Research Tomsk State University
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
Krasnoyarsk Scientific Center of the Siberian Branch of the Russian Academy of Sciences
Contact person: Olga S. Kolovskaya, olga.kolovskaya@gmail.com
Investigated the prospects of obtaining electrochemical aptasensors and their application in combination with the method of electrochemical impedance spectroscopy for the indication of SARS-CoV-2 in biological samples. The method of electrochemical impedance spectroscopy makes it possible to find RBD protein specifice for coronavirus infection pathogene in liquid biopsy samples. Equivalent schemes were determined and it was found that the indicators of electron transfer resistance and the capacitive component are the most informative and can be used to develop a method for detecting pathogens of coronavirus infection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.