Состояние микробиоценоза толстого кишечника у пациентов с COVID-19 средней степени тяжести
- Аннотация
- Статья
- Ссылки
- English
Микробиоценоз толстого кишечника – важная составляющая здоровья человека, влияющая на его иммунитет и общее самочувствие.
Цель – провести количественную оценку состояния микробиоценоза толстого кишечника у пациентов с COVID-19 средней степени тяжести.
Материал и методы. В 2022–2023 гг. в московском стационаре под наблюдением находились 64 пациента с COVID-19 средней степени тяжести (27 (42%) женщин и 37 (58%) мужчин, медиана возраста – 59 [18; 75] лет). Основные жалобы – лихорадка, кашель, слабость, боль и першение в горле, ринит. Всем пациентам выполнены общепринятые исследования согласно Временным методическим рекомендациям «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 17), а также проанализирован состав микробиоты кишечника методом полимеразной цепной реакции.
Результаты. Выявлены дисбиотические нарушения толстого кишечника: уменьшение численности представителей нормальной микрофлоры кишечника Bifidobacterium spp., Bacteroides spp. и Faecalibacterium prausnitzii, увеличение условно-патогенных микроорганизмов Klebsiella sp., Citrobacter spp., Enterobacter spp., Proteus vulgaris/mirabilis и патогенных бактерий Escherichia coli enteropathogenic, Candida spp., Staphylococcus aureus, Clostridium sp., Fusobacterium nucleatum. Примерно одинаковые средние значения индексов Шеннона и Симпсона как в острой фазе заболевания, так и на этапе реконвалесценции свидетельствовали о снижении кишечного разнообразия. Установлена взаимосвязь между составом кишечной микробиоты и клиническим течением COVID-19.
Заключение. Результаты исследования указывают на серьезные нарушения микробиоценоза у пациентов с COVID-19.
Микробиоценоз толстого кишечника – важная составляющая здоровья человека, влияющая на его иммунитет и общее самочувствие.
Цель – провести количественную оценку состояния микробиоценоза толстого кишечника у пациентов с COVID-19 средней степени тяжести.
Материал и методы. В 2022–2023 гг. в московском стационаре под наблюдением находились 64 пациента с COVID-19 средней степени тяжести (27 (42%) женщин и 37 (58%) мужчин, медиана возраста – 59 [18; 75] лет). Основные жалобы – лихорадка, кашель, слабость, боль и першение в горле, ринит. Всем пациентам выполнены общепринятые исследования согласно Временным методическим рекомендациям «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 17), а также проанализирован состав микробиоты кишечника методом полимеразной цепной реакции.
Результаты. Выявлены дисбиотические нарушения толстого кишечника: уменьшение численности представителей нормальной микрофлоры кишечника Bifidobacterium spp., Bacteroides spp. и Faecalibacterium prausnitzii, увеличение условно-патогенных микроорганизмов Klebsiella sp., Citrobacter spp., Enterobacter spp., Proteus vulgaris/mirabilis и патогенных бактерий Escherichia coli enteropathogenic, Candida spp., Staphylococcus aureus, Clostridium sp., Fusobacterium nucleatum. Примерно одинаковые средние значения индексов Шеннона и Симпсона как в острой фазе заболевания, так и на этапе реконвалесценции свидетельствовали о снижении кишечного разнообразия. Установлена взаимосвязь между составом кишечной микробиоты и клиническим течением COVID-19.
Заключение. Результаты исследования указывают на серьезные нарушения микробиоценоза у пациентов с COVID-19.
Инфекция COVID-19 остается актуальной проблемой современного здравоохранения. Несмотря на завершение пандемического этапа ее распространения, вероятность мутации и появления новых генетических линий SARS-CoV-2, способных вызывать значимые эпидемические подъемы заболеваемости, предопределяет продолжение научных исследований в области патогенеза, персонифицированного подхода к лечению и реабилитации больных. Число инфицированных в мире по состоянию на февраль 2024 г. превысило 774 млн человек, ежедневный прирост заболевших в России – 28 тыс. в сутки [1].
На патогенез новой коронавирусной инфекции влияет множество факторов, одним из которых является состояние микробиома макроорганизма. Без сомнения, ключевую роль в поддержании здоровья человека играет микробиоценоз различных органов. Не случайно многие ученые обратили внимание на потенциальную взаимосвязь состояния кишечного микробиоценоза и тяжести течения COVID-19 во время пандемии. У пациентов с COVID-19 выявлен дисбаланс бактериального разнообразия: уменьшение количества бактерий типа Firmicutes, продуцирующих короткоцепочечные жирные кислоты (КЖК), увеличение условно-патогенных микроорганизмов типа Proteobacteria [2].
В структуре бактерий, населяющих кишечник взрослого человека, на долю Firmicutes и Bacteroidetes приходится 90%, на долю Actinobacteria, Proteobacteria, Verrucomicrobia и Fusobacteria, дрожжеподобных грибов, фагов и простейших – 10% [3]. Микроорганизмы в толстом кишечнике ферментируют сложные углеводы, основными метаболитами которых являются КЖК: ацетат, пропионат и бутират. Бутират увеличивает выработку муцина бокаловидными клетками и активирует регуляторные Т-клетки, играющие жизненно важную роль в ослаблении выработки цитокинов путем минимизации активации Т-клеток [3, 4]. На фоне снижения уровня бутирата в кишечнике возрастает вероятность слияния SARS-CoV-2 с ангиотензинпревращающим ферментом 2 (ACE2) с последующей активацией ренин-ангиотензиновой системы (RAS). Это приводит к системной вазоконстрикции и развитию синдрома системного воспалительного ответа (SIRS) [4]. Кишечная микробиота влияет на экспрессию рецепторов интерферона (ИФН) 1-го типа в клетках респираторного эпителия, которые быстро реагируют на вирусные инфекции посредством секреции ИФН-альфа и ИФН-бета, ограничивая репликацию вируса [5].
Цель – провести количественную оценку состояния микробиоценоза толстого кишечника у пациентов c COVID-19 средней степени тяжести.
Материал и методы
Под наблюдением находились 64 пациента с COVID-19 средней степени тяжести, госпитализированных в Инфекционную клиническую больницу (ИКБ) № 2 Департамента здравоохранения г. Москвы в период с 15 октября 2022 г. по 15 мая 2023 г. Критерии включения: возраст 18–75 лет, лабораторно подтвержденный COVID-19, наличие информированного согласия на обработку персональных данных. Критерии невключения: возраст младше 18 и старше 75 лет, беременность, ВИЧ-инфекция, отсутствие лабораторно подтвержденного COVID-19 и отзыв информированного добровольного согласия больного на обработку персональных данных и медицинское вмешательство. Работа представляет собой простое описательное исследование, основанное на анализе клинико-лабораторных показателей больных, данных стандартных лабораторных и инструментальных методов обследования в условиях стационара. Диагноз новой коронавирусной инфекции был установлен на основании выявления РНК SARS-CoV-2 методом полимеразной цепной реакции (ПЦР) в мазках из носоглотки и ротоглотки (100%). Лабораторный анализ помимо стандартных исследований предусматривал оценку количественного состава микробиоценоза толстого кишечника методом ПЦР с флуоресцентной детекцией результатов амплификации в режиме реального времени с набором «Колонофлор-16 (биоценоз)» (ООО «Альфалаб», Россия). Анализ результатов исследований проводили с использованием программного обеспечения «Колонофлор v.2.1.5.0». Статистическая обработка результатов выполнялась в программе Microsoft Office Excel 2016 (Microsoft). Интегральные показатели гемограммы описывались с помощью медианы (Ме) и нижнего и верхнего квартилей (Q1–Q3).
Результаты
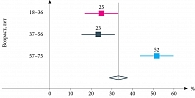
Под наблюдением находились 64 пациента, соответствовавшие критериям включения, с диагнозом COVID-19 средней степени тяжести. Исследуемую группу составили 27 (42%) женщин и 37 (58%) мужчин, медиана возраста – 59 [18; 75] лет. Возраст большинства больных (n = 33) – от 57 до 75 лет (рис. 1).
В среднем пациенты поступали на лечение в стационар на 6,6 ± 5,5 день с момента появления первых симптомов болезни. В течение 1–3-х и 4–7-х суток госпитализировано одинаковое количество пациентов – по 36%. Спустя более семи суток от начала заболевания в инфекционный стационар поступили 28% пациентов.
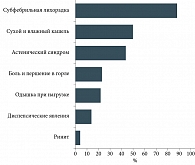
Продолжительность госпитализации в среднем составила 6,6 ± 3,8 дня (от двух до 24 дней). На амбулаторном этапе противовирусную и антибактериальную терапии получили 15,6 и 20,3% пациентов соответственно, в стационаре антибиотики назначались 59,3% госпитализированных, противовирусные – 100%. В стационаре пробиотики принимали 20,3% больных. При поступлении в стационар самыми частыми жалобами были лихорадка (87,5%), кашель (50%), астенический синдром (43,7%), боль и першение в горле (23,4%), одышка (21,8%), диспепсические явления (14%), ринит (12,5%) (рис. 2).
У 25 (39%) пациентов, по данным компьютерной томографии (КТ) органов грудной клетки, в момент госпитализации диагностирована пневмония. Однако уровень SpO2 ниже 94% отмечался только у 5 (7,8%) пациентов.
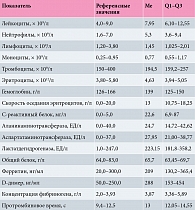
В клиническом анализе крови у 39% пациентов отмечались лейкоцитоз с нейтрофильным сдвигом и моноцитоз, у 34% – лимфопения. Анализ биохимических показателей продемонстрировал превышение референсных значений: С-реактивного белка – 85,9% случаев, лактатдегидрогеназы (ЛДГ) – 34,4%, ферритина – 20,3% случаев. В коагулограмме отмечалось повышение D-димера (46,9%) и фибриногена (43,6%). Показатели общего и биохимического анализов крови представлены в табл. 1.
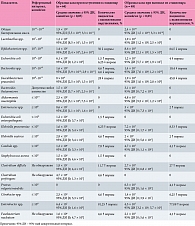
Проведено исследование бактериального состава толстого кишечника. Анализ полученных результатов выявил изменения в количественных параметрах основных представителей микробиоценоза кишечника пациентов исследуемой группы (табл. 2). Дисбиотические нарушения толстого кишечника при госпитализации зарегистрированы у 95,4% пациентов, при выписке – у 100%. Для оценки альфа‐разнообразия кишечной микробиоты использовались индексы Шеннона и Симпсона. В острой фазе и периоде реконвалесценции COVID-19 средние значения индекса разнообразия Шеннона составили 0,54 ± 0,36 и 0,52 ± 0,33, индекса равномерности Шеннона – 0,31 ± 0,18 и 0,29 ± 0,16, индекса Симпсона – 0,73 ± 0,21 и 0,71 ± 0,23 соответственно.
Таким образом, результаты указывают на серьезные нарушения микробиома.
В остром периоде заболевания при поступлении в стационар выявлено снижение численности симбиотических таксонов микробиоценоза кишечника: доля пациентов со сниженным количеством бактерий родов Bifidobacterium spp., Bacteroides spp., Faecalibacterium prausnitzii составила 50, 4,6 и 28% соответственно. В то же время наблюдалось увеличение доли пациентов, у которых условно-патогенные (Klebsiella sp., Citrobacter spp. и Enterobacter spp.) и патогенные бактерии (Escherichia coli enteropathogenic, Candida spp., Staphylococcus aureus, Clostridium spp., F. nucleatum) были выше нормы на 1,5 и 11,7% соответственно.
В период реконвалесценции при выписке из стационара наблюдалось увеличение доли пациентов со сниженным количеством бактерий Bifidobacterium spp., Bacteroides spp., F. prausnitzii по сравнению с острым периодом заболевания – до 2,26 раза в зависимости от таксона. Кроме того, зарегистрировано уменьшение доли пациентов со сниженным количеством кишечной палочки – с 6,25% при поступлении до 4% при выписке. При выписке из стационара отмечалась элиминация энтеропатогенных E. coli, S. aureus и Clostridium perfringens. Снизилась также доля пациентов, у которых содержание Klebsiella oxytoca, Candida spp., Enterobacter spp. и F. nucleatum превышало норму – до 2,3 раза в зависимости от таксона. Однако, несмотря на элиминацию и/или снижение в микробиоценозе кишечника условно-патогенных и патогенных бактерий в период реконвалесценции COVID-19, отмечалось увеличение доли пациентов с превышающими норму уровнями Enterococcus spp., K. pneumoniae, C. difficile, Proteus vulgaris/mirabilis, Citrobacter spp. – до 4,1 раза в зависимости от таксона.
Таким образом, у обследованных пациентов установлены дисбиотические нарушения толстого кишечника: колонизация условно-патогенной и патогенной микрофлорой на фоне снижения симбиотической флоры. Кроме того, установлена связь нарушения микробиоценоза с лабораторными показателями и клиническими проявлениями COVID-19.
Обсуждение
В последние годы проведено множество исследований кишечного микробиоценоза пациентов с COVID-19 в разные периоды заболевания (острая стадия, период реконвалесценции, постковидный период – long COVID-19). Согласно данным литературы, на всех стадиях COVID-19 присутствуют значительные дисбиотические нарушения толстого кишечника [6–9].
Результаты наших исследований частично совпадают с данными китайских авторов [6, 8, 10]. Исследование микробиоценоза пациентов с COVID-19 в остром периоде показало снижение бактериального разнообразия и истощение представителей нормальной микрофлоры кишечника Bifidobacterium spp., Bacteroides spp. и F. prausnitzii, а также увеличение содержания условно-патогенных микроорганизмов Klebsiella sp., Citrobacter spp. и Enterobacter spp. Однако количество Lactobacillus spp. оставалось в пределах нормы. Информация о количественном содержании лактобактерий в кале у больных COVID-19 противоречива. Одни авторы указывают на сниженное содержание лактобактерий [10], другие – на повышенное [11].
Как и в ряде других исследований, в нашем исследовании у пациентов после элиминации SARS-CoV-2 уровни Bifidobacterium spp., Bacteroides spp. и F. prausnitzii оставались сниженными, содержание условно-патогенных бактерий – увеличенным [5, 7]. В нашем исследовании зафиксировано увеличение количества Enterococcus spp., Proteus vulgaris/mirabilis, Citrobacter spp. в периоде реконвалесценции по сравнению с острым периодом. Вероятно, это связано с постковидным синдромом. Независимо от применения антибактериальных препаратов у пациентов отмечался дисбаланс бактериального разнообразия, скорее всего связанный с опосредованным влиянием вируса SARS-CoV-2 через ось «легкие – кишечник» [6, 12].
Установлена взаимосвязь между низким уровнем Bifidobacterium spp. и наличием ринита у пациентов с COVID-19. Ранее отмечалась связь между составом кишечной микробиоты и иммунными изменениями, участвующими в развитии аллергического ринита [13]. Положительная корреляция астении и индекса разнообразия Шеннона, вероятно, связана с воздействием SARS-CoV-2 на ось «кишечник – мозг» [14]. Впервые выявлена связь условно-патогенных грибковых микроорганизмов Candida spp. с уровнями D-димера, ЛДГ и индекса разнообразия Шеннона. В работе Y. Zhou (2021) показано, что у пациентов с COVID-19 на фоне высокой температуры тела уровень Enterococcus faecalis положительно коррелирует с уровнями ЛДГ и D-димера [15].
Таким образом, дисбаланс бактериального разнообразия у пациентов с COVID-19 влияет на клиническое течение заболевания, а также может способствовать развитию постковидного синдрома.
Заключение
Инфекция COVID-19 средней степени тяжести сопровождается дисбиотическим нарушением толстого кишечника – уменьшением численности представителей нормальной микрофлоры кишечника Bifidobacterium spp., Bacteroides spp. и F. prausnitzii, а также увеличением условно-патогенных микроорганизмов Klebsiella sp., Citrobacter spp., Enterobacter spp., Proteus vulgaris/mirabilis и патогенных бактерий E. coli enteropathogenic, Candida spp., S. aureus, Clostridium sp., Fusobacterium nucleatum. Средние значения индексов Шеннона и Симпсона как в острой фазе заболевания, так и на этапе реконвалесценции примерно одинаковы и свидетельствуют о снижении кишечного разнообразия. Существует взаимосвязь между составом кишечной микробиоты и клиническим течением COVID-19.
Таким образом, результаты исследования свидетельствуют о серьезных нарушениях микробиоценоза у пациентов с COVID-19. Эти данные могут быть использованы для совершенствования подходов к лечению новой коронавирусной инфекции, а также для реабилитации пациентов с постковидным синдромом.
N.S. Martynova, Zh.B. Ponezheva, PhD, N.G. Kulikova, PhD, L.A. Bityumina, D.V. Usenko, PhD, A.A. Grishaeva, PhD, Ye.T. Vdovina
Central Research Institute of Epidemiology of Rospotrebnadzor
Infectious Clinical Hospital № 2, Moscow
Contact person: Nina S. Martynova, ninabistrova1210@mail.ru
Introduction. COVID-19 infection remains an urgent problem of modern healthcare, which requires continued into the pathogenesis of a new coronavirus infection and the development of a personalized approach to the treatment and rehabilitation of patients. The microbiocenosis of the large intestine is an important component of human health, affecting immunity and general well-being.
The purpose – quantification of the state of colon microbiocenosis in patients with moderate COVID-19.
Material and methods. In 2022–2023, 64 patients with COVID-19 of moderate severity were monitored in a Moscow hospital (27 (42%) women and 37 (58%) men, the median age was 59 [18; 75] years). The main symptoms were fever, cough, weakness, pain and sore throat, and rhinitis. All patients underwent conventional studies according to the Temporary guidelines 17 version, and the composition of the intestinal microbiota was analyzed by PCR.
Results. Dysbiotic disorders of the large intestine were revealed, expressed as a decrease in the number of representatives of the normal intestinal microflora Bifidobacterium spp., Bacteroides spp., and Faecalibacterium prausnitzii, as well as an increase in opportunistic pathogens Klebsiella sp., Citrobacter spp., Enterobacter spp., Proteus vulgaris/mirabilis and pathogenic bacteria Escherichia coli enteropathogenic, Candida spp., Staphylococcus aureus, Clostridium sp., Fusobacterium nucleatum. The average values of the Shannon and Simpson indices in patients both in the acute phase of the disease and at the stage of convalescence were approximately the same and indicated a decrease in intestinal diversity. The relationship between the composition of the intestinal microbiota and the clinical course of COVID-19 has been established.
Conclusion. The results of the study indicate serious violations of microbiocenosis in patients with COVID-19.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.