COVID-19 у больных ревматоидным артритом: течение и исходы
- Аннотация
- Статья
- Ссылки
- English
После начала кампании по вакцинации против COVID-19 у пациентов с РА риск инфицирования COVID-19 и степень его тяжести снизились. Однако новые данные свидетельствуют о том, что страдающие РА могут подвергаться риску развития постковидного синдрома. Именно поэтому необходимо соблюдать настороженность в отношении снижения риска заражения и как можно раньше начинать лечение COVID-19 и реабилитацию в данной популяции.
Актуальны дальнейшие исследования клинических исходов и механизмов возникновения постковидного синдрома у больных РА.
После начала кампании по вакцинации против COVID-19 у пациентов с РА риск инфицирования COVID-19 и степень его тяжести снизились. Однако новые данные свидетельствуют о том, что страдающие РА могут подвергаться риску развития постковидного синдрома. Именно поэтому необходимо соблюдать настороженность в отношении снижения риска заражения и как можно раньше начинать лечение COVID-19 и реабилитацию в данной популяции.
Актуальны дальнейшие исследования клинических исходов и механизмов возникновения постковидного синдрома у больных РА.
На сегодняшний день в мире насчитывается порядка 20 млн страдающих ревматоидным артритом (РА), которые как минимум один раз были инфицированы SARS-CoV-2 с начала пандемии в 2020 г. В ходе сравнительного когортного исследования клинического течения и исходов COVID-19, выполненного K.M. D’Silva и соавт. в ряде регионов США с наибольшими эпидемиологическими показателями данной инфекции у пациентов с иммуновоспалительными ревматическими заболеваниями (ИВРЗ), среди которых преобладал РА, таким больным чаще требовались лечение в условиях отделения интенсивной терапии и дополнительная оксигенация (относительный риск (ОР) 3,11 при 95%-ном доверительном интервале (ДИ) 1,07–9,05) [1]. В исследовании, проведенном T.Y. Hsu и соавт., анализ медицинской документации госпитализированных больных показал, что при ИВРЗ чаще возникали тяжелые осложнения, в том числе гипервоспалительный синдром (синдром активации макрофагов) [2]. В других исследованиях у больных РА также фиксировались более тяжелое течение пневмонии, что подтверждалось данными лучевой диагностики [3], меньшая реактивность гуморального иммунитета после перенесенной инфекции [4], длительное выделение SARS-CoV-2 после клинического выздоровления [5] и высокая частота неблагоприятных исходов у получавших анти-В-клеточную терапию [6].
На исходе первого года пандемии были опубликованы данные Глобального ревматологического альянса о факторах риска госпитализации и смерти в связи с COVID-19 [7, 8], к которым были отнесены некоторые противоревматические препараты [9], коморбидные заболевания, активность ИВРЗ, определенная раса/этническая принадлежность [10], а также территориальные/социальные факторы [11]. Метаанализ и систематический обзор R. Conway и соавт. свидетельствуют о том, что у пациентов с ИВРЗ имел место более высокий риск заражения COVID-19 (отношение шансов (ОШ) 1,53 (95% ДИ 1,16–2,01)) и смерти (ОШ 1,74 (95% ДИ 1,08–2,80)) по сравнению с общей популяцией [12].
Накопленные в первые годы пандемии данные позволили провести исследования в группах пациентов, стратифицированных по ревматическим нозологиям, в том числе с РА. Установлено, что у лиц с РА риск заражения SARS-CoV-2 был увеличен в связи с иммунопатологическими расстройствами в рамках основного заболевания, проводимой противоревматической терапией, включая прием глюкокортикоидов (ГК) и генно-инженерных биологических препаратов (ГИБП), и сопутствующей патологией. Так, согласно данным B.R. England и соавт., риск COVID-19 у больных РА оказался на 25% выше, чем у пациентов без РА (скорректированный коэффициент риска (сКР) 1,25 (95% ДИ 1,13–1,39)) [13]. При этом указанные риски у лиц с антителами к циклическому цитруллинированному пептиду (АЦЦП) и/или ревматоидным фактором (РФ) не превосходили таковые у больных серонегативным РА. Аналогичные результаты были получены другими исследователями. В частности, в работе Y. Wang и соавт. при сравнении заболеваемости COVID-19 у пациентов с и без РА скорректированный коэффициент риска вероятного/подтвержденного или подтвержденного COVID-19 составил 1,19 (95% ДИ 1,05–1,36) и 1,42 (95% ДИ 1,01–1,95) соответственно [14].
Некоторые противоревматические препараты, в том числе ГК, стандартные (с) и таргетные (т) базисные противовоспалительные препараты (БПВП), а также ГИБП могут влиять на противоинфекционный иммунитет и повышать восприимчивость к COVID-19. В упоминавшемся выше исследовании среди больных РА, получавших тБПВП/ГИБП в сочетании с ГК, отмечены максимальные риски как развития COVID-19, так и госпитализации/летального исхода, обусловленных данной инфекцией (сКР 1,66 (95% ДИ 1,36–2,03) и 2,12 (95% ДИ 1,48–3,03) соответственно) [13].
Таким образом, РА per se, сопутствующие факторы и противоревматическая терапия влияют на заболеваемость инфекцией, вызванной SARS-CoV-2.
Ревматоидный артрит и течение/исходы COVID-19
Пациенты с ИВРЗ, в том числе с РА, подвержены большему риску тяжелого течения COVID-19 по сравнению со здоровой когортой, включая тяжелое поражение легких (20 и 11% соответственно, p = 0,02), госпитализацию в инфекционное отделение (ОР 1,14 (95% ДИ 1,03–1,26)) или отделение интенсивной терапии (ОР 1,32 (95% ДИ 1,03–1,68)), развитие острой почечной недостаточности (ОР 1,81 (95% ДИ 1,07–3,07)), венозной тромбоэмболии (ОР 1,74 (95% ДИ 1,23–2,45)) и необходимость искусственной вентиляции легких (ИВЛ) (ОШ 3,11, p = 0,02) [1, 3, 15, 16]. Некоторые исследователи выделяют дополнительные факторы риска тяжелого течения COVID-19. Так, согласно данным M.A. Gianfrancesco и соавт., повышенному риску госпитализации, потребности в ИВЛ и смерти подвержены представители негроидной расы (скорректированное ОШ (сОШ) 2,74 (95% ДИ 1,90–3,95)), латиноамериканцы (сОШ 1,71 (95% ДИ 1,18–2,49)) и монголоиды (сОШ 2,69 (95% ДИ 1,90– 3,95)) по сравнению с европейцами [10]. По мнению авторов, эти данные иллюстрируют особенности течения ИВРЗ и доступность медицинской помощи в разных странах. Риск смерти от COVID-19 увеличивают такие факторы, как пожилой возраст (ОШ 3,00 (95% ДИ 2,13–4,22)), мужской пол (ОШ 1,46 (95% ДИ 1,11–1,91)), артериальная гипертензия в сочетании с другими сердечно-сосудистыми заболеваниями (ОШ 1,89 (95% ДИ 1,31–2,73)), хронические болезни легких (ОШ 1,68 (95% ДИ 1,26–2,25)) и умеренная/высокая активность ИВРЗ (ОШ 1,87 (95% ДИ 1,27–2,77)) [8].
В нескольких работах показано, что РА ассоциируется с более тяжелым течением COVID-19, включая повышенную частоту госпитализаций [13], развитие венозной тромбоэмболии и сепсиса [17], а также летального исхода [17, 18].
Некоторые исследователи выделяют ряд факторов, ассоциирующихся с ухудшением прогноза COVID-19 у больных РА. Речь, в частности, идет о серопозитивности по РФ и АЦЦП, наличии эрозивного артрита и интерстициального поражения легких. Так, G. Figueroa-Parra и соавт. в ходе ретроспективного сравнительного многоцентрового когортного исследования показали, что пациенты с РА по сравнению с общей популяцией были подвержены более высокому риску госпитализаций или летального исхода в результате COVID-19 (ОР 1,75 (95% ДИ 1,45–2,10)). В то же время у серопозитивных по РФ и АЦЦП пациентов, а также пациентов с активным эрозивным артритом имел место более высокий внутригрупповой риск вышеуказанных событий (ОР 1,97 (95% ДИ 1,58–2,46) и 1,93 (95% ДИ 1,41–2,63) соответственно). Кроме того, риск тяжелого течения COVID-19 был выше у пациентов с РА, осложненным интерстициальным поражением легких (ОР 2,50 (95% ДИ 1,66–3,77)) [19].
Противоревматическая терапия и исходы COVID-19
При анализе базы данных Глобального ревматологического альянса установлено, что больные, в том числе с РА, получавшие ритуксимаб (РТМ) и высокие дозы ГК (> 10 мг/сут в эквиваленте преднизолона), подвергались большему риску тяжелого течения COVID-19 [8]. В отношении с/тБПВП и других ГИБП получены разрозненные результаты, что требует дополнительных исследований. Так, согласно данным H. Bower и соавт., тБПВП и ГИБП не увеличивали потребность в стационарном лечении COVID-19 у больных ИВРЗ [20]. В вышеупомянутом исследовании было показано, что некоторые ГИБП, в частности ингибиторы фактора некроза опухоли α (иФНО-α), ассоциировались со снижением тяжести течения COVID-19 и частоты госпитализаций [7]. Результаты другого когортного исследования продемонстрировали, что у пациентов с РА применение РТМ и ингибиторов интерлейкина (ИЛ) 6 ассоциировалось с повышением частоты госпитализаций по сравнению с использованием иФНО-α [17]. В то же время между группами, получавшими ингибиторы янус-киназ/абатацепт/иФНО-α, различий по указанному показателю не получено [17]. В когортном исследовании, проведенном N. Singh и соавт., у пациентов с РА, получавших РТМ, при развитии COVID-19 отмечен более высокий риск госпитализаций (сОР 2,1 (95% ДИ 1,5–3,0)), в том числе в отделение интенсивной терапии (сОР 5,2 (95% ДИ 1,8–15,4)), а также потребности в ИВЛ (сОР 2,7 (95% ДИ 1,4–5,5)) по сравнению с получавшими только БПВП [21].
Постковидный синдром
В октябре 2021 г. эксперты Всемирной организации здравоохранения определили постковидный синдром (ПКС) как состояние, которое возникает у лиц с наличием в анамнезе вероятной или подтвержденной инфекции, вызванной SARS-CoV-2, как правило, в течение трех месяцев с момента дебюта COVID-19 и характеризуется наличием симптомов на протяжении не менее двух месяцев, а также невозможностью их объяснения альтернативным диагнозом [22].
Имеющиеся на сегодняшний день данные позволяют предполагать, что ИВРЗ, в том числе РА, и ПКС имеют схожий патогенез, определяемый аутоиммунными реакциями, развитием фиброза, гиперкоагуляции и воспаления.
Известно, что вирусные инфекции, в том числе вызванные коронавирусами, являются триггером развития и обострения ИВРЗ. Считается, что ПКС может модифицировать течение РА, усугубляя системное воспаление [23]. Так, в исследовании RheumCARD из 174 пациентов с ИВРЗ, в том числе 50% с РА, перенесших COVID-19, у 45% симптомы COVID-19 продолжались не менее 28 дней. К факторам риска развития ПКС были отнесены сравнительно большее количество симптомов COVID-19 и потребность в госпитализации в инфекционной фазе болезни [24]. Согласно нашим данным, частота развития ПКС при РА составила 47,8%. Данный синдром преимущественно был представлен слабостью, повышенной утомляемостью, снижением концентрации внимания, нарушениями сна, усилением артралгий и одышкой при физической нагрузке. В среднем (медиана) каждый пациент отмечал 10 (6,5; 12,0) симптомов ПКС одновременно. При этом у больных РА и ПКС отмечались более высокая частота госпитализаций и более тяжелое течение COVID-19 [25].
Вакцинация и течение COVID-19
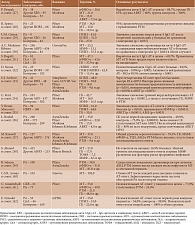
Вакцины против SARS-CoV-2 снижают риск заражения и тяжесть течения COVID-19 у лиц с ослабленным иммунитетом [26]. Однако РА и/или препараты, назначаемые для его лечения, в определенной степени ослабляют иммуногенный эффект вакцин (таблица) [27–42].
Показано, что у вакцинированных лиц с РА повышалась частота заражения SARS-CoV-2, так называемая прорывная инфекция, по сравнению с группой контроля [43]. Ранее уже было известно, что пациенты с ИВРЗ более подвержены прорывным инфекциям [44], даже с неблагоприятным исходом. Особенно это касалось получавших РТМ и микофенолата мофетил (ММФ) [45]. Ретроспективный анализ данных крупной американской когорты показал, что среди невакцинированных пациентов с РА увеличен риск госпитализаций и летального исхода, ассоциированных с COVID-19, по сравнению с общей популяцией при оценке в контрольной точке через три месяца наблюдения (сОР 1,62 (95% ДИ 1,34–1,96) и 1,88 (95% ДИ 1,37–2,60) соответственно). В то же время среди вакцинированных у больных РА уровень заражения COVID-19 был выше по сравнению с общей популяцией при оценке девятимесячного временного интервала (сКР 1,10 (95% ДИ 1,00–1,20)), при этом в контрольных точках через три и шесть месяцев различий не наблюдалось [18]. Согласно данным общенационального датского исследования, несмотря на то что потребность в госпитализации у пациентов с РА по сравнению с лицами контрольной группы была выше независимо от статуса вакцинации, риск госпитализаций был ниже в когорте вакцинированных (сОР 1,22 (95% ДИ 1,09–1,57) и 1,09 (95% ДИ 0,92–1,14) соответственно). У невакцинированных пациентов с РА, получавших РТМ, вероятность госпитализации была значительно выше, чем у применявших БПВП, и этот показатель оставался повышенным в группе вакцинированных [46]. I. Jyssum и соавт. установили, что среди больных РА, получивших две дозы вакцины против SARS-CoV-2, серологический ответ на вакцинацию в группе РТМ отмечался значимо реже, чем в контрольной группе, – 21 и 98% соответственно (p < 0,0001). У 16,3% применявших РТМ серологический ответ наблюдали только при введении бустерной дозы вакцины. В этом же исследовании оценивался Т-клеточный ответ, который у пациентов исследуемой группы также был сглажен после второй и повышался после третьей дозы вакцины [47].
Таким образом, применение ряда противоревматических препаратов может негативно влиять на поствакцинальный ответ и повышать риск развития прорывной инфекции COVID-19.
В клинической практике при применении различных вакцин, в том числе против SARS-CoV-2, нередки ситуации, когда те или иные антигены, полученные из инфекционных агентов и являющиеся вакцинальными компонентами, могут выступать в качестве триггеров развития различных аутоиммунных феноменов, в том числе возникновения или обострения уже существующих ИВРЗ, включая РА [48–50]. Однако, как свидетельствуют данные обзора, выполненного отечественными авторами, в целом частота активации ИВРЗ после вакцинации против COVID-19 представляется достаточно низкой (5–7%) и не имеет статистически значимых ассоциаций с конкретной вакциной или проводимой противоревматической терапией [51].
Следует подчеркнуть, что, несмотря на риск развития прорывных инфекций и минимальную вероятность обострения РА, равно как и других ИВРЗ, эксперты всех международных и национальных ревматологических научных обществ, включая Ассоциацию ревматологов России [52], поддерживают положение о том, что польза от вакцинации значительно превосходит потенциальный вред, связанный с развитием вышеуказанных явлений, поскольку вакцинация, несомненно, снижает риск инфицирования SARS-CoV-2 и тяжелого течения COVID-19.
Заключение
С начала пандемии COVID-19 накоплен большой объем информации, касающейся частоты, особенностей клиники и исходов этого заболевания у пациентов ревматологического профиля, а также его влияния на течение РА и других ИВРЗ. Несомненного внимания заслуживает ПКС, оценка риска развития которого необходима для адекватного распределения нагрузки на систему здравоохранения, а также для разработки стратегии, направленной на его профилактику, своевременную диагностику и лечение при РА в частности и ИВРЗ в целом. При активной вакцинации наблюдается явное снижение частоты тяжелого течения COVID-19 и летальных исходов, связанных с данной инфекцией. Однако в данной области остается ряд нерешенных вопросов, в частности разработка графика бустерной вакцинации, активное изучение и быстрое внедрение в практику новых антиковидных вакцин и препаратов, содержащих моноклональные антитела, направленные на нейтрализацию циркулирующих и возможных будущих штаммов SARS-CoV-2. Для достижения указанных целей необходимы новые широкомасштабные исследования на крупных когортах пациентов с ИВРЗ.
Заявление о конфликте интересов
Исследование выполнено в рамках темы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7. Исследование не имело спонсорской поддержки.
Конфликт интересов отсутствует.
E.S. Aronova, PhD, B.S. Belov, MD, PhD, G.I. Gridneva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Evgenia S. Aronova, eugpozd@mail.ru
The data accumulated in the early years of the pandemic made it possible to study the features of the course of COVID-19 in patients with RA. The results indicated that patients with RA have an increased risk of SARS-CoV-2 infection due to disorders in the immune system, antirheumatic therapy, including the use of glucocorticoids and genetically engineered biological drugs, and comorbidities.
Since the start of the COVID-19 vaccination campaign, the risk and severity of COVID-19 infection has decreased for patients with RA, but remained higher compared to the general population. In addition, literature data indicate a high risk of breakthrough infection after vaccination. However, new evidence suggests that patients with RA may be at risk of developing post-COVID syndrome. Care must be taken to reduce the risk of infection and to begin treatment of COVID-19 and rehabilitation of patients with RA as early as possible. Further studies of clinical outcomes and mechanisms of post-COVID syndrome in patients with RA are relevant.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.