Редкие иммуноопосредованные нежелательные явления. Клинический случай синдрома Шегрена на фоне иммунотерапии у пациента с аденокарциномой легкого
- Аннотация
- Статья
- Ссылки
- English
Представленное клиническое наблюдение убедительно демонстрирует, что при назначении ИКТИ в случае появления симптомов, подозрительных в отношении синдрома Шегрена (СШ), следует провести тщательный сбор анамнеза и полное обследование, включая специализированные диагностические тесты по оценке функции слюнных и слезных желез. Для дифференциальной диагностики СШ с другими нозологиями требуется выполнение анализа на сывороточные аутоантитела и биопсии слюнных желез. Крайне важным является незамедлительное направление пациента к ревматологу, что позволит избежать задержки в постановке корректного диагноза.
Ранняя диагностика и своевременное лечение токсических реакций являются залогом успешного проведения противоопухолевой терапии. Для достижения этой цели требуется тесное взаимодействие врачей разных специальностей, пациента и его близких.
Представленное клиническое наблюдение убедительно демонстрирует, что при назначении ИКТИ в случае появления симптомов, подозрительных в отношении синдрома Шегрена (СШ), следует провести тщательный сбор анамнеза и полное обследование, включая специализированные диагностические тесты по оценке функции слюнных и слезных желез. Для дифференциальной диагностики СШ с другими нозологиями требуется выполнение анализа на сывороточные аутоантитела и биопсии слюнных желез. Крайне важным является незамедлительное направление пациента к ревматологу, что позволит избежать задержки в постановке корректного диагноза.
Ранняя диагностика и своевременное лечение токсических реакций являются залогом успешного проведения противоопухолевой терапии. Для достижения этой цели требуется тесное взаимодействие врачей разных специальностей, пациента и его близких.

Введение
Роль Т-лимфоцитов в иммунологическом надзоре за опухолевыми клетками привлекает внимание исследователей уже долгое время. Именно понимание того, что раковые клетки могут в итоге избегать воздействия со стороны Т-клеток, послужило толчком к поиску путей повышения эффективности противоопухолевого иммунного ответа. Последние достижения в понимании иммунобиологии Т-лимфоцитов сыграли особую роль в разработке терапевтических стратегий, направленных на преодоление механизмов «уклонения» опухоли от распознавания иммунными клетками, а блокада контрольных точек стала одним из наиболее перспективных направлений лечения [1–3].
Открытие и клиническое применение чекпойнт-ингибиторов, нацеленных на рецептор цитотоксических Т-лимфоцитов 4 (CTLA-4), рецептор программируемой клеточной гибели (PD-1) и его лиганд (PD-L1), произвели настоящую революцию в лечении онкологических заболеваний и были отмечены Нобелевской премией по физиологии и медицине в 2018 г. [4].
Ингибиторы контрольных точек иммунитета (ИКТИ) снимают ограничения на активацию и поддержание эффекторной функции Т-клеток путем вмешательства в регуляторные пути, естественным образом ингибирующие эту активность [5].
Как показали исследования, для опухолевых клеток характерна чрезмерная активность подобных путей, воздействующих на Т-лимфоциты. Поэтому использование ИКТИ оказалось эффективной стратегией лечения, которая в последние годы демонстрирует беспрецедентный и стойкий ответ у определенного числа онкологических пациентов [6, 7].
Однако сенсибилизация иммунной системы чекпойнт-ингибиторами сопровождается уникальным профилем побочных эффектов. Токсичность, обусловленная применением ИКТИ, имеет аутоиммунную природу и носит название иммуноопосредованных нежелательных явлений (иНЯ) [8, 9]. Частота и варианты различных иНЯ зависят от профиля пациентов, диагноза и типа используемого препарата [10]. Наиболее распространенными нежелательными явлениями являются поражения кожи (сыпь, зуд), слизистой желудочно-кишечного тракта (диарея, гепатит, колит), суставов (артралгия), эндокринных желез (гипотиреоз/гипертиреоз, недостаточность коры надпочечников, сахарный диабет) и дыхательных путей (плеврит, пневмонит), однако почти каждая ткань или орган могут быть подвергнуты аутоиммунной агрессии [11]. Некоторые иНЯ возникают крайне редко или могут быть малозаметными и потенциально упущенными из виду. Осведомленность клиницистов об этих побочных эффектах является важным аспектом, определяющим успешность лечебной тактики [12].
Приведенный в данной статье клинический случай демонстрирует возможное разнообразие иНЯ, в частности развитие у пациента на фоне терапии ниволумабом такого редкого нежелательного явления, как синдром Шегрена (СШ), потребовавшего мультимодального подхода для своевременной диагностики и назначения рациональной сопроводительной терапии.
Клинический случай
Пациент Б., 54 года, в декабре 2019 г. обратился к пульмонологу в поликлинику по месту жительства с жалобами на сухой кашель, который сохранялся с ноября 2019 г. после перенесенной ОРВИ. Был поставлен диагноз «бронхиальная астма», назначен Беродуал, который дал незначительный положительный эффект.
Далее при плановой диспансеризации в мае 2020 г. была выполнена компьютерная томография (КТ) органов грудной клетки, по данным которой выявлены множественные очаговые уплотнения в правом легком. В июне 2020 г. в ФГБНУ «Центральный научно-исследовательский институт туберкулеза» пациенту выполнено хирургическое вмешательство с диагностической целью в объеме видеоассистированной торакоскопии справа, атипичной резекции 1–2-го сегментов легкого, прецизионного удаления очага в 8-м сегменте, лимфодиссекции. При морфологическом исследовании верифицирована аденокарцинома.
В августе 2020 г. пациент обратился в Московский научно-исследовательский институт им. П.А. Герцена. При дополнительном обследовании данных о наличии отдаленных метастазов не получено. При пересмотре гистологического материала была подтверждена умеренно дифференцированная аденокарцинома. Проведено молекулярно-биологическое исследование опухолевой ткани. Перестроек генов ROS1 и ALK не выявлено, в генах EGFR и BRAF соматических мутаций не обнаружено, реакция с антителом к онкопротеину HER2/neu – негативная. При оценке PD-L1-статуса мембранная экспрессия в опухолевых клетках (TPS) составляла 0%. Установлен окончательный диагноз: C34.8 периферический рак правого легкого T4N2M0, IIIB стадия, без активирующих мутаций, PD-L1-негативный.
Ввиду распространенности опухолевого процесса хирургическое лечение пациенту не показано, проведение химиолучевой терапии также невозможно вследствие объема первичной опухоли, превышающего допустимую толерантность легочной ткани. В связи с этим было принято решение о проведении индукционной химиотерапии (ХТ). Из сопутствующей патологии отмечены контролируемая артериальная гипертензия, сахарный диабет 2-го типа в стадии компенсации, ожирение 3-й степени (индекс массы тела – 41,6 кг/м2).
С августа по октябрь 2020 г. пациенту проведено три курса ХТ по схеме: паклитаксел в дозе 175 мг/м2 + карбоплатин AUC 6 в первый день 21-дневного цикла. По данным позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ), после третьего курса отмечались стабилизация процесса и отсутствие значимых токсических реакций, в связи с чем принято решение о продолжении платиносодержащей ХТ до максимального объема. С ноября по декабрь 2020 г. реализовано еще три курса ХТ по прежней схеме с последующим выполнением ПЭТ/КТ, по результатам которой сохранялась стабилизация заболевания. Далее пациент находился под динамическим наблюдением.
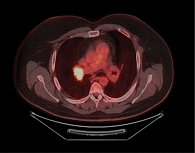
По данным контрольной ПЭТ/КТ, выполненной в марте 2021 г., зафиксировано прогрессирование заболевания в виде увеличения метаболической активности в ткани правого легкого и бронхопульмональных лимфоузлах справа (рис. 1). В связи с этим было принято решение о проведении иммунотерапии (ИТ).
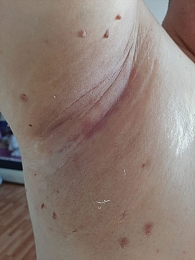
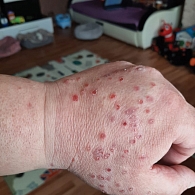
С марта 2021 г. начата ИТ ниволумабом в дозе 480 мг в первый день 28-дневного цикла. После четвертого курса ИТ у пациента появились жалобы на высыпания на коже и зуд в паховой области и области подмышечных впадин, а также выраженную сухость во рту и жажду (рис. 2). С учетом проявления кожной токсичности 2-й степени тяжести местно были назначены кортикостероиды, давшие положительный эффект. При дообследовании не было обнаружено несахарного диабета. Уровни гормонов щитовидной железы, гипофиза и надпочечников оставались в пределах нормы. Симптомов сухости глаз, а также каких-либо других системных проявлений не наблюдалось. Причиной ксеростомии могло быть недостаточное потребление жидкости. Проведена коррекция питьевого режима, однако жалобы на выраженную сухость во рту сохранялись в течение двух месяцев без видимого улучшения. Пациента проконсультировали дерматолог, эндокринолог, ревматолог. Заподозрен синдром Шегрена. По рекомендации ревматолога пациенту выполнена сиалометрия, по данным которой отмечалось выраженное снижение стимулированной секреции слюны. Выполнена биопсия слюнных желез, при гистологическом исследовании обнаружены множественные крупные скопления лимфоцитов с атрофией ацинусов. В анализе крови зафиксированы антинуклеарный фактор и антитела к La/SS-B ядерным антигенам. С учетом полученных данных на основании классификационных критериев Американской коллегии ревматологов у пациента был установлен СШ.
Клинические проявления СШ, согласно данным шкалы ревматологических критериев токсичности (RCTC), разработанных рабочей группой OMERACT по безопасности лекарственных средств, которая специализируется на стандартизации оценки нежелательных явлений в клинических испытаниях, в том числе и в ревматологии, соответствовали 2-й степени. Была назначена корригирующая терапия в виде заменителей слюны, глюкокортикостероидов (преднизолон в дозе 0,5 мг/кг перорально один раз в день), которая сопровождалась положительным эффектом. Однако в феврале 2022 г., несмотря на проводимую терапию, пациент отметил ухудшение состояния: усилились сыпь на теле, кожный зуд, чувство жажды, появилась сухость кожи, глаз, кроме того, отмечено появление признаков фимоза (рис. 3). Предпринята попытка увеличения дозировки стероидов, однако на этом фоне наблюдались повышение артериального давления до 180/90 мм рт. ст., повышение уровня глюкозы до 19 ммоль/л, набор веса на 12 кг. С целью коррекции нежелательных явлений пациента неоднократно консультировали дерматолог, эндокринолог, кардиолог, ревматолог, уролог. Проводился подбор корригирующей терапии, которая сопровождалась лишь минимальным положительным эффектом. Вышеописанные симптомы ухудшали качество жизни пациента, в связи с чем принято решение об отмене ИТ. При регулярных обследованиях (ПЭТ/КТ) в течение года фиксировалась стабилизация опухолевого процесса. С учетом длительной стабилизации пациент оставлен под строгим динамическим наблюдением. По данным контрольной ПЭТ/КТ от сентября 2022 г. подтверждено сохранение достигнутой на фоне ИТ стабилизации опухоли (рис. 4).
Обсуждение
Ревматологические иммуноопосредованные нежелательные явления (РиНЯ) встречаются гораздо реже, чем другие иНЯ, и обычно являются предметом сообщений в качестве отдельных случаев. Так, согласно данным статистики, РиНЯ отмечаются у 1,5–22% пациентов, а такой широкий диапазон объясняется наличием определенных сложностей у клиницистов вследствие отсутствия единых критериев диагностики [13, 14]. Самые большие когорты пациентов с РиНЯ были прослежены в крупных одноцентровых исследованиях. Например, в ретроспективной базе данных клиники Мейо были зарегистрированы 43 случая среди 1293 пациентов, получавших ИКТИ (74% – монотерапия анти-PD-(L)1-препаратами), в результате чего частота данного вида НЯ составила 3,3% [15]. Во французском проспективном исследовании с участием 524 пациентов, 77% из которых получали анти-PD-(L)1-препараты, сообщалось о 6,6% (n = 35) РиНЯ [16].
Причина немногочисленных сообщений о ревматологических побочных эффектах на фоне ИТ многофакторна и включает разнообразие симптомов, редкость репортирования о РиНЯ в клинических исследованиях, а также позднее возникновение событий (в течение двух лет после начала терапии ИКТИ). Многие симптомы могут появляться самостоятельно или в составе какого-либо синдрома, как правило характеризующегося более тяжелым течением. Также стоит отметить сложность для онколога в диагностике подобных нежелательных явлений [17–19].
В литературе наиболее часто встречаются сообщения об артралгии и миалгии на фоне лечения чекпойнт-ингибиторами, частота которых варьирует от 1 до 43% и от 2 до 21% соответственно. Кроме того, миалгия наблюдалась у 2–18% участников испытаний, получавших ниволумаб и ипилимумаб, а мышечная слабость – у 1% [20].
ИКТИ иногда способствуют активации и пролиферации аутореактивных иммунных клеток, что может привести к возникновению СШ [21, 22]. Первые четыре случая СШ, обусловленного иммунотерапией, были описаны L.C. Cappelli и соавт. в 2016 г. [23]. В более поздних сообщениях представлены клинические проявления СШ на фоне применения чекпойнт-ингибиторов с частотой встречаемости от 1,2 до 24,2%, в зависимости от критериев постановки диагноза [13, 24]. В недавно опубликованной серии случаев были выявлены 20 пациентов, у которых развился СШ, связанный с терапией ИКТИ, и исчерпывающе описана клиническая картина. Средний возраст пациентов составил 57 лет (диапазон 26–78 лет), 70% были мужчинами, 20% имели в анамнезе аутоиммунные заболевания, а 85% получали монотерапию анти-PD-(L)1-препаратами. У половины были отмечены сопутствующие неревматологические иНЯ. Симптомы сухости во рту присутствовали у всех пациентов и появились в среднем через 70 дней после начала лечения ИКТИ. Ксеростомия обычно возникала внезапно, часто усиливалась при физической нагрузке или ночью. У 95% пациентов наблюдалась гипофункция слюнных желез по данным сиалометрии, 45% (n = 9) отмечали сухость глаз, а у 55% (n = 5) встречалось снижение продукции слезной жидкости [25]. Согласно данным International ImmunoCancer Registry, среди 26 пациентов с СШ ксеростомия была зарегистрирована в 96% случаев, а ксерофтальмия – в 65% [26].
Заключение
Выраженные иНЯ влияют не только на качество жизни пациентов, но и на возможность получать последующее противоопухолевое лечение, зачастую являясь противопоказаниями к продолжению терапии [27, 28]. Несмотря на это, в недавних публикациях сообщалось о взаимосвязи между иНЯ и клинической эффективностью ИКТИ у онкологических больных с точки зрения частоты ответа (ЧО), выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) [29, 30]. Согласно данным, полученным К. Haratani и соавт., у пациентов с немелкоклеточным раком легкого (НМРЛ), получавших ниволумаб, развитие иНЯ связано с лучшей ВБП (9,2 месяца против 4,8 месяца) и ОВ (не достигнута против 11,1 месяца) [31]. Также положительная связь между иНЯ и улучшением показателей выживаемости была продемонстрирована в большой когорте итальянских пациентов с НМРЛ, получавших анти-PD-1-препараты. В частности, более высокая ЧО (46,5 против 25,7%), более длительная ВБП (10,1 против 4,1 месяца) и ОВ (20,5 против 8,5 месяца) наблюдались среди пациентов, у которых развились иНЯ, по сравнению с теми, у кого их не было [32]. Результаты, полученные в ретроспективном французском исследовании, объединившем 270 пациентов, подтверждают более высокие онкологические показатели при возникновении иНЯ, однако статистически значимых различий достигнуто не было, что авторы связывают с непродолжительным периодом наблюдения [33].
Рабочая группа OMERACT разработала Общие критерии токсичности для ревматологии (RCTC), которые могут помочь клиницисту в подборе средств при РиНЯ. Как правило, лечение является многокомпонентным и во многом пересекается с лечением, применяемым в ревматологической практике.
Оценка и успешное лечение иНЯ требуют своевременного привлечения специалиста-ревматолога.
Yu.B. Karagodina, M.S. Ruban, V.V. Savchina, A.L. Kornietskaya, PhD, L.V. Bolotina, PhD, A.A. Fedenko, PhD
National Medical Research Radiological Center
Contact person: Yulia B. Karagodina, yuliaborisovnakaragodina@gmail.com
Given the rapid expansion of indications for immune checkpoint inhibitors therapy in the clinical practice of oncologists, as well as the emergence of new drugs with similar mechanisms of action, knowledge of rare immune-related adverse events is extremely important for physicians, both in terms of their early detection and optimisation of treatment tactics. Despite their rarity, the spectrum of rheumatological manifestations is quite broad, which requires the continued detailed accumulation and analysis of clinical material.
The present clinical observation convincingly demonstrates that when prescribing immune checkpoint inhibitors in case of symptoms suspicious of Sjögren's syndrome, a thorough history and a complete examination, including specialized diagnostic tests to evaluate salivary and lacrimal gland function, should be performed. The differential diagnosis of Sjögren's syndrome with other nosologies requires serum autoantibody testing and salivary gland biopsy. Prompt referral of the patient to a rheumatologist is critical, to avoid delay in making a correct diagnosis.
Early diagnosis and timely treatment of toxic reactions are the key to successful anti-tumour therapy. Achieving this goal requires close collaboration between multidisciplinary physicians, the patient, and the patient's family.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.