Рекомбинантный активированный фактор VII в остановке кровотечения на фоне антитромботической терапии
- Аннотация
- Статья
- Ссылки


Физиологический гемостаз – тонко сбалансированный механизм. Гены, образ жизни, возраст, заболевания могут нарушать этот хрупкий баланс. Антитромботическая терапия, находящая все более широкое применение в клинической практике, представляет серьезный вызов врачу, оказывающему помощь пациенту с кровотечением.
Традиционно средством коррекции острой массивной кровопотери считают переливание плазмы крови [1]. Однако оно неэффективно при остановке кровотечения на фоне большинства современных антитромботических препаратов [2].
Рекомбинантный активированный фактор VII (recombinant activated factor VII, rFVIIa) разработан для лечения пациентов с циркулирующими в крови ингибиторами к фактору VIII и находит все более широкое применение как гемостатический препарат «последней линии», когда все остальные средства неэффективны [3].
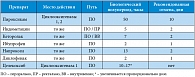
С позиции трансфузиолога можно выделить семь групп препаратов антитромботической терапии.
Варфарин
Эффект варфарина оценивают по величине международного нормализованного отношения (МНО). При небольшой кровоточивости быстрое внутривенное введение 1–3 мг витамина К приводит к снижению МНО в течение 6–8 часов с полной нормализацией коагуляции в течение 12 часов. При тяжелом кровотечении требуется введение четырехфакторного концентрата протромбинового комплекса, а при его отсутствии – свежезамороженной плазмы [4].
Гепарин и гепариноподобные препараты
Гепарин увеличивает активность антитромбина против активированных сериновых протеаз. Для инверсии эффекта гепарина при плановом лечебном использовании или при кровотечении широко применяется протамин. Плазма для инверсии действия гепарина значения не имеет и даже может нанести вред, поставляя больше антитромбина, на который действует гепарин. Фракционированные или низкомолекулярные гепарины с полупериодом циркуляции в плазме 4–6 часов (при подкожном введении – дольше) на 50% выводятся почками и, соответственно, могут аккумулироваться при почечной недостаточности. Признаком передозировки гепаринов является увеличенное активированное частичное тромбопластиновое время (АЧТВ). Некоторые низкомолекулярные гепарины удаляются диализом. Действие протамина ограниченно; считается, что он нейтрализует до 50% антикоагулянтной активности гепарина, но этот эффект сложно измерить, в отличие от такового стандартных гепаринов. Предположительно, более эффективно шунтирование антикоагулянтной активности при помощи введения rFVIIa. Существуют отчеты об эффективности относительно низких доз препарата – 30–50 мкг/кг массы тела. Трансфузии лабильных компонентов крови или концентрата протромбинового комплекса не применяются. Фондапаринукс – пентасахаридный аналог гепарина, обладающий выраженной анти-FXa-активностью, но слабой анти-IIa-активностью. Связанное с ним кровотечение надо лечить как экстремальную форму кровотечения на фоне применения низкомолекулярного гепарина, которое не отвечает на введение протамина [5].
Прямые ингибиторы фактора Xa
Ривароксабан – новый пероральный антикоагулянт, по специфичности в отношении фактора (F) Xa подобный фондапаринуксу. В отличие от гепарина и его аналогов он действует не через антитромбин, а прямо – на фактор Xa. Ожидается, что благодаря удобному режиму приема (однократный ежедневный прием) ривароксабан найдет широкое применение в клинической практике как альтернатива варфарину. Ривароксабан аккумулируется при почечной и печеночной недостаточности. Эффект измеряется по протромбиновому времени (ПВ). Прямая инверсия антикоагулянтного эффекта в настоящее время невозможна. Для некоторого уменьшения всасывания недавно принятой дозы может использоваться активированный уголь. Трансфузия лабильных компонентов неэффективна. Удаление диализом ограниченно из-за высокого связывания с белком. В исследованиях с участием добровольцев показана эффективность протромбинового комплекса для устранения эффекта анти-FXa, однако режим для клинической практики еще не подобран. По результатам исследования также сделано предположение о возможной эффективности rFVIIa [6].
M.K. Körber и соавт. [7] использовали тромбоэластометрию и рутинные тесты коагуляции для оценки влияния на свертывание профилактических и терапевтических концентраций ривароксабана и инверсию их эффектов при введении концентрата протромбинового комплекса (prothrombin complex concentrate, PCC) и активированного рекомбинантного фактора VII (rFVIIa) in vitro. Ривароксабан растворяли в образцах крови и в эти образцы вносили PCC и rFVIIa в двух концентрациях, отслеживая влияние на гемокоагуляцию. Установлено, что ривароксабан дозозависимо увеличивал время свертывания, активированного тканевым фактором (tissue factor-activated clotting time, CTExTEM). АЧТВ и ПВ существенно изменялись при использовании обеих концентраций ривароксабана. Использование PCC в обеих дозах не вызывало существенных изменений исследуемых параметров. При использовании профилактической дозировки ривароксабана rFVIIa значительно изменил ПВ, но не CTExTEM и АЧТВ. При терапевтической дозе ривароксабана rFVIIa значительно уменьшал CTExTEM. Остальные параметры остались без изменений. Авторами сделаны выводы:
- тромбоэластометрия может использоваться для оценки эффектов ривароксабана;
- rFVIIa, в отличие от PCC, представляется весьма эффективным для инверсии эффектов ривароксабана in vitro [7].
В отличие от PCC и концентрата фибриногена rFVIIa также уменьшал время кровотечения на фоне приема апиксабана [8].
Прямые ингибиторы тромбина
FXa конвертирует протромбин в тромбин. Тромбин переводит фибриноген в фибрин, влияет на тромбоциты, антикоагуляцию и фибринолиз. Среди множества новых пероральных прямых ингибиторов тромбина в клиническую практику внедрен дабигатран. Этот препарат, как и ривароксабан, рассматривается как возможная замена варфарину и гепарину. Пик активности дабигатрана наступает через 2–3 часа после приема (если препарат принят с пищей – через 4–5 часов). Препарат быстро превращается в печени в активную форму. Полупериод циркуляции в плазме – 4–5 часов. Эффект измеряется по тромбиновому времени или АЧТВ, но не по МНО. Дабигатран на 80% выводится почками, соответственно, накапливается при почечной недостаточности. Как и ривароксабан, дабигатран следует отменять в случае развития острой почечной недостаточности на фоне регулярного приема. Связывание с белками незначительно, поэтому для удаления дабигатрана эффективны диализ и гемофильтрация. У пациентов с преднамеренной или случайной передозировкой пероральной дозы дабигатрана активированный уголь, принятый внутрь в течение 1–2 часов, может связывать невсосавшийся препарат. В будущем использование активированного угля в колонке для гемоперфузии может стать вариантом быстрого удаления дабигатрана. Трансфузия лабильных компонентов не играет специфической роли при кровотечении на фоне приема дабигатрана. Эффективен rFVIIa. Возможно, эффективен и протромбиновый комплекс [6].
В исследовании на животных показано, что концентраты протромбинового комплекса не уменьшают кровопотерю в случае кровотечения, развившегося на фоне приема дабигатрана [9].
Пероральные антитромбоцитарные препараты
Антитромбоцитарные препараты используются все шире, благодаря ангиопластике и стентированию. Ацетилсалициловая кислота (аспирин) ингибирует циклооксигеназу как в клетках эндотелия, так и в тромбоцитах, что снижает агрегацию тромбоцитов. В низких дозах полупериод циркуляции составляет около 5 часов. Аспирин метаболизируется преимущественно в печени. Ингибирование аспирином (в отличие от других нестероидных противовоспалительных средств, табл. 1) необратимо, и тромбоциты остаются нефункционирующими в течение их обычного существования – 10 дней. Тесты с агрегацией тромбоцитов не являются истинно количественными и не используются в клинической практике. Антитромбоцитарный эффект собственно аспирина относительно слаб, и польза трансфузии тромбоцитов в случае кровотечения на фоне приема аспирина не доказана.
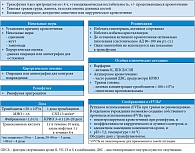
Тиенопиридины – клопидогрел и более новый препарат прасугрел – ингибируют тромбоцитарные рецепторы аденозиндифосфата (АДФ). Оба препарата подвергаются метаболизму в печени с образованием активных метаболитов. Полупериод циркуляции метаболита клопидогрела в плазме – 8 часов. Препарат с высокой аффинностью связывается с рецепторами АДФ, и тромбоциты ингибируются, как и в случае с аспирином, необратимо на срок до 10 дней после прекращения приема препарата. Антитромбоцитарный эффект клопидогрела так же трудно измерить. Еще более серьезную проблему представляет сочетанное использование аспирина и клопидогрела. В этом случае время кровотечения обычно выходит за пределы нормы, и риск кровотечения в случае оперативного лечения возрастает (принципы ведения больных с целью уменьшения периоперационной кровопотери см. в табл. 2). Самый распространенный подход к лечению таких кровотечений – переливать тромбоциты, несмотря на их нормальное количество. Известно также, что десмопрессин (1-desamino-8D-arginin vasopressin, DDAVP) снижает дисфункцию тромбоцитов (показано на добровольцах), предположительно за счет увеличения содержания фактора Виллебранда. Единственной альтернативой такому подходу является использование rFVIIa, который должен активировать тромбоциты путем генерации тромбина на их поверхности [10].
Внутривенные антитромбоцитарные препараты
Внутривенные антитромбоцитарные препараты используются при острой коронарной ишемии, а также в ходе ангиопластики и стентирования (табл. 3).
Абциксимаб – это гуманизированные мышиные Fab-фрагменты, которые плотно связываются с гликопротеиновыми IIb/IIIa рецепторами фибрина поверхности тромбоцитов. Абциксимаб является мощным антитромбоцитарным агентом с полупериодом активного действия 2–4 часа. В стандартных дозах препарат быстро связывается с рецепторами, при этом небольшое количество свободного препарата остается в плазме. В результате переливания тромбоцитов возрастает количество гликопротеиновых IIb/IIIa рецепторов, связанный с тромбоцитами препарат разбавляется и, по крайней мере частично, инвертирует антитромбоцитарный эффект. Занятость рецепторов медленно снижается до 50% в течение 24 часов, и к этому времени агрегация тромбоцитов возвращается к нормальным показателям.
Эптифибатид – пептид меньшего размера, с меньшим сродством к рецепторам АДФ. В отличие от абциксимаба этот препарат в достаточном количестве находится в плазме, что делает неэффективным переливание тромбоцитов, поскольку донорские тромбоциты свяжутся свободным препаратом. Полупериод выведения составляет 2–4 часа, препарат выводится в основном почками. Функция тромбоцитов возвращается к норме в течение 30 минут после прекращения инфузии, но при почечной недостаточности это время увеличивается.
Тирофибан имеет аналогичные характеристики. В случае высокого риска операции и кровотечения препаратом выбора следует считать абциксимаб. Продолжительности искусственного кровообращения может быть достаточно для восстановления функции тромбоцитов. Уменьшение стандартной дозы гепарина во время любой операции с искусственным кровообращением снижает выраженность кровотечения [11].
Фибринолитики
Фибринолитики используются для лизиса сформировавшихся свертков, наиболее часто – при остром инфаркте миокарда. Стрептокиназа активирует переход плазминогена в плазмин. Полупериод циркуляции в плазме короток. Рекомбинантный тканевый активатор плазминогена связывает фибрин и активирует переход плазминогена в плазмин. Полупериод циркуляции в плазме составляет лишь несколько минут. Оба эти препарата относительно специфичны к фибрину, но некоторое их количество связывается и с фибриногеном и лизирует его. Если в период выраженной гипофибриногенемии необходима операция или развивается кровотечение, то для противодействия остаточной фибринолитической активности вводят криопреципитат или концентрат фибриногена, возможно вместе с антифибринолитиками – апротинином или транексамовой кислотой [12].
Заключение
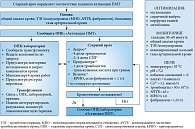
Рекомбинантный активированный фактор VII используют как «шунтирующий агент» в ситуациях, в которых специфическая инверсия эффекта антикоагулянта невозможна. Кроме того, его применение в рамках протокола массивной трансфузии (рис. 1 и 2) может являться предметом обсуждения у пациентов с различными критическими состояниями (например, при тяжелых акушерских, травматических и желудочно-кишечных кровотечениях – см. рис. 2).
Трансфузионная терапия не играет определяющей роли в инверсии антикоагулянтных эффектов многих препаратов. Свежезамороженная плазма используется только для борьбы с антикоагуляцией, вызванной варфарином, но и в этой ситуации является средством не первого, а второго выбора (после витамина K и протромбинового комплекса) [13].
Переливание тромбоцитов играет умеренную роль в присутствии антитромбоцитарных агентов, но при критическом кровотечении (например, внутричерепном) выходит на первый план (даже в отсутствие опубликованных доказательств) [14].
Во многих ситуациях применение антигемостатических агентов ведет к серьезному риску тромбозов. Задача клинициста – сбалансировать риск тромбоза, вероятность которого резко возрастает при ряде состояний (искусственный клапан сердца, анастомоз печеночной артерии в трансплантате печени и др.), и риск кровотечения [15].
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.