Рецепты женского здоровья: новый взгляд на старые проблемы. Сателлитный симпозиум компании «Пфайзер». Сателлитный симпозиум компании «Пфайзер»
- Аннотация
- Статья
- Ссылки




Согласно статистике, доля бесплодных браков в России составляет 8–15%1. До 40% случаев бесплодия приходится на эндокринный фактор1. При этом одна из наиболее частых причин эндокринного бесплодия – гиперпролактинемия. Существенное негативное влияние на здоровье будущих мам оказывают и генитальные кандидозы. По данным ряда авторов, среди всех инфекций влагалища вульвовагинальный кандидоз занимает второе место, уступая лишь бактериальному вагинозу2. Порядка 75% женщин репродуктивного возраста хотя бы раз столкнулись с этим заболеванием, а половина из них имели хотя бы один рецидив2. Заболевание опасно еще и тем, что размножение грибов особенно усиливается во время беременности.
Беременность и роды у пациенток с гиперпролактинемией
Детальному рассмотрению алгоритмов диагностики и лечения пациенток с гиперпролактинемией до и во время беременности было посвящено выступление члена-корреспондента РАМН Галины Афанасьевны МЕЛЬНИЧЕНКО (д. м. н., проф., зам. директора ЭНЦ МЗСР РФ по научной работе, директор Института клинической эндокринологии ЭНЦ МЗСР РФ).
Синдром гиперпролактинемии или гиперпролактинемического гипогонадизма является наиболее распространенной нейроэндокринной патологией. Количество больных варьируется от 214 тыс. до 2 млн человек, причем 80% случаев регистрируются у женщин в возрасте 25–40 лет. Причины повышения пролактина (ПРЛ) в сыворотке крови могут быть разнообразными и подразделяются на физиологические, патологические и фармакологические. Клинические проявления гиперпролактинемического гипогонадизма включают в себя репродуктивные, сексуальные, метаболические, эмоционально-личностные, а при макропролактиномах также и неврологические нарушения. Наиболее яркие клинические проявления развиваются в результате влияния ПРЛ на функцию половых желез. Так, гиперпролактинемический гипогонадизм у женщин выражается в различных нарушениях менструального цикла – вплоть до аменореи, приводит к развитию ановуляции и является одной из частых причин бесплодия. На сегодняшний день гиперпролактинемия отмечается у 20–25% бесплодных семей.
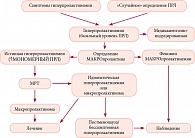
Основными диагностическими этапами при оценке гиперпролактинемического синдрома являются следующие: оценка клинической симптоматики, подтверждение и оценка выраженности гиперпролактинемии, установление причин ее возникновения. При диагностике синдрома гиперпролактинемии наряду с оценкой клинической симптоматики необходимо лабораторное подтверждение, а также оценка выраженности гиперпролактинемии с последующим определением генеза повышения содержания гормона. В отношении лабораторной диагностики гиперпролактинемии необходимо помнить, что существует ряд ситуаций, которые могут приводить к ошибкам в интерпретации результатов. Так, при подтверждении гиперпролактинемии целесообразно определять содержание макропролактина, в особенности пациентам с умеренно повышенным уровнем пролактина при отсутствии типичных клинических проявлений; а пациентам с макроаденомой гипофиза с выраженной клинической симптоматикой при нормально или незначительно повышенном уровне пролактина необходимо исключить эффект ложно-низких результатов в анализе при чрезвычайно высоких концентрациях гормона в сыворотке – феномен «hook effect».
После подтверждения стойкого повышения ПРЛ следует исключить возможные причины симптоматической гиперпролактинемии путем целенаправленного уточнения анамнеза, общеклинического обследования, биохимического анализа (для исключения почечной и печеночной недостаточности), определения уровня ТТГ. Женщины репродуктивного возраста с гиперпролактинемией не всегда знают о своей беременности или сообщают о ней лечащему врачу, поэтому перед продолжением обследования следует выполнить соответствующий тест. Если пациент принимает лекарственные препараты, способные вызвать гиперпролактинемию, следует определить, действительно ли повышение ПРЛ связано с приемом данных веществ, отменив их не менее чем на 72 ч (в случае когда это безопасно для пациента).
Диагноз пролактиномы устанавливается на основании лабораторного подтверждения стойкой гиперпролактинемии и выявления аденомы гипофиза при нейровизуализации. МРТ головного мозга проводится после исключения других возможных причин гиперпролактинемии. Алгоритм диагностики (рис. 1) предполагает скрупулезное исследование, конечной целью которого является уточнение генеза гиперпролактинемии и назначение адекватного лечения.
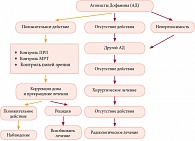
Не вызывает сомнения, что для подавляющего большинства пациентов, вне зависимости от генеза заболевания, предпочтительным методом выбора является терапия агонистами дофамина.
Показаниями к назначению данной терапии являются наличие макропролактиномы и в большинстве случаев микроаденом, бесплодие, стойкая галакторея, нарушение менструального цикла, нарушение полового созревания, предотвращение снижения минеральной плотности костной ткани в результате развития гипогонадизма у женщин, а также наличие аденомы гипофиза с неврологическими проявлениями (в том числе частичным нарушением зрения). Женщинам с умеренной гиперпролактинемией и сохраненным менструальным циклом при планировании беременности в ряде случаев также показано проведение терапии.
По словам Г.А. Мельниченко, процесс лечения пролактином достаточно длительный. Минимальная продолжительность терапии агонистами дофамина составляет 1 год. Если уровень ПРЛ сохраняется в пределах нормальных значений не менее 2 лет, а размер аденомы уменьшился более чем на 50%, можно постепенно уменьшить дозу агонистов дофамина, так как на данном этапе лечения малые дозы препарата позволяют поддержать стабильный уровень гормона и размер аденомы. Если на фоне проводимого лечения на протяжении не менее 3 лет отмечается нормальное содержание ПРЛ и значительно уменьшается размер аденомы, может быть предпринята попытка отмены препаратов. Такие пациенты должны находиться под строгим динамическим контролем, ввиду возможности рецидива гиперпролактинемии, увеличения опухоли, что потребует возобновления терапии. Как показал метаанализ ряда исследований, наименьшее число рецидивов наблюдается при терапии каберголином (Достинексом) при длительности лечения более двух лет.
Алгоритм критериев назначения, титрации, отмены терапии представлен на рис. 2.
У пациентов с идиопатической гиперпролактинемией об эффективности проводимого лечения судят, как правило, по нормализации уровня ПРЛ. Для пациентов с аденомами гипофиза целью лечения является также контроль размеров объемного образования. 80% пролактином на фоне терапии уменьшаются более чем на 25% от исходного объема, и почти у всех пациентов лечение позволяет снизить ПРЛ на 50%. В данной связи, хотя и нет единого определения понятия резистентности к терапии агонистами дофамина, наиболее распространен подход к понятию резистентности к терапии как невозможности достичь уменьшения объема аденомы на 50% и более. Уменьшение размеров опухоли, как правило, начинается через 1–2 недели от начала терапии, однако в некоторых случаях может начаться только через несколько месяцев лечения. Постепенное уменьшение опухоли может наблюдаться в течение многих месяцев и даже лет. Целесообразно проведение повторного МРТ через 2–3 мес. от начала терапии, а в дальнейшем уже через более длительные интервалы. У ряда больных прием агонистов дофамина позволяет восстановить гонадную функцию, несмотря на сохраняющееся повышение ПРЛ. Для таких пациентов именно клиническая эффективность, а не абсолютные цифры ПРЛ играет первостепенную роль при определении доз препаратов. В то же время в рутинной клинической практике для пациенток, не планирующих на данный момент беременность, исследование гонадной функции, подразумевающее контроль овуляции, может быть затруднительно и финансово не оправдано. В связи с этим наиболее доступным показателем эффективности терапии остается нормализация уровня ПРЛ.
Показаниями к проведению хирургического вмешательства являются: резистентность к терапии агонистами дофамина, непереносимость терапии, неврологические нарушения при отсутствии эффекта от консервативного лечения (компрессия хиазмы, прорастание аденомы в сфеноидальный синус и ликворея), а также пожелания пациента. Другими показаниями к хирургическому лечению являются апоплексия макроаденомы с неврологическими проявлениями, кистозные макроаденомы с неврологическими осложнениями (которые, несмотря на проводимую терапию, как правило, не уменьшаются). Лучевая терапия используется крайне редко и ассоциирована с высокой частотой развития побочных эффектов, включая гипопитуитаризм, повреждение зрительных нервов и другие неврологические осложнения, увеличение риска инсультов и вторичных опухолей головного мозга. Лучевая терапия не рассматривается в качестве первичного и единственного метода лечения пролактином, но может быть использована у пациентов, резистентных к медикаментозной терапии, у которых было неэффективно хирургическое вмешательство, а также в редких случаях злокачественных аденом.
В результате лечения достигается нормализация уровня ПРЛ, восстановление фертильности, контроль роста аденомы, устраняются психо-вегетативные, эндокринно-обменные и эмоционально-личностные нарушения.
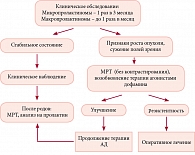
Согласно Международному руководству, агонисты дофамина в настоящее время рекомендованы для коррекции гиперпролактинемии при наличии показаний. При этом использование каберголина является предпочтительным вследствие более высокой эффективности в отношении нормализации уровня пролактина, а также уменьшения размера опухолей8. Поскольку основной целью терапии зачастую является восстановление фертильности, вопрос о планировании беременности на фоне медикаментозного лечения представляет особый интерес. В настоящее время каберголин (Достинекс), как и бромокриптин, – препараты, разрешенные во время планирования беременности. Выработан определенный алгоритм ведения пациенток с пролактиномами во время беременности (рис. 3). При наступлении беременности у больных с микроаденомами гипофиза агонисты дофамина должны быть отменены, поскольку риск роста опухоли низок и составляет 2–3%. Клиническое обследование беременных с микроаденомами выполняют 1 раз в 3 месяца, МРТ и измерение полей зрения целесообразно проводить после родов. У больных с макропролактиномами риск роста опухоли выше (15–30%), чем у больных с микропролактиномами, поэтому планирование беременности возможно лишь после нормализации уровня ПРЛ, уменьшения опухоли по данным МРТ в динамике и после проведения терапии агонистами дофамина минимум в течение года до зачатия.
При наступлении беременности терапию АД следует отменить и продолжить наблюдение в виде ежемесячного клинического обследования, МРТ, измерения полей зрения. При появлении признаков значимого роста опухоли на МРТ, сужении полей зрения рекомендуется возобновить терапию АД.
Пациенткам с гиперпролактинемией во время беременности нет необходимости контролировать уровень пролактина, поскольку отмечается его физиологическое повышение в 10–20 раз, и оно не коррелирует с ростом аденомы. Синдром гиперпролактинемии и применение АД также не являются противопоказаниями при подготовке к экстракорпоральному оплодотворению (ЭКО) пациенток с гиперпролактинемией.
«Когда пациентка с гиперпролактинемией впервые начинает прием агонистов дофамина, она должна быть информирована о том, что восстановление овуляции и фертильности может наступить незамедлительно (даже до восстановления менструального цикла), – подчеркнула проф. Г.А. Мельниченко. – Эффективность применения агонистов дофамина для восстановления фертильности очень высока: восстановление овуляции и/или наступление беременности происходит в течение полугода у 52% пациенток с синдромом гиперпролактинемии при приеме агониста дофамина первого поколения бромокриптина и у 72% пациенток при приеме агониста дофамина третьего поколения каберголина (Достинекса), а при увеличении продолжительности терапии каберголином до 10 месяцев – у 90%».
Безусловно, клиницистам важно знать, насколько безопасна терапия АД для лечения гиперпролактинемии, а также как влияет заболевание на течение и исходы беременности. В 2008 г. вышла публикация A. Сolao и соавт.4, описывающая исходы индуцированных каберголином беременностей и состояние здоровья детей на протяжении до 12 лет. Это исследование также продемонстрировало отсутствие какого-либо отрицательного эффекта от приема препарата. В 2010 г. опубликована работа M. Lebbe и соавт.5, где описаны течение и исходы беременностей еще 100 женщин, принимавших каберголин до момента зачатия. На настоящий момент всего накоплено 663 случая наблюдений таких пациенток, и результаты этих наблюдений подтвеждают 12-летние данные об отсутствии повышения частоты спонтанных абортов, преждевременных родов и многоплодных беременностей4, 6, 7. Эти данные свидетельствуют о том, что каберголин (Достинекс) может успешно использоваться при планировании беременности у женщин с гиперпролактинемией, не оказывая тератогенного эффекта и негативного влияния на здоровье матери, а беременность, индуцированная каберголином, не является показанием к ее прерыванию.
Вульвовагинальный кандидоз – взгляд клинициста
Вопросы диагностики и терапии одной из наиболее распространенных причин вагинитов – вульвовагинального кандидоза (ВВК) – осветила проф. Вера Николаевна ПРИЛЕПСКАЯ (д. м. н., зам. директора по научной работе ФГУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» МЗСР РФ).
«Число грибковых заболеваний, в том числе и вульвовагинального кандидоза (ВВК), растет в геометрической прогрессии и составляет 30% среди всех заболеваний нижнего отдела гениталий, – отметила В.Н. Прилепская. – Это диктует необходимость более тщательного изучения данной проблемы». Рост заболеваемости вульвовагинальным кандидозом обусловлен целым рядом провоцирующих факторов, среди которых длительное и бесконтрольное применение антибиотиков, кортикостероидов, высокодозированных гормональных контрацептивов, патология, ассоциированная с подавленным иммунным ответом. Факторами риска развития заболевания являются ношение тесной одежды, несоблюдение гигиенических условий и многое другое.
В последнее время увеличивается число больных вульвовагинальным кандидозом, который регистрируется не только как самостоятельное заболевание, но и как сопутствующее другим инфекциям. Известно, что возбудителем кандидоза являются дрожжеподобные грибы рода Candida. При этом главенствующая роль в этиологии данного заболевания отводится Candida albicans. Candida albicans выступает в качестве этиологического фактора ВВК в 76–89% случаев и остается наиболее частой причиной заболевания. Однако в последнее время, как отметила докладчик, все чаще стали выявляться случаи урогенитального кандидоза, вызванные Candida non-albicans видами, как, например, Candida tropicalis, Candida glabrata и другие. «К сожалению, Candida non-albicans виды, чаще ассоциирующиеся с рецидивирующим вульвовагинальным кандидозом, с кандидозом на фоне сахарного диабета, у пациентов с ВИЧ-инфекцией или в постменопаузе, хуже поддаются терапии азоловыми антимикотиками, в то время как Сandida albicans – основной возбудитель – демонстрирует высокую чувствительность к флуконазолу и другим азоловым антимикотикам», – подчеркнула проф. В.Н. Прилепская.
В настоящее время в мире используют следующую классификацию вульвовагинального кандидоза (табл. 1): неосложненным называют форму ВВК, характеризующуюся спорадическими или нечастыми (< 4/год) эпизодами с легкими или умеренными проявлениями заболевания, вызванного C. albicans, у женщин с нормальным иммунным ответом (иммунокомпетентных). К осложненному ВВК относят рецидивирующий ВВК, или ВВК тяжелого течения (по выраженности вульвовагинита), или ВВК, вызванный Candida non-albicans, а также ВВК, возникший у иммунокомпрометированных пациентов (беременность, иммуносупрессия, декомпенсированный сахарный диабет и др.). Рецидивирующим ВВК называют ≥ 4 эпизодов симптомного, острого вагинита, вызванного Candida в течение 12 мес. Более чем у 20–25% женщин в составе вагинальной флоры имеются C. albicans без симптомов болезни, что называется кандидоносительством. При микробиологическом исследовании в отделяемом влагалища могут быть в небольшом количестве (выделение Candida 1 х 102 КОЕ/мл при отсутствии клиники) обнаружены формы дрожжеподобных грибов.
Причины рецидивов ВВК до сих пор остаются предметом дискуссии. Существуют две основные гипотезы, которые описывают рецидив и реинфекцию, связанную с неполной элиминацией возбудителя. Остается дискуссионным вопрос о реинфекции влагалища Candida из желудочно-кишечного тракта или других источников и, соответственно, целесообразности терапии экстрагенитальных очагов при ВВК.
Постановка диагноза вульвовагинального кандидоза обязана базироваться на данных клинико-лабораторных методов исследования, в первую очередь на микробиологических методах, которые включают в себя оценку результатов культуральной диагностики и микроскопии мазков.
Каждой форме ВВК должна соответствовать своя тактика лечения. Показанием к терапии является наличие симптомов среди пациентов с определением грибов рода Candida при бактериоскопии или посеве на среду. В отсутствие симптоматики лечение не целесообразно, то есть кандидоносительство не требует лечения антимикотиками. Тем не менее при наличии таких факторов, как беременность, инвазивные вмешательства, целесообразно проводить профилактическое лечение, чтобы предотвратить переход кандидоносительства в клинически выраженную форму заболевания. По словам В.Н. Прилепской, именно при вульвовагинальном кандидозе наиболее часто отмечаются самолечение, недооценка клинических проявлений, неправильный подход к лечению рецидивов заболевания, к определению тактики ведения больных, причем как вне беременности, так и во время нее.
Классификация противогрибковых препаратов насчитывает более 30 наименований. Для лечения ВВК используются следующие лекарственные средства: препараты полиенового ряда (нистатин, леворин и др.), имидазолового ряда (клотримазол, миконазол, омоконазол и др.), препараты триазолового ряда (флуконазол, итраконазол) и другие (препараты йода, флуцитозин, нитрофунгин и др.). В настоящее время для терапии ВВК применяют как топические, так и системные агенты. Из всего арсенала антимикотиков широкое применение в лечении ВВК нашли препараты, хорошо зарекомендовавшие себя в клинической практике. К таким лекарственным средствам относится класс триазольных соединений, в том числе препараты, содержащие флуконазол (оригинальный препарат Дифлюкан). По данным многочисленных исследований, лечение азоловыми антимикотиками позволяет как купировать симптомы, так и достичь отрицательного результата бактериологического исследования у 80–90% пациентов с неосложненным ВВК1, 2, 3, 4. Для купирования эпизода тяжелого вульвовагинита (выраженная эритема, отек, экскориации и трещины слизистой) рекомендована более длительная терапия топическими агентами (7–14 дней), либо две последовательные дозы флуконазола 150 мг (вторая через 72 часа после первой)2, 3. Рецидивирующий ВВК (≥ 4 эпизодов в год) представляет трудности в лечении, так как чаще, чем другие формы, вызывается Candida non-albicans, которые менее чувствительны к терапии азоловыми антимикотиками. Для ВВК, вызванного Candida non-albicans, нет оптимального режима терапии. Согласно международным рекомендациям, следует увеличить продолжительность лечения азоловыми антимикотиками (за исключением флуконазола)2, также могут быть рекомендованы интравагинальные формы борной кислоты1, суппозитории амфотерицина В1, 3. При подтверждении Candida albicans форм рецидивирующего ВВК, согласно международным рекомендациям, следует применять тактику купирования обострения с последующей поддерживающей терапией. На примере флуконазола могут быть рекомендованы две последовательные дозы флуконазола (вторая через 72 часа после первой), затем супрессивное лечение 150 мг флуконазола еженедельно в течение 6 мес.1, 2, 3, 4. Данная схема терапии обоснована такими фармакокинетическими особенностями флуконазола (Дифлюкана), как его водорастворимость и низкое связывание с белками, что позволяет обеспечить быструю пенетрацию и высокие концентрации в тканях и секрете вагины, а также длительный период полувыведения из тканей вагины. Последнее в свою очередь дает возможность поддерживать минимальную ингибирующую концентрацию большинства штаммов C. albicans на 96 ч (4 дня), в последующие 3 дня постантифунгицидный эффект позволяет предотвратить рост оставшихся организмов. Данные особенности флуконазола лежат в основе высокой эффективности описанной выше схемы терапии (еженедельного приема), которая, по данным литературы, позволяет поддерживать отсутствие симптомов и отрицательные результаты бактериологического исследования более чем у 90% пациентов во время лечения1, 2 , 3, 4.
В заключение Вера Николаевна Прилепская еще раз акцентировала внимание участников симпозиума на том, что выбор лекарственного препарата в каждом конкретном случае должен зависеть от возбудителя (Саndida albicans/non-albicans), тяжести клинического течения заболевания, частоты рецидивов (более или менее 4 в год), наличия микстинфекции и сопутствующих состояний (беременность, ВИЧ, сахарный диабет и др.). Необходимо учитывать, что только комплексный подход к данной проблеме позволит повысить эффективность лечения ВВК.
Фунгицидная активность флуконазола: новые данные
Очевидно, что успех лечения генитальных кандидозов зависит от выбора эффективного антимикотика. О результатах исследований по оценке фунгицидной активности анимикотиков на основе флуконазола рассказала проф. Татьяна Михайловна ЖЕЛТИКОВА (д. б. н., зав. Лабораторией НИИ вакцин и сывороток им. И.И. Мечникова РАМН).
Флуконазол – антимикотик для системного применения. Препараты на его основе особенно хорошо зарекомендовали себя при лечении микозов, вызванных дрожжами рода Candida. По биохимической структуре флуконазол является производным триазола и функционально работает как высокоактивный селективный ингибитор синтеза стеролов в клетках грибов. Как и другие препараты группы азолов, флуконазол угнетает образование эргостерола, основного компонента клеточной мембраны грибов. В низких концентрациях флуконазол нарушает биосинтез клеточной мембраны грибов, что приводит к развитию фунгистатического эффекта (задержке роста). При достижении высоких концентраций вследствие перекисного окисления и других процессов в клетке происходит гибель гриба (фунгицидный эффект).
На фармакологическом рынке в значительном количестве представлены дженерики, в состав которых входит флуконазол. Как правило, препараты-дженерики должны быть эквивалентны оригинальному препарату по действующему веществу, фармакологическим показателям и терапевтической эффективности. Однако они могут отличаться по составу дополнительных веществ, способу синтеза действующего вещества и другим параметрам. «В связи с тем, что дженерики положено сравнивать с оригинальным препаратом по разным параметрам, целью нашего исследования было оценить in vitro фунгицидную активность антимикотиков на лабораторных культурах Candida albicans, Candida glabrata и Сandida parapsilosis», – пояснила проф. Т.М. Желтикова. В работе были использованы оригинальный препарат Дифлюкан, содержащий флуконазол, а также ряд дженериков флуконазола. Препараты исследовались в двух концентрациях: 150 мг/мл и 2 мг/мл. В качестве контроля применялся оригинальный препарат Дифлюкан для внутривенного введения в концентрации 2 мг/мл. Работа проводилась двойным слепым методом, каждый эксперимент имел трехкратную повторность. Зоны ингибиции роста грибов измеряли в миллиметрах. Чем больше зона ингибиции роста гриба, тем выше фунгицидная активность препарата.
При изучении фунгицидной активности препарата Дифлюкан и различных дженериков выяснилось, что этим свойством обладают все исследуемые препараты, однако проявляется оно в различной степени. При сравнительном изучении различных препаратов, содержащих флуконазол, наибольшую статистически достоверную фунгицидную активность на всех трех модельных видах дрожжей, как при максимальной, так и при минимальной концентрации, показал оригинальный препарат, то есть Дифлюкан. Как отметила проф. Т.М. Желтикова, наиболее чувствительными к Дифлюкану видами оказались C. albicans и C. parapsilosis. Дифлюкан также статистически достоверно более сильно подавляет рост C. glabrata, чем исследованные дженерики.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.