Резистентность Helicobacter pylori к кларитромицину в Российской Федерации
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Поиск исследований проводился в электронных базах данных MEDLINE/PubMed, EMBASE, Cochrane, Российский индекс научного цитирования, опубликованных в период с января по сентябрь 2020 г. В финальный анализ вошли оригинальные публикации из периодических рецензируемых зарубежных и российских изданий, а также диссертационные работы, в которых применялись валидированные тесты оценки резистентности H. pylori с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ.
Результаты. В итоговый анализ было включено 16 исследований (1227 изолятов). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95%-ный доверительный интервал (ДИ) 7,315–17,302; I2 = 86,19%). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I2 = 61,29%). В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину составил 10,87% (95% ДИ 7,280–15,439; I2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I2 = 45,22%).
Заключение. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в России не превышает регламентированный консенсусом Маастрихт-V порог 15%. Это позволяет рассматривать тройную схему противохеликобактерной терапии с кларитромицином в качестве терапии первой линии. Вместе с тем для достижения максимального эффекта при использовании классической тройной терапии и нивелирования риска дальнейшего прогрессирования кларитромициновой резистентности H. pylori в России целесообразно применять методы ее оптимизации.
Материал и методы. Поиск исследований проводился в электронных базах данных MEDLINE/PubMed, EMBASE, Cochrane, Российский индекс научного цитирования, опубликованных в период с января по сентябрь 2020 г. В финальный анализ вошли оригинальные публикации из периодических рецензируемых зарубежных и российских изданий, а также диссертационные работы, в которых применялись валидированные тесты оценки резистентности H. pylori с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ.
Результаты. В итоговый анализ было включено 16 исследований (1227 изолятов). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95%-ный доверительный интервал (ДИ) 7,315–17,302; I2 = 86,19%). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I2 = 61,29%). В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину составил 10,87% (95% ДИ 7,280–15,439; I2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I2 = 45,22%).
Заключение. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в России не превышает регламентированный консенсусом Маастрихт-V порог 15%. Это позволяет рассматривать тройную схему противохеликобактерной терапии с кларитромицином в качестве терапии первой линии. Вместе с тем для достижения максимального эффекта при использовании классической тройной терапии и нивелирования риска дальнейшего прогрессирования кларитромициновой резистентности H. pylori в России целесообразно применять методы ее оптимизации.

Введение
В настоящее время инфекция Helicobacter pylori остается одним из ведущих этиологических факторов заболеваний гастродуоденальной зоны, включая хронический гастрит, язвенную болезнь желудка и двенадцатиперстной кишки, а также рак (аденокарциному) желудка [1, 2]. Согласно последнему систематическому обзору, 44,3% (95%-ный доверительный интервал (ДИ) 40,9–47,7) мировой популяции инфицировано H. pylori [3]. По некоторым данным, Российская Федерация относится к странам с высокой распространенностью инфекции H. pylori в популяции в целом [4]. Так, согласно метаанализу J.K.Y. Hooi и соавт. (2017 г.), в нашей стране H. pylori инфицировано 78,5% (95% ДИ 67,1–89,9) населения, или более 112 млн человек [4]. Вместе с тем следует отметить, что в последнее время стали появляться публикации, демонстрирующие тренд к снижению распространенности инфекции H. pylori в Российской Федерации. Так, по данным D. Bordin и соавт. (2020 г.), полученным во всех федеральных округах России с использованием 13С-уреазного дыхательного теста, распространенность инфекции H. pylori составляла 42,5% в 2017 г. и 35,3% – в 2019 г. [5].
В последних европейских и североамериканских рекомендациях по диагностике и лечению инфекции H. pylori сказано, что эрадикационная терапия (ЭТ) должна назначаться всем инфицированным взрослым пациентам, а выбор схемы лечения носит дифференцированный характер в зависимости от уровня региональной резистентности микроорганизма к кларитромицину и метронидазолу [6, 7]. В частности, экспертный совет консенсуса Маастрихт-V (2015 г.) не рекомендует использовать тройную схему противохеликобактерной терапии с кларитромицином в регионах, где показатель резистентности H. pylori к данному антибактериальному препарату превышает пороговый уровень 15% [6]. Между тем тройная противохеликобактерная терапия с кларитромицином, внедренная в клиническую практику в 1995 г., остается одной из наиболее распространенных схем ЭТ как во всем мире, так и в нашей стране [8–10]. Согласно последним клиническим рекомендациям Российской гастроэнтерологической ассоциации (2018 г.) по диагностике и лечению инфекции H. pylori у взрослых, тройная терапия с кларитромицином регламентируется в качестве терапии первой линии [11]. Тем не менее метаанализы 2020 г. демонстрируют, что частота неэффективного лечения при использовании данной комбинации высока – около 25–30% [12, 13]. Такой негативный тренд обусловлен ростом количества резистентных штаммов H. pylori к кларитромицину, который наблюдается в последние годы во многих регионах мира [14, 15].
Метаанализ Y. Zou и соавт. (2020 г.), обобщивший результаты 120 исследований (28 707 пациентов), показал, что наличие резистентности H. pylori к кларитромицину значительно снижает эффективность ЭТ первой линии (отношение шансов (ОШ) 0,682; 95% ДИ 0,636–0,731) [16]. В систематическом обзоре G.G. Kasahun и соавт. (2020 г.) обобщенный показатель первичной резистентности H. pylori к кларитромицину в мире составил 27,22% (95% ДИ 25,89–28,58), в Европейском регионе – 31,25% (95% ДИ 25,88–37,17) [17]. При этом метааналитических данных о частоте резистентности H. pylori к кларитромицину, позволяющих объективизировать данные об антибиотикорезистентности и приоритетном выборе схемы ЭТ в России, в настоящий момент нет. В отдельных работах, проведенных за последние 20 лет в нашей стране, показатели резистентности H. pylori к кларитромицину превышают 15%-ный пороговый уровень, установленный консенсусом Маастрихт-V [18–20].
Основной целью настоящего метаанализа стала систематизация данных резистентности H. pylori к кларитромицину в Российской Федерации.
Методы
Поиск исследований
Поиск исследований проводили в электронных базах данных MEDLINE/PubMed, EMBASE, Cochrane, Российский индекс научного цитирования (РИНЦ). В указанных базах нами анализировались заголовки и абстракты. Для поиска использовалась комбинация ключевых слов «Helicobacter pylori», «H. pylori» или «pylori», «резистентность», «устойчивость» или «чувствительность», а также их аналоги на английском языке (для поиска в международных базах данных). Осуществлялся поиск работ, опубликованных в период с января по сентябрь 2020 г.
Критерии отбора исследований
Критериями включения в метаанализ были оригинальные публикации в периодических рецензируемых зарубежных и российских изданиях, а также защищенные диссертационные работы, оригинальные публикации и диссертации с подробной описательной статистикой, позволяющей включить результирующие данные в метаанализ, исследования с применением валидированных тестов оценки резистентности H. pylori (метод серийного разведения, диско-диффузионный метод, молекулярно-генетический метод). В случае обнаружения дублирования результатов между двумя публикациями (из разных или одной электронной базы данных) в финальный анализ отбиралась только одна. Оценка методологического качества каждого из включенных в метаанализ исследований проводилась с использованием Newcastle-Ottawa Scale (NOS).
Статистический анализ
Статистическая обработка данных осуществлялась с помощью специального программного обеспечения MedCalc 19.5.3 (Бельгия) в среде Microsoft Windows 10 (США). Результаты представлены в виде обобщенной частоты резистентности H. pylori к кларитромицину (в процентах) и 95%-ного доверительного интервала (95% ДИ). Гетерогенность между различными работами оценивали по критериям Cochrane’s Q и I2. При р < 0,05 и I2 > 50 констатировалось наличие значимой гетерогенности. Вероятность наличия публикационной ошибки оценивали с помощью воронкообразной диаграммы рассеяния, а также на основании расчета корреляционного теста Бегга – Мазумдара и теста регрессии Эггера.
Результаты
Поиск исследований
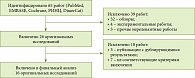
Поиск в электронных базах данных выявил 65 работ для последующего анализа. Из них 39 исследований было исключено, поскольку они не являлись оригинальными работами (32 – обзоры, четыре – экспериментальные исследования, три – прочие нерелевантные работы). Отобранные 26 работ детально проанализированы на соответствие критериям включения, после чего десять исследований были исключены (рис. 1). В итоге 16 оригинальных исследований вошли в настоящий метаанализ (табл. 1) [18–33].
Характеристика отобранных исследований
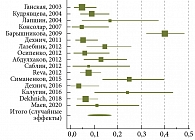
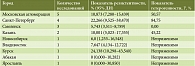
В итоговый анализ было включено 16 исследований (1227 изолятов), выполненных в Москве и Московской области (n = 5) [21–23, 26, 33], Санкт-Петербурге (n = 4) [18, 19, 22, 29], Смоленске (n = 3) [25, 31, 33], Новосибирске (n = 1) [27], Казани (n = 2) [24, 28], Ярославле (n = 1) [33], Курске (n = 1) [20] и Владивостоке (n = 1) [30]. В качестве методики определения чувствительности H. pylori к антибактериальным препаратам в семи исследованиях использовали метод серийных разведений [19, 22, 23, 25, 30–32], в пяти – молекулярно-генетический метод [18, 20, 25, 26, 28], в четырех – диффузионную методику [21, 23, 24, 29].
Резистентность H. pylori к кларитромицину в России
В итоговом анализе использовали модель случайных эффектов, поскольку была выявлена значительная гетерогенность между результатами включенных в метаанализ исследований (p < 0,0001; I2 = 86,19%). Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации составил 11,85% (95% ДИ 7,315–17,302) (рис. 2). При анализе работ, опубликованных за последние десять лет, резистентность H. pylori к кларитромицину составила 10,39% (95% ДИ 7,103–14,219; I2 = 61,29%).
Дополнительно нами была рассчитана резистентность H. pylori к кларитромицину в отдельных агломерациях и городах России. В Москве и Московской области обобщенный показатель резистентности H. pylori к кларитромицину достиг 10,87% (95% ДИ 7,280–15,439; I2 = 50,57%), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470; I2 = 84,75%), Смоленске – 5,74% (95% ДИ 3,511–8,789; I2 = 0,00%), Казани – 10,0% (95% ДИ 5,023–17,355; I2 = 45,22%) (табл. 2).
При оценке исследований, выполненных молекулярно-генетическим методом, показатель резистентности H. pylori к кларитромицину составил 19,08% (95% ДИ 7,781–33,905; I2 = 89,62%), тогда как при использовании методов серийных разведений и диффузионных методик – 8,39% (95% ДИ 5,891–11,305; I2 = 48,67%).
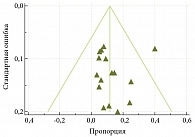
Вероятность наличия публикационного смещения оценивали с помощью воронкообразной диаграммы рассеяния, а также на основании расчета теста Бегга – Мазумдара и теста регрессии Эггера. При визуальном анализе воронкообразной диаграммы рассеяния (рис. 3) существенной асимметрии не выявлено. Помимо этого наличие значимого публикационного смещения исключено по результатам теста Бегга – Мазумдара (p = 0,1357) и теста регрессии Эггера (p = 0,9183).
Обсуждение
Клиническое значение устойчивости H. pylori к кларитромицину для практической гастроэнтерологии существенно возросло за последние 15 лет [5, 14, 15]. Резистентность H. pylori к данному антибактериальному препарату детерминируется точечными хромосомными мутациями в регионе, кодирующем пептидил-трансферазу (основную мишень макролидов) в V домене 23S рРНК [33, 34]. Наиболее распространенными вариациями таких мутаций является замена нуклеотидных последовательностей в позициях 2142 (A2142G и A2142С), 2143 (A2143G) [34, 35]. Замещение нуклеотидов в данных последовательностях приводит к снижению аффинности всей группы макролидов, в состав которой входит в том числе кларитромицин, к рибосомам бактериальной клетки. Как следствие, формируется резистентность [34]. Согласно метаанализу A. Savoldi и соавт. (2018 г.), наличие резистентности H. pylori к кларитромицину многократно увеличивает риск неэффективной эрадикации при использовании кларитромицин-содержащих протоколов лечения (ОШ 6,97; 95% ДИ 5,23–9,28; p < 0,001) [36]. В соответствии с консенсусом Маастрихт-V, в регионах с низким уровнем резистентности H. pylori к кларитромицину (< 15%) тройная терапия с данным антибактериальным препаратом продолжает рассматриваться в качестве терапии первой линии и может назначаться эмпирически [5]. Вместе с тем, по данным последних систематических обзоров и метаанализов, в Европе обобщенный показатель резистентности H. pylori к кларитромицину в зависимости от выборки исследований варьируется от 18 (95% ДИ 16–20) до 31,2% (95% ДИ 25,9–37,2) [17, 36].
Настоящий метаанализ, обобщивший результаты 16 исследований резистентности H. pylori к кларитромицину в Российской Федерации, продемонстрировал, что обобщенная устойчивость H. pylori к данному антибактериальному препарату составляет 11,85% (95% ДИ 7,315–17,302; I2 = 86,19%). Полученные показатели резистентности H. pylori к кларитромицину ниже показателей, выявленных в европейских метаанализах. Это подтверждает позицию экспертов Российской гастроэнтерологической ассоциации, изложенную в клинических рекомендациях 2018–2020 гг., регламентирующую актуальность применения классической тройной противохеликобактерной терапии с кларитромицином в качестве эрадикационного протокола первой линии в нашей стране [11, 37]. Тем не менее обращает на себя внимание тот факт, что эффективность классической тройной терапии в реальной клинической практике в России относительно низка. Это создает определенный диссонанс с полученными в настоящем метаанализе данными. Так, по данным Европейского регистра ведения инфекции H. pylori (Hp-EuReg, 2020 г.), эффективность эрадикации при использовании 10–14-дневной тройной терапии в Москве при анализе ITT (intention-to-treat) достигает 70–79% [38]. По последним данным, такой субоптимальный профиль эффективности классической тройной терапии характерен для большинства регионов Европы [39]. Таким образом, для достижения максимальной эффективности лечения при использовании классической тройной терапии и нивелирования риска дальнейшей прогрессии резистентности H. pylori к кларитромицину в Российской Федерации целесообразно использовать методы ее оптимизации, регламентированные Российской гастроэнтерологической ассоциацией и позволяющие повысить эффективность стандартной тройной терапии [11]:
- подробное инструктирование пациента и контроль за точным соблюдением назначенного режима приема лекарственных средств;
- пролонгация курса лечения до 14 дней;
- назначение дважды в день повышенной дозы ингибиторов протонной помпы (ИПП) (удвоенной по сравнению со стандартной);
- использование ИПП последних поколений (рабепразол и эзомепразол);
- добавление к стандартной тройной терапии висмута трикалия дицитрата (240 мг два раза в сутки);
- добавление к стандартной тройной терапии цитопротектора ребамипида (100 мг три раза в сутки).
Следует отметить, что, по данным Европейского регистра ведения инфекции Helicobacter pylori (Hp-EuReg), основной схемой в России в 2013–2018 гг. считалась тройная терапия (ИПП, кларитромицин, амоксициллин), которая назначалась в 62,8–68,9% случаев. При этом наблюдалась тенденция к увеличению частоты назначения тройной терапии с добавлением висмута трикалия дицитрата (с 28,4 до 35,8%). Квадротерапия (ИПП, тетрациклин, метронидазол, висмута трикалия дицитрат) назначалась 0,5–7,8% больных. Эффективность 14-дневной тройной терапии у завершивших прием препаратов (per protocol, PP) составила 85%, при анализе начавших терапию (ITT) – 66%. Это свидетельствует о недостаточной эффективности тройной терапии. При добавлении к тройной терапии висмута трикалия дицитрата эффективность 14-дневного курса РР достигла 96%, ITT – 89% [40]. Подобные данные получены и при анализе международной когорты больных регистра Hp-EuReg [41].
В данном метаанализе имеется несколько недостатков. В частности, общий пул проанализированных изолятов относительно небольшой по сравнению с таковым в аналогичных метааналитических работах, проведенных во многих странах Европы, Северной Америки и Азии. Кроме того, имеется существенная гетерогенность между включенными исследованиями, заключающаяся в различных методиках определения чувствительности H. pylori к кларитромицину. На наш взгляд, интерпретация результатов данного метаанализа должна проводиться осторожно с учетом показателей эффективности классической тройной терапии в конкретном регионе нашей страны. Вместе с тем это первая работа подобного дизайна, позволяющая приблизиться к объективизации показателя резистентности H. pylori к кларитромицину в России. С учетом динамично меняющегося паттерна антибиотикорезистентности H. pylori эти данные требуют перманентной актуализации за счет проведения более крупных многоцентровых исследований с анализом значительно большего количества изолятов во всех федеральных округах нашей страны.
Заключение
Настоящий метаанализ представляет собой первую аналитическую работу, которая позволяет объективизировать уровень резистентности H. pylori к кларитромицину в Российской Федерации. Полученные результаты свидетельствуют о том, что устойчивость H. pylori к кларитромицину в нашей стране не превышает регламентированный консенсусом Маастрихт-V пороговый уровень 15%. Таким образом, тройную схему противохеликобактерной терапии с кларитромицином можно рассматривать в качестве терапии первой линии. Тем не менее для достижения максимальной эффективности лечения при использовании классической тройной терапии и нивелирования риска дальнейшей прогрессии резистентности H. pylori к кларитромицину в Российской Федерации целесообразно применять методы ее оптимизации.
Авторы заявляют об отсутствии конфликта интересов.
I.V. Mayev, RASci Academiam, PhD, Prof., D.N. Andreyev, PhD, D.S. Bordin, PhD, Prof., Yu.A. Kucheryavy, PhD, L.V. Kudryavtseva, PhD, Prof., Ye.S. Vyuchnova, PhD, Ye.G. Lebedeva, PhD, A.K. Fomenko, D.T. Dicheva, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific Center
Tver State Medical University
City Clinical Hospital № 40
Contact person: Dmitry N. Andreyev, dna-mit8@mail.ru
Purpose – the systematization of data on the resistance of Helicobacter pylori to clarithromycin in the Russian Federation.
Material and methods. Necessary investigations were searched in the electronic databases MEDLINE/PubMed, EMBASE, Cochrane, and the Russian Science Citation Index (RSCI), published between January and September, 2020. The final analysis included original publications from periodically reviewed foreign and Russian publications, as well as dissertations that used validated H. pylori resistance assessment tests with detailed descriptive statistics that allow the resulting data to be included in the meta-analysis.
Results. The final analysis included 16 studies (1227 isolates). The generalized indicator of H. pylori resistance to clarithromycin in the Russian Federation was 11.85% (95% confidence interval (CI) 7.315–17.302; I2 = 86.19%). When analyzing papers published over the past ten years, H. pylori resistance to clarithromycin was 10.39% (95% CI 7.103–14.219; I2 = 61.29%). In Moscow and the Moscow Region, the generalized indicator of H. pylori resistance to clarithromycin was 10.87% (95% CI 7,280–15,439; I2 = 50.57%), in St. Petersburg – 22.26% (95% CI 9,525–38,470; I2 = 84.75%), Smolensk – 5.74% (95% CI 3,511–8,789; I2 = 0.00%), Kazan – 10.0% (95% CI 5,023–17,355; I2 = 45.22%).
Conclusion. The results show that the resistance of H. pylori to clarithromycin in Russia does not exceed the 15% threshold regulated by the Maastricht-V Consensus, which allows us to consider a triple regimen of anti-Helicobacter therapy with clarithromycin as a first-line therapy. At the same time, to achieve the maximum effect when using classical triple therapy and to level the risk of further progression of clarithromycin resistance of H. pylori in Russia, it is advisable to use methods of its optimization.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.