Роль микробиоты кишечника в поддержании метаболического гомеостаза
- Аннотация
- Статья
- Ссылки
- English
Пробиотические препараты воздействуют на микробиоту организма-хозяина, корректируя дисбиоз и улучшая метаболические показатели, что свидетельствует о потенциальной возможности их использования для профилактики и лечения ожирения, а также ассоциированных с ним заболеваний, наряду с выполнением рекомендаций по диете, модификацией образа жизни и базовой терапией.
Пробиотические препараты воздействуют на микробиоту организма-хозяина, корректируя дисбиоз и улучшая метаболические показатели, что свидетельствует о потенциальной возможности их использования для профилактики и лечения ожирения, а также ассоциированных с ним заболеваний, наряду с выполнением рекомендаций по диете, модификацией образа жизни и базовой терапией.

Микробиота кишечника человека представляет собой сложную систему микроорганизмов c колоссальным видовым разнообразием и внушительными количественными характеристиками [1]. В кишечнике насчитывается более 500–1000 видов микроорганизмов. Они составляют 1–3% общей массы организма и являются огромнейшим резервуаром генетического материала [2, 3].
Значимую долю микробиоты составляют, в частности, представители филотипов Firmicutes, Bacteroidetes, Proteobacteria, Verrucomicrobia, Actinobacteria [3].
В настоящее время внимание исследователей обращено к изучению микробиоты не только как важнейшего фактора пищеварения, но и как невидимого органа, ответственного за поддержание метаболического и иммунологического гомеостаза макроорганизма. Учитывая огромный вклад бактерий кишечника в процессы расщепления пищевых компонентов, их участие в синтезе и всасывании веществ, важных для регуляции липидного, углеводного и белкового обменов, поддержании иммунологической толерантности и барьерной функции, а также формировании противоинфекционной защиты, становится очевидна роль нарушений микробиоты в каскаде патологических реакций, лежащих в основе развития метаболических заболеваний. Большая часть отечественных и зарубежных работ в этой области посвящена вопросам функциональной роли микроорганизмов в развитии социально значимых патологий, таких как ожирение, сахарный диабет, неалкогольная жировая болезнь печени, а также канцерогенезе.
Распространенность ожирения достигла размеров эпидемии. Основной вклад в его развитие вносят особенности питания и низкая физическая активность. Однако существует еще ряд факторов, лидирующие позиции среди которых наряду со стрессами занимает состояние микробиома кишечника. Он реализует значимую часть патологических реакций, связанных с нарушением регуляции адипогенеза и аппетита [4–8]. К сожалению, интерпретация результатов исследований, демонстрирующих различие в составе кишечной микробиоты у тучных и индивидов с нормальной массой тела, усложняется подтверждением причинно-следственных связей между первичными факторами, приводящими к регистрируемым дисбалансам жирового обмена, и дисбиозом. Однако достоверно показано, что колонизация желудочно-кишечного тракта здоровых мышей микроорганизмами, полученными из дистальных отделов кишечника тучных особей, вызывала прирост жировой ткани на 60% и быстрое развитие инсулинорезистентности [5]. Транслокация микробиоты лиц с ожирением в кишечник стерильных животных также сопровождалась увеличением общей и жировой массы, несмотря на низкокалорийное питание [9].
Безусловно, ожирение – ключевой, а в ряде случаев и пусковой фактор прогрессирования нарушений углеводного и липидного обменов. Следовательно, очевидна связь между составом микробиоты и метаболическим дисбалансом. Биотехнологический и физико-технический прогресс, наблюдающийся последнее десятилетие, позволил предпринять активные попытки по расшифровке функциональной связи микроорганизмов и факторов поддержания метаболического гомеостаза.
Согласно данным литературы, симбиоз макроорганизма и микробиоты в отношении липидного и углеводного обменов реализуется благодаря нескольким основным механизмам. Одна из гипотез – вовлечение микроорганизмов в синтез и метаболизм короткоцепочечных жирных кислот (КЖК), а именно масляной, уксусной и пропионовой (бутирата, ацетата и пропионата соответственно). КЖК являются производными продуктов расщепления растворимых полисахаридов. Они стимулируют рост и пролиферацию энтероцитов, выполняют роль основного энергетического субстрата для клеток кишечника [10]. Механизм влияния бутирата на регуляцию энергопотребления и углеводный обмен базируется на способности активировать специфические рецепторы, сопряженные с G-белками, или серпентины, широко представленные в адипоцитах, иммунных и эпителиальных клетках кишечника [11]. Активация данных рецепторов индуцирует секрецию пептида YY в подвздошной и толстой кишке, способствующего снижению перистальтики кишечника и оказывающего влияние на центральную регуляцию аппетита [12, 13]. Активация серпентиновых рецепторов также приводит к стимуляции секреции глюкагоноподобного пептида 1 (ГПП-1). Функциональные возможности ГПП-1 подробно описаны в литературе: стимулирование постпрандиального выброса инсулина, снижение секреции глюкагона, ингибирование моторики кишечника. Это обусловило широкое применение агонистов рецепторов ГПП-1 в лечении ожирения и сахарного диабета 2-го типа [14]. Непосредственная роль рецепторов, сопряженных с G-белками, в регуляции энергетического обмена продемонстрирована на мышиных моделях. Так, у мышей с дефицитом вышеуказанных рецепторов развивалось ожирение, несмотря на нормокалорийное питание. В то же время у животных с гиперэкспрессией серпентинов не наблюдалось изменения массы тела на фоне диеты с высоким содержанием жиров. Вклад микробиоты в активацию данных рецепторов – изменение концентрации свободных жирных кислот. Ее роль в указанном процессе также подтверждается тем, что в условиях стерильности кишечника или после антибактериальной терапии вне зависимости от выраженности экспрессии серпентинов у мышей была зафиксирована нормальная масса тела [11].
Короткоцепочечные жирные кислоты также вовлечены в регуляцию кишечного глюконеогенеза. Так, бутират и пропионат активируют экспрессию генов, ответственных за реализацию синтеза глюкозы в слизистой оболочке кишечника через циклический аденозинмонофосфат-зависимый механизм и активацию оси «кишечник – головной мозг» посредством рецептора жирных кислот 3. В эксперименте у здоровых особей это оказывало положительный эффект на массу тела и контроль глюкозы. При этом у особей, нокаутированных по гену, кодирующему один из ключевых ферментов глюконеогенеза, аналогичных изменений не наблюдалось, несмотря на модификацию кишечной микробиоты [15, 16]. Таким образом, метаболически позитивное влияние короткоцепочечных жирных кислот реализуется только в условиях нормального кишечного глюконеогенеза.
Протективное действие КЖК в отношении поддержания барьерной функции эндотелия кишечника заключается в снижении проницаемости интестинального барьера. Механизм последнего не установлен, однако экспериментально показано, что при добавлении бутирата и пропионата к бокаловидным клеткам, с одной стороны, происходила стимуляция экспрессии мРНК гена муцина, с другой – повышение транскрипции белка клаудина 1, одного из важнейших компонентов замыкающих контактов, устанавливающего параклеточный барьер, который контролирует потоки молекул в эпителиальном межклеточном пространстве [17, 18].
В качестве еще одного механизма вовлечения микробиоты в энергетический гомеостаз следует рассматривать систему интеграции микроорганизмов в реализацию иммунного ответа и системного воспаления. Результаты ряда последних исследований свидетельствуют о роли КЖК в активации местного иммунитета посредством регуляции дифференцировки Т-клеток [19]. Одним из факторов, посредством которого микроорганизмы участвуют в регуляции иммунного статуса, является повышение концентрации ранее упомянутых короткоцепочечных жирных кислот. Данные метаболиты модулируют синтез и дифференциацию Т-клеток, секретирующих интерлейкины (ИЛ), которые выполняют важнейшую роль в регуляции аутоиммунитета, оказывая протективное воздействие на бета-клетки поджелудочной железы, и способствуют улучшению глюкозного и липидного метаболизма, а также снижению инсулинорезистентности [20]. Проанализирована связь между дисбиозом кишечника и снижением уровня ИЛ-18 в условиях подавления генов, ответственных за формирование протеинов, входящих в комплекс инфламмасом, – ключевых факторов, способствующих трансформации провоспалительных цитокинов в активные формы. Другими факторами микробиотической жизнедеятельности, вовлеченными в процесс иммунного ответа, считаются липополисахариды (ЛПС). Они являются основными компонентами клеточной стенки грамотрицательных бактерий и играют ключевую роль в развитии острой и хронической форм воспаления [21]. Избыточное содержание липополисахаридов в плазме, или эндотоксемия, впервые охарактеризовано P.D. Cani и соавт. как фактор развития дислипидемии на фоне диеты с высоким содержанием жиров. У особей, которым длительное время подкожно вводили ЛПС, отмечалось снижение численности бактерий типа Bacteroides, повышение тощакового уровня глюкозы и развитие инсулинорезистентности [21]. Аналогичные результаты получены M. Lassenius и соавт. В ходе исследования у пациентов с сахарным диабетом 1-го типа была выявлена ассоциация между уровнем ЛПС в крови и повышением уровня триглицеридов, диастолических показателей артериального давления. В другом исследовании, включившем более тысячи пациентов, уровень эндотоксемии был значимо выше в группе сахарного диабета [22].
Воздействие микробиоты на энергетический гомеостаз реализуется посредством влияния микроорганизмов на качественный и количественный состав желчных кислот. Известно, что пропорциональные характеристики последних значимо отличаются у здоровых особей после применения антибиотиков [23]. В настоящее время значение желчных кислот в регуляции энергетического обмена до конца не определено, однако установлено, что они являются лигандами для ряда важнейших рецепторов, таких как фарнезоидный Х-рецептор и мембранный рецептор желчных кислот, активация которых модифицирует глюкозный, липидный и энергетический обмены [24].
Одной из причин развития ожирения и ассоциированных с ним заболеваний являются особенности пищевого поведения. В данном контексте перспективным представляется изучение взаимосвязи микробиоты с эндоканнабиоидной системой. Данная система представлена каннабиоидными (КБ) рецепторами 1 и 2, эндогенными каннабиоидами и ферментами, участвующими в процессе их биосинтеза и деградации. Установлено, что эндоканнабиоиды влияют на энергообмен как с помощью центральных орексигенных механизмов на уровне лимбической системы, гипоталамуса, так и с помощью регуляции липогенеза [25].
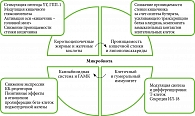
Модификация микробиоты кишечника способствует снижению массы тела у тучных особей и экспрессии мРНК рецептора КБ-1. Применение антагонистов данного рецептора вызывало значимое снижение проницаемости стенки кишечника и уровня липополисахаридов в плазме [26]. Среди других биологически активных субстанций, вовлеченных в регуляцию углеводного обмена, а именно секреции инсулина и функционирование бета-клеток, выделяют гамма-аминомасляную кислоту (ГАМК). В экспериментах на клетках продемонстрировано усиление пролиферации бета-клеток и секреции инсулина при добавлении лакто- и бифидобактерий, способных к синтезу ГАМК (рис.) [27, 28].
Учитывая тесную связь между микробиотой и развитием ожирения, инсулинорезистентности, нарушением углеводного и липидного обменов, предпринимались попытки выявить виды или филотипы микроорганизмов, ответственных за нарушение метаболического гомеостаза.
Некоторые авторы связывают развитие ожирения и ассоциированных с ним заболеваний с изменением качественного состава микробиоты. Благодаря суммарному анализу всей совокупности генетического материала микроорганизмов кишечника удалось выделить две группы индивидов в зависимости от распределения и количества бактериальных генов. Первая группа характеризуется достаточным биологическим разнообразием (высокий геномный индекс) и преобладанием Actinobacteria и Euryarchaeota, а также противовоспалительных видов Faecalibacterium prausnitzii. Вторая – низким геномным индексом и распространенностью условно провоспалительных видов Bacteroidetes, Ruminococcus gnavus, ассоциированных с язвенным колитом и болезнью Крона. Кроме того, у данной группы отмечались значимо более высокие уровни лептина, адипонектина, триглицеридов, свободных жирных кислот, С-реактивного белка. Несмотря на очевидную связь качественного состава микробиоты и показателей энергообмена, четкая корреляция геномного индекса и ожирения в обеих группах отсутствовала, что, вероятно, обусловлено влиянием собственного генома на развитие метаболических нарушений [29]. N. Larsen и соавт. установили, что, несмотря на отсутствие различий в суммарной совокупности бактериального пула тонкой кишки, доля филотипа Firmicutes у пациентов с избыточной массой тела и сахарным диабетом 2-го типа ниже, чем у лиц без нарушений углеводного обмена [30]. В более масштабном исследовании, проведенном J. Qin и соавт., у пациентов с сахарным диабетом 2-го типа наблюдались дисбиотические нарушения – снижение численности бутират-продуцирующих бактерий при незначительном повышении количества условно патогенных микроорганизмов [31].
Другая гипотеза, также основывающаяся на видовой дифференциации микробиоты у лиц с ожирением и нарушениями разных видов обмена, связана с дисбиозом кишечника, при котором при неизменном потреблении пищевых компонентов микробиота обладает большей способностью к энергоизвлечению [32, 33]. Показано, что у мышей ob/ob с генетически детерминированным ожирением значимо преобладало количество коротких бактериальных ДНК-последовательностей, кодирующих ферменты, вовлеченные в расщепление полисахаридов и крахмала, а также генов, ответственных за синтез белков-переносчиков, обеспечивающих мембранный транспорт продуктов гидролиза (свидетельство высокой интенсивности обмена). В ранее упомянутом исследовании J. Qin и соавт. также было выявлено повышение трансмембранного транспорта сахаров, уровня метаболизации метана и деградации ксенобиотиков, что поддерживало концепцию микробиотического усиления энергоизвлечения из нутриентов у лиц с избыточной массой тела [31].
Микробиота также участвует в синтезе важнейших витаминов – кофакторов, необходимых для реализации метаболического конвейера по преобразованию энергии пищи в главный источник энергетических запасов организма аденозинтрифосфат [34]. Так, тиамин (витамин В1) выполняет роль кофактора в ферментативных реакциях расщепления пировиноградной кислоты, рибофлавин (витамин В12), ниацин (витамин В3), пантотеновая кислота (витамин В5) участвуют в окислительно-восстановительных биохимических процессах цикла Кребса. Биотин (витамин В7) является кофактором при метаболизме жирных кислот, лейцина и глюконеогенезе. Некоторые штаммы лактобактерий способны к синтезу фолатов, в связи с чем вызывают огромный интерес как альтернатива синтезированной фолиевой кислоте [35]. Микробиота участвует в метаболизме и синтезе 25(ОН)D, а также его производных посредством изменения концентрации фактора роста фибробластов 23 [36].
Учитывая вышесказанное, представляется логичным поиск потенциальных факторов, модулирующих количественный и качественный состав бактерий кишечника, с целью максимального извлечения преимуществ из симбиоза микроорганизмов и макроорганизма. Одним из таких факторов являются пробиотики. Согласно определению Всемирной организации здравоохранения, к пробиотикам следует относить «живые микроорганизмы», при назначении которых в корректных количествах наблюдаются положительные эффекты на организм.
Биологические и клинические эффекты пробиотиков основаны на коррекции качественного состава микробиоты с восстановлением пропорционального количества «метаболически полезных» бактерий. Наиболее перспективными в отношении влияния на метаболизм человека являются пробиотики, которые содержат лактобактерии и бифидобактерии.
Биологическое действие пробиотиков достигается путем активации или коррекции механизмов, посредством которых микробиота регулирует метаболический обмен и иммунный статус.
В первую очередь пробиотики и входящие в их состав бактерии характеризуются высокой способностью продуцировать КЖК. Это достигается путем ферментации конечных продуктов расщепления углеводов [37]. Показано, что лактобактерии способны к синтезу всего спектра КЖК (пропионата, бутирата, ацетата), бифидобактерии – лактата и ацетата.
Влияние пробиотиков на концентрацию конечных продуктов распада углеводов продемонстрировано при проведении экспериментов в специализированной системе – функциональном аналоге пищеварительного тракта человека (Simulator Human Microbial Ecosystem – SHIME) [38]. Механизм позитивного влияния короткоцепочечных жирных кислот на углеводный и липидный обмены описан ранее.
Пробиотики также воздействуют на синтез и секрецию интестинальных пептидов, участвующих в регуляции углеводного обмена. В настоящее время выделены виды лактобактерий, способных секретировать ГПП-1. У мышей с диабетом при добавлении в пищу вышеуказанных микроорганизмов отмечалось значимое улучшение гликемических показателей за счет повышения уровня инсулина [39]. Это может послужить основанием для изучения факторов, лежащих в основе профилактики нарушений углеводного обмена, и возможностей использования пробиотиков в качестве антидиабетических препаратов. Как указывалось ранее, лактобактерии способны синтезировать ГАМК и модулировать эндоканнабиоидную систему.
В настоящее время представлены результаты более 50 исследований, посвященных влиянию пробиотиков на микробиоту кишечника, липидный и углеводный обмены, артериальное давление. Анализ данных литературы о применении и эффектах пробиотиков свидетельствует, что в значимом количестве рандомизированных клинических исследований (РКИ) подтверждено положительное влияние модификации микробиоты на течение сахарного диабета 1-го и 2-го типов, ожирение [40–45]. Так, в 2016 г. C. Li и соавт. провели метаанализ, по результатам которого продемонстрировано значимое снижение уровня глюкозы плазмы натощак при применении пробиотиков (стандартизованная разность средних (СРС) 0,61 ммоль/л), уровня холестерина высокой плотности (СРС 0,42 ммоль/л) без значимых различий в показателях триглицеридов, гликированного гемоглобина, индекса инсулинорезистентности, холестерина низкой плотности [46]. В том же году аналогичные результаты представлены Q. Zhang и L. Hua. Исследователи отметили более выраженные эффекты пробиотических препаратов в отношении снижения тощаковых уровней глюкозы и повышения инсулина [47]. H. Jun и соавт. установили, что пробиотики по сравнению с плацебо значимо снижали как лабораторные показатели липидного обмена (общего холестерина (СРС 0,57 мг/дл), липопротеинов низкой плотности (СРС 0,4 мг/дл), триглицеридов (СРС 0,66 мг/дл)) при повышении уровня липопротеинов высокой плотности (СРС 0,38 мг/дл), так и значения артериального давления [48], что в совокупности свидетельствовало о роли пробиотиков в уменьшении риска развития сердечно-сосудистых осложнений у данной категории пациентов. Таким образом, хотелось бы подчеркнуть, что пробиотики, которые ранее продемонстрировали эффективность в лечении заболеваний желудочно-кишечного тракта, согласно современным данным, обладают широким спектром положительных свойств в отношении коррекции компонентов метаболического синдрома (например, штаммы, указанные в таблице).
В настоящее время накоплено значительное количество данных, свидетельствующих о колоссальной роли микроорганизмов кишечника в регуляции энергетического гомеостаза. В большей степени влияние микробиоты на систему углеводного и жирового обменов реализуется посредством модуляции синтеза свободных жирных кислот, желчных кислот, ряда системных биоактивных молекул, клеточного звена иммунной системы и проницаемости кишечной стенки для липополисахаридов.
Поддержание корректного количественного и качественного состава микробиоты, в том числе с использованием пробиотических препаратов, необходимо для нормального функционирования не только желудочно-кишечного тракта, но и системы энергетического гомеостаза. Суммированные данные систематических обзоров, включивших рандомизированные клинические исследования, свидетельствуют о широких перспективах в отношении применения пробиотиков как для профилактики нарушений углеводного обмена, так и для коррекции уже имеющихся заболеваний, в частности сахарного диабета 2-го типа и дислипидемии.
При поддержке компании ООО «Пфайзер Инновации»
S.Yu. Vorotnikova, Ye.A. Pigarova, L.K. Dzeranova
National Medical Research Center for Endocrinology
Contact person: Svetlana Yuryevna Vorotnikova, vorotnikova.s.y@gmail.com
Intestinal microbiota is a complex of microorganisms that closely function with the human body. Integration of the microbiota and metabolism of the host is achieved through the regulation of the synthesis of biologically active substances such as free fatty acids, bile acids, endocannobioids and modulation of the intestinal permeability and central mechanisms of appetite regulation. Probiotics act on all levels of integration of the system "host-microbiota", correcting dysbiosis and improving metabolic parameters, which indicates the potential for use these drugs for the prevention and treatment of obesity and associated diseases together with dietary recommendations, lifestyle modification and basic therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.