Роль снижения массы тела в купировании болевого синдрома при остеоартрозе
- Аннотация
- Статья
- Ссылки
- English



В XXI в. ожирение признано одной из самых распространенных проблем здравоохранения многих стран мира, в том числе России. Согласно эпидемиологическим прогнозам, к 2025 г. им будут страдать 40% мужчин и 50% женщин [1, 2].
Данная патология развивается при увеличении потребления пищи и снижении расхода энергии, то есть является результатом нарушения энергетического баланса.
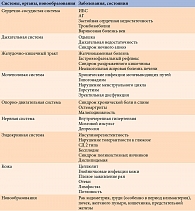
Уже давно ожирение рассматривается не как избыток жировой ткани в организме, а как хроническое рецидивирующее заболевание, ассоциированное с рядом серьезных осложнений (табл. 1). Ожирение способствует развитию дислипидемии и атеросклероза, ишемической болезни сердца (ИБС), сахарного диабета (СД) 2 типа, артериальной гипертензии (АГ), синдрома ночного апноэ, заболеваний опорно-двигательной системы и других патологий, приводящих к потере трудоспособности и снижающих качество и продолжительность жизни.
Остеоартроз и ожирение
Заболевания опорно-двигательной системы часто сочетаются с ожирением. Так, среди пациентов с избыточной массой тела достаточно высока распространенность остеоартроза – хронического дегенеративно-дистрофического заболевания суставов [3–5]. Кроме того, патологии опорно-двигательного аппарата являются неизбежным следствием ожирения. Известно, что ожирение нередко предшествует развитию остеоартроза коленных суставов [6, 7]. У пациентов с ожирением риск развития последнего в восемь раз выше, чем у пациентов с нормальным индексом массы тела (ИМТ) [7]. Ожирение также ассоциируется с увеличением риска прогрессирования остеоартроза коленных суставов [8]. При этом высокий ИМТ оказывает более выраженное влияние на развитие остеоартроза, а не на его прогрессирование [4, 9].
Ожирение в значительной степени обусловливает прогрессирование рентгенологических изменений суставов, таких как сужение суставной щели и увеличение размеров остеофитов [10].
Установлена также связь между ожирением и интенсивностью боли при остеоартрозе коленных суставов [11]. В исследовании, проведенном M.A. Cimmino и соавт., участвовало 2764 врача общей практики, каждый из которых последовательно набирал десять пациентов с симптоматическим остеоартрозом, соответствующим критериям Американской коллегии ревматологов (American College of Rheumatology – ACR) [12]. Боль оценивалась по визуальной аналоговой шкале (ВАШ) и была максимальной у лиц с остеоартрозом коленных суставов и ожирением. При коксартрозе и остеоартрозе суставов кистей в сочетании с ожирением боль была менее выраженной.
Результаты исследования R. Marks продемонстрировали, что у больных остеоартрозом коленных суставов и ожирением интенсивность боли была выше, чем у пациентов с низким ИМТ (р < 0,05) [13].
S.K. Tanamas и соавт. наблюдали за 250 больными остеоартрозом коленных суставов в течение двух лет. Исследователи установили, что повышение массы тела более чем на 5% сопровождается усилением боли в среднем на 27,1 мм, скованности на 18,4 мм и функциональной недостаточности на 99,3 мм (по ВАШ) [14].
Кроме того, при ИМТ > 30 кг/м² риск развития остеоартроза коленных суставов в четыре раза выше, чем при ИМТ 25 кг/м² [15].
В работе D.J. Hart и T.D. Spector, включавшей 1000 женщин, выявлено, что относительный риск развития одностороннего и двустороннего остеоартроза коленных суставов, по данным рентгенологического исследования, у лиц с ИМТ > 26,4 кг/м² составил 6,2 и 18,0 соответственно по сравнению с лицами с ИМТ < 23,4 кг/м² [16].
Ожирение оказывает влияние и на прогноз остеоартроза [17, 18]. В Великобритании 27 и 69% случаев артропластики бедра и колена у пациенток среднего возраста были связаны с ожирением [3].
Характерной особенностью остеоартроза у лиц с ожирением является потеря хрящевой ткани.
Сложность патогенеза остеоартроза обусловлена строением хрящевой ткани, основные функции которой заключаются в адаптации сустава к механической нагрузке (сжатие при нагрузке и восстановление при ее снятии) и обеспечении движения в суставе без трения суставных поверхностей [3, 4]. Суставной хрящ на 98% состоит из соединительнотканного матрикса, основными компонентами которого являются коллагеновые волокна, преимущественно второго типа. Остальное пространство заполнено гиалуроновой кислотой и сульфатированными протеогликанами. Ключевая роль в поддержании равновесия между анаболическими и катаболическими процессами отводится клеточным элементам хряща – хондроцитам [19].
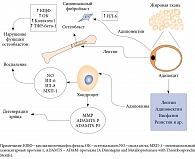
Повреждение хондроцитов связано с активацией специфических рецепторов на мембране (рецепторы к интерлейкину (ИЛ) 1, лептину, фибронектину). Они запускают синтез провоспалительных и деструктивных медиаторов, опосредованный белками ядерного фактора транскрипции каппа-би (NF-kB). Имеет также значение увеличение продукции цитокинов, которые стимулируют синтез протеаз, активатора плазминогена, простагландина E и, с одной стороны, способствуют пролиферации синовиальных клеток, с другой – подавляют синтез коллагена и протеогликанов хондроцитами [15, 19, 20]. При остеоартрозе происходит гиперпродукция хондроцитами циклооксигеназы 2, фермента, индуцирующего синтез простагландинов, принимающих участие в развитии воспаления, и индуцибельной формы оксида азота (NO), оказывающего токсическое воздействие на хрящ и индуцирующего апоптоз хондроцитов [15, 16, 21] (рис. 1).
Существует несколько точек зрения на механизмы развития остеоартроза при ожирении [15].
Одна точка зрения – при излишней массе тела суставы подвергаются повышенной механической нагрузке. На поверхности хондроцитов обнаружены механорецепторы, чувствительные к давлению и связанные с внеклеточным матриксом сигнальным каскадом. Ожирение, предположительно, может индуцировать повреждение хряща через активацию этих рецепторов [21].
Другая точка зрения – существуют иные механизмы, связанные с ожирением и способные изменить метаболизм хрящевой, костной ткани. Речь, в частности, идет о роли метаболических нарушений, обусловленных инсулинорезистентностью (ИР) [3, 18, 22, 23].
Жировая ткань, будучи эндокринным органом, секретирует большое количество цитокинов, хемокинов и пептидов, осуществляющих важные физиологические функции в организме. Обладая паракринным, аутокринным и эндокринным механизмом действия, адипоцитокины влияют на метаболизм углеводов, жиров, процессы воспаления, свертывания, иммунный ответ, ангиогенез, процессы в костной, хрящевой тканях и др. [2, 15, 24]. Для сравнения – у худого взрослого человека в организме порядка 35 млрд адипоцитов, у тучного – 125 млрд.
Нарушение регуляции синтеза и секреции сигнальных веществ жировой тканью может служить связующим звеном между ожирением, ИР и заболеваниями опорно-двигательного аппарата.
Однако риск развития сопутствующих ожирению патологических состояний в значительной степени определяется особенностями отложения жировой ткани в организме [24].
Наиболее опасно абдоминальное отложение жира (окружность талии (ОТ) у мужчин – более 94 см, у женщин – более 80 см). В абдоминальном жире очень активно протекают метаболические процессы. Адипоциты абдоминального жира в отличие от адипоцитов подкожного жира имеют высокую плотность и чувствительность к бета-адренорецепторам (особенно бета-3-адренорецепторам), рецепторам кортизола и андрогенов и низкую плотность и чувствительность к инсулиновым рецепторам и альфа-адренорецепторам. Незначительное влияние инсулина повышает продукцию свободных жирных кислот в абдоминальной жировой ткани.
При ИР снижаются биологические эффекты инсулина в различных органах и тканях. Для ее компенсации требуется увеличение количества инсулина. Развивающаяся компенсаторная гиперинсулинемия приводит к усилению поглощения глюкозы периферическими тканями, а также уменьшению продукции глюкозы печенью. Таким образом некоторое время поддерживается нормальный уровень глюкозы крови.
Как было сказано ранее, гиперинсулинемия необходима для преодоления ИР. В то же время это патологический процесс, способствующий развитию метаболических, гемодинамических и системных нарушений. Изменение метаболизма инсулина при ожирении ассоциируется с ухудшением анаболических процессов в хондроцитах (с учетом их чувствительности к инсулину) [1, 25].
Среди адипоцитокинов особая роль отводится лептину. Установлено, что помимо регуляции пищевого поведения данный пептид выполняет и другие важные функции, например участвует в метаболизме хрящевой ткани [20]. Наличие рецепторов лептина в семействе клеток мезенхимального происхождения, к которому относятся хондробласты/хондроциты, остеобласты/остеоциты и клетки макрофагального ряда, обеспечивает эндокринную, паракринную и аутокринную регуляцию, осуществляемую этим гормоном в структурах, формирующих суставы [22].
Лептин воздействует на Т-клетки как модулятор, поэтому играет важную роль в патогенезе ряда воспалительных заболеваний, включая дегенеративные и воспалительные заболевания суставов [23]. Так, в исследовании Н. Dumond и соавт. обнаружено, что у пациенток с остеоартрозом гиперэкспрессия лептина в хрящевой ткани коррелирует со степенью разрушения хряща [22]. При избыточной продукции лептина замедляется синтез продуктов хрящевого матрикса. В эксперименте лептин индуцирует апоптоз хондроцитов, что приводит к потере хрящевой ткани. Как провоспалительный медиатор, лептин посредством NF-kB стимулирует продукцию провоспалительных цитокинов моноцитами, макрофагами, хондроцитами. Это приводит к активации металлопротеиназы и апоптозу хондроцитов в хрящевой ткани [20]. Внутрисуставные инъекции лептина стимулируют анаболические процессы и активируют синтез ростовых факторов в хряще и хондроцитах [26].
Лептин участвует в воспалительном ответе и может увеличивать продукцию макрофагами провоспалительных цитокинов.
В целом характер влияния лептина на ткани опорно-двигательного аппарата зависит как от его концентрации, так и от присутствия целого ряда гормонально-метаболических факторов в циркуляции и средах, непосредственно окружающих клетки хрящевой и костной ткани [1]. Через систему провоспалительных цитокинов лептин может способствовать потере хрящевой ткани, через стимуляцию синтеза факторов роста клетками мезенхимальной ткани в суставах – активному новообразованию хрящевых клеток, формированию хрящевых выростов и их оссификации (образованию остеофитов).
G. Miller и соавт. изучали взаимосвязь уровня сывороточного лептина, ожирения и прогрессирования остеоартроза коленных суставов у пациентов старше 60 лет с ИМТ 28,0 кг/м² и более [27]. Результаты исследования свидетельствуют, что снижение уровня сывороточного лептина – один из механизмов замедления прогрессирования остеоартроза у пациентов с ожирением. Таким образом, лептин, по-видимому, является связующим звеном между остеоартрозом и ожирением, при котором всегда возрастает его тканевый и системный уровень. Лептин способствует повышению концентрации провоспалительных и ростовых факторов, под влиянием которых происходят деструктивные процессы в тканях скелета.
В настоящее время ожирение рассматривается как хроническое подострое системное воспаление, что связано с увеличением синтеза провоспалительных цитокинов как адипоцитами, так и макрофагами жировой ткани (например, ИЛ-1-бета, ИЛ-6, фактора некроза опухоли альфа (ФНО-альфа), С-реактивного белка). При этом количество макрофагов, мигрирующих в жировую ткань (особенно в абдоминальную), тем больше, чем выше выраженность ИР [2, 24]. Это вносит весомый вклад в развитие остеоартроза, который характеризуется как низковоспалительное заболевание [1, 3, 16].
Воспаление усиливает разрушение хряща, поскольку провоспалительные цитокины способствуют высвобождению хондроцитами матриксных металлопротеаз (ММЗ), активаторов плазминогена, повреждающих коллаген и протеогликаны хряща [28].
Отметим, что экспрессия ФНО-альфа более выражена в адипоцитах абдоминальной жировой ткани [24]. Стимулируя пролиферацию фибробластов, синтез простагландинов, фактора активации тромбоцитов, супероксидных радикалов и подавляя синтез коллагена и протеогликанов, ФНО-альфа усиливает деструктивные эффекты в суставных структурах. Существенное влияние на прогрессирование деградации хряща при остеоартрозе оказывает нарушение синтеза или действия анаболических медиаторов: инсулиноподобного фактора роста 1 и трансформирующего фактора роста бета (ТФР-бета), активность которых связана с репарацией хрящевой ткани.
Следовательно, избыточная жировая ткань (особенно абдоминальная) ассоциируется с деградацией хряща, развитием воспаления в суставах и прогрессированием остеоартроза. В свою очередь снижение массы тела приводит к уменьшению содержания различных маркеров воспаления, что положительно влияет на течение остеоартроза.
Лечение ожирения
Терапия ожирения – сложная задача, для решения которой требуется системный подход.
Современные подходы к лечению ожирения предполагают использование немедикаментозных методов терапии, которые при необходимости дополняются медикаментозными (табл. 2).
Основными целями лечения наряду со снижением массы тела являются предотвращение или улучшение течения сопутствующих заболеваний, максимальное снижение риска развития сердечно-сосудистых заболеваний и их осложнений, повышение качества жизни [2, 27].
Для улучшения состояния пациентов с ожирением не обязательно стремиться к достижению идеальной массы тела. Клинически значимое снижение массы тела составляет 5% от исходного [9]. Для пациентов с ИМТ более 35 кг/м² – на 10% от исходного. После достижения результата необходимо осуществлять меры по длительному его поддержанию и предупреждению рецидивов.
Уменьшение массы тела и отрицательный энергетический баланс достигаются за счет снижения физиологической калорийности рациона – на 500–600 ккал/сут. Содержание жира не должно превышать 25–30% от суточной калорийности рациона, в том числе насыщенных жиров – менее 7–10%, полиненасыщенных – до 10%, мононенасыщенных – менее 20%, холестерина – менее 300–200 мг, клетчатки – более 20–25 г/сут. Потребление медленноусвояемых углеводов должно составлять 55–60%, белков – 15% от общей калорийности рациона. Рекомендуется также умеренное потребление соли – до 5 г/сут.
Пациенты должны ежедневно заполнять дневник питания, в котором указываются все приемы пищи, полный перечень продуктов и их объем, количество потребленной жидкости. Это помогает контролировать эффективность снижения массы тела.
Больным могут быть назначены регулярные физические нагрузки умеренной интенсивности (дозированная ходьба, плавание, велотренажер четыре-пять занятий в неделю по 30–45 минут), поскольку в начале терапии они часто не в состоянии заниматься длительно и интенсивно. Необходимо также помнить, что активная физическая нагрузка (более 10 000 шагов в день) способствует структурным изменениям в коленных суставах, особенно у пациентов с остеоартрозом, осложненным повреждением мениска или костного мозга (по данным магнитно-резонансной томографии). Таким больным следует избегать интенсивных физических нагрузок и выбирать альтернативные методы снижения массы тела.
Для пациентов с остеоартрозом и ожирением проведение мероприятий по снижению массы тела является первоочередной задачей как с точки зрения механической нагрузки, так и с точки зрения профилактики сердечно-сосудистых заболеваний.
Коррекция массы тела позволит уменьшить болевой синдром в пораженных суставах, замедлить прогрессирование остеоартроза, а также значительно снизить риск сердечно-сосудистых осложнений. Известно, что у лиц с ожирением и остеоартрозом коленных суставов нетрудоспособность, обусловленная заболеванием опорно-двигательного аппарата, может быть значительно снижена благодаря уменьшению массы тела на 5,1%. В исследовании D. Felson и соавт., включавшем 800 женщин, продемонстрировано, что уменьшение ИМТ на 2 кг/м2 в течение десяти лет снизило риск развития остеоартроза более чем на 50%.
К сожалению, приходится констатировать, что среди пациентов, снизивших массу тела с помощью немедикаментозных методов лечения, около двух третей вновь прибавляют ее в течение года и большинство – в последующие пять лет, в некоторых случаях масса тела становится даже больше исходной [16, 29].
Лишь 4–5% больных ожирением могут достигать положительных результатов без фармакотерапии.
Медикаментозная терапия проводится при ИМТ ≥ 30 кг/м² и ИМТ ≥ 27 кг/м² в случае наличия связанных с ожирением патологических состояний и факторов риска [25].
Применение препаратов не только повышает приверженность пациентов немедикаментозному лечению, но и способствует достижению более эффективного снижения массы тела и его поддержанию в течение длительного периода.
Изучение влияния снижения массы тела на течение остеоартроза
Настоящее исследование проведено с целью оценить эффективность терапии оригинальным препаратом орлистат в отношении снижения массы тела у пациентов с остеоартрозом коленных суставов второй и третьей стадии.
Задачи исследования:
- изучить влияние снижения массы тела на клинические проявления патологии (боль, скованность, функцию суставов);
- изучить динамику качества жизни больных.
Материал и методы
Было проведено открытое сравнительное рандомизированное исследование эффективности и безопасности орлистата (препарат Ксеникал) у пациенток с остеоартрозом коленных суставов и ожирением. Длительность лечения – шесть месяцев.
В исследовании приняли участие 50 пациенток от 45 до 65 лет с тибиофеморальным остеоартрозом коленных суставов (согласно критериям ACR) второй и третьей стадии по критериям Kellgren – Lawrence, отвечавших критериям включения: ИМТ > 30 кг/см², боль при ходьбе в коленных суставах по ВАШ более 40 мм, ОТ ≥ 80 см.
Критерии исключения:
- травма коленного сустава в период до трех месяцев до начала исследования;
- внутрисуставное введение любых препаратов в течение шести недель до начала исследования;
- клинические признаки синовита коленного сустава;
- вторичный гонартроз;
- противопоказания к приему орлистата (синдром мальабсорбции, холестаз, гиперчувствительность к препарату или его компонентам);
- СД 1 и 2 типов в стадии декомпенсации;
- отсутствие письменного согласия на участие в исследовании.
Пациентки были рандомизированы на две равные группы – по 25 человек. Принцип рандомизации – первый-второй. Каждая участница под нечетным номером помимо немедикаментозного лечения ожирения (гипокалорийная диета и повышение физической активности) получала препарат Ксеникал (первая группа), под четным – только немедикаментозную терапию. Все больные также лечили остеоартроз по стандартной схеме.
Ксеникал в дозе 120 мг (одна капсула) принимался три раза в день –до еды, во время или не позднее чем через час после еды.
Всем пациенткам была рекомендована диета с калорическим дефицитом 500–600 ккал по сравнению с расчетным показателем. Содержание жиров < 30%, углеводов – 50–55%, белков – 15–20%.
Кроме того, участницы в течение шести месяцев заполняли дневник питания, где ежедневно отражали рацион, калорийность, количество жира в граммах.
Проводилась консультация эндокринолога, где обсуждалась коррекция рациона питания и физической активности. Всем пациенткам были даны разъяснения по изменению образа жизни.
На фоне диетотерапии участницам исследования было рекомендовано проводить мероприятия, направленные на повышение двигательной активности. Даны разъяснения по выполнению изометрических упражнений, которые способствуют повышению силы мышц. Показан комплекс упражнений, направленных на укрепление четырехглавой мышцы бедра.
Оценка эффективности терапии проводилась по следующим параметрам:
- динамика индекса WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index);
- снижение массы тела (в % от исходной), а также ОТ (в см), окружности бедер (ОБ) (в см) и соотношения ОТ/ОБ;
- динамика качества жизни по ВАШ.
Участницы приходили на амбулаторный осмотр в Научно-исследовательский институт ревматологии им. В.А. Насоновой один раз в месяц.
Ежемесячно измерялись рост, масса тела, определялись ИМТ, ОТ, ОБ и соотношение ОТ/ОБ, заполнялись опросники WOMAC, оценивалось качество жизни по ВАШ.
Индекс массы тела определялся согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), на основании классификации массы тела по ИМТ (табл. 3 (ВОЗ, 1997)). ИМТ рассчитывали путем деления показателя массы тела в килограммах на показатель роста человека, выраженный в метрах и возведенный в квадрат (кг/м2).
Индекс WOMAC – опросник для самостоятельной оценки пациентами выраженности боли (в покое и при ходьбе – пять вопросов), скованности (длительность и выраженность – два вопроса) и функциональной недостаточности в повседневной жизни (17 вопросов). По ВАШ оценку проводят в см – от 0 (нет симптомов/ограничений) до 10 (максимальная выраженность симптомов/ограничений), затем все показатели суммируют.
Качество жизни (состояние здоровья) определялось по ВАШ – от 0 до 100 мм (0 соответствует наихудшему состоянию, 100 – наилучшему).
Статистический анализ результатов проводился с использованием пакета прикладных программ Statistica 6.0. Обработка данных – методом описательной статистики, для сравнения групп использовался t-критерий Стьюдента. Статистически значимыми считались различия при p < 0,05.
Результаты и их обсуждение
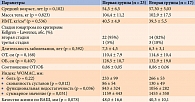
В таблице 4 представлена клиническая характеристика завершивших исследование.
Необходимо отметить, что пациентки второй группы начиная со второго визита к врачу неоднократно отказывались от продолжения участия в исследовании, мотивируя это неэффективностью диетотерапии в отношении уменьшения болей в коленных суставах. В связи с этим набор участниц во вторую группу был затруднен. Выбывшим пациенткам подбирали замену.
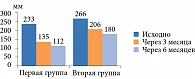
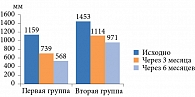
Снижение массы тела зафиксировано в обеих группах (рис. 2). Наиболее выраженным оно было в первой группе – -9,05% (в среднем на 9,5 кг) против -1,02% (в среднем на 1 кг) во второй (р = 0,05). Необходимо отметить, что у пациентов первой группы уже через три месяца лечения масса тела уменьшилась на 5,8% от исходной.
Аналогичные изменения наблюдались в отношении ИМТ. В первой группе показатель снизился на 9%, во второй – на 1,8% (р < 0,05).
В первой группе у 52% пациенток выявлено ожирение третьей степени, у 39% – второй и у 8,7% – первой степени. На фоне терапии Ксеникалом количество участниц с ожирением третьей степени сократилось на 15%.
В обеих группах на фоне лечения отмечено снижение ОТ и ОБ. Однако у принимавших Ксеникал ОТ уменьшилась на 7%, у 15 из них – более чем на 6,4 см (р < 0,05). В группе немедикаментозной терапии ОТ сократилась на 2,7%, в среднем на 3 см по сравнению с исходными данными. Окружность бедер в первой группе снизилась на 7,8%, во второй – на 5,4% (р = 0,05).
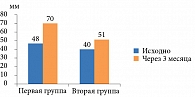
На фоне проведенного лечения изменились значения индекса WOMAC. Так, выраженность боли в первой группе снизилась на 52% и была достоверно ниже (р = 0,006), чем во второй группе (-32,4%) (рис. 3).
Скованность в наиболее болезненном коленном суставе была достоверно (р = 0,001) ниже у принимавших Ксеникал. Этот показатель в первой группе снизился на 47,4%, во второй – на 36,5%.
Изменения наблюдались и в отношении функциональной недостаточности. В динамике функциональная недостаточность в первой группе оказалась достоверно ниже, чем во второй – -51,3 и -33% соответственно (р = 0,003).
Через шесть месяцев суммарное значение индекса WOMAC в результате снижения массы тела уменьшилось в обеих группах – на 51 и 33% соответственно, однако достоверно было ниже в группе, получавшей Ксеникал (р = 0,002) (рис. 4). При этом в первой группе динамика индекса WOMAC отмечалась уже через три месяца терапии – -36% от исходных значений.
На фоне терапии ожирения качество жизни пациентов обеих групп стало выше. В группе пациенток с гонартрозом и высоким ИМТ, получавших медикаментозное лечение, зафиксировано значимое улучшение качества жизни (р < 0,001) (рис. 5).
Результаты исследования продемонстрировали, что добавление Ксеникала к стандартной терапии остеоартроза приводит к выраженному снижению массы тела и уменьшению его клинических проявлений. Поэтому препараты, оказывающие влияние на массу тела, необходимо включать в схему лечения пациентов с остеоартрозом и ожирением.
A.M. Mkrtumyan, I.V. Solovyova
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Obesity consistently associated with the development of a number of chronic diseases, leading to a decrease in quality of life, disability and death. The article examines the connection between obesity and disease of the musculoskeletal system, describes the mechanisms by means of which obesity leads to the development of osteoarthritis. It is evident that reduction of body mass can slow the progression of osteoporosis. The own experience of non-pharmacological and pharmacological treatment of obesity with the use of orlistat in 50 obese patients with osteoarthritis of the knee II-III stage is presented. Our results showed that the addition of orlistat to standard osteoarthritis scheme leads to significant reduction in weight and reduction of clinical manifestations of osteoarthritis. According to the above, the drugs that have impact on weight loss, should be included in the treatment regimen of patients with osteoarthritis and obesity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.