Доказательная кардиология российского масштаба. Российский национальный конгресс кардиологов – 2014. Сателлитный симпозиум компании «Гедеон Рихтер».
- Аннотация
- Статья
- Ссылки



Интенсивная терапия статинами и каротидный атеросклероз: предварительные итоги исследования «ФРЕГАТ»
По словам д.м.н., ведущего научного сотрудника отдела атеросклероза Института клинической кардиологии им. А.Л. Мясникова Российского кардиологического научно-производственного комплекса (РКНПК) Минздрава России Андрея Владимировича СУСЕКОВА, статины относятся к основному классу лекарственных средств, применяемых для первичной и вторичной профилактики высокого риска сердечно-сосудистых заболеваний. Однако в нашей стране практика назначения статинов больным каротидным атеросклерозом пока незначительна. Между тем, как показывает анализ результатов семи исследований с участием свыше 3000 пациентов, каротидный атеросклероз, будучи эквивалентом сердечно-сосудистого риска, увеличивает риск коронарной смерти в ближайшие десять лет на 19–35%, сосудистой смерти – на 30%1.
Статины обладают как липидными, так и плейотропными эффектами, к которым относят противовоспалительное, антипролиферативное и антиоксидантное действие. Данные зарубежной литературы демонстрируют способность статинов в течение одного месяца стабилизировать опасные атеросклеротические бляшки у пациентов с острым коронарным синдромом. Согласно результатам международного исследования JUPITER, прием розувастатина снижает риск инсульта на 48%. Метаанализ рандомизированных контролируемых исследований китайских ученых W. Wang и B. Zhang 2014 г. подтвердил способность статинов снижать риск повторных инсультов на 16%2, 3. На фоне терапии статинами у пациентов, перенесших инсульт, снижается количество макрофагов воспалительного субстрата, увеличивается количество гладких мышечных клеток, формируется иммунный ответ, уменьшается количество окисленных липопротеинов низкой плотности (ЛПНП), что в совокупности приводит к стабилизации бляшек.
А.В. Сусеков ознакомил участников симпозиума с предварительными результатами исследования «ФРЕГАТ», проведенного сотрудниками лаборатории клинической липидологии РКНПК. Цель исследования – оценить влияние краткосрочной терапии препаратом Мертенил® (розувастатин, компания-производитель «Гедеон Рихтер») в дозе 40 мг/сут на выраженность и структуру каротидного атеросклероза у пациентов с очень высоким сердечно-сосудистым риском по данным трехмерного ультразвукового исследования (3D-УЗИ). Сроки проведения: февраль 2014 г. – лето 2015 г. В ходе исследования оценивался объем атеросклеротических бляшек в сонных артериях по данным 3D-УЗИ, влияние краткосрочной терапии (три месяца) Мертенилом (розувастатином) 40 мг/сут на липидные параметры, аполипопротеины (Апо А1, Апо В) и маркеры воспаления (С-реактивный белок (СРБ), интерлейкин (ИЛ) 6, фактор некроза опухоли альфа (ФНО-альфа)), а также проводился корреляционный анализ между объемом атером в сонных артериях, липидами, аполипопротеинами и маркерами воспаления у пациентов с очень высоким сердечно-сосудистым риском исходно и в конце интенсивной терапии Мертенилом 40 мг/сут.
«Методом валидированной инструментальной технологии 3D-УЗИ мы пытались выяснить, можно ли за три месяца терапии Мертенилом замедлить прогрессирование каротидного атеросклероза. Данный метод прошел стандартизацию в лаборатории УЗ методов исследования сосудов нашего кардиоцентра в 2013 г.», – уточнил докладчик.
В исследование включены пациенты с высоким риском (в анамнезе инсульт, артериальная гипертезия (АГ), инфаркт миокарда, стентирование), имеющие уровень ЛПНП >1,8 ммоль/л и находящиеся на традиционной терапии статинами. Участники исследования были рандомизированы в группу активной терапии (основная группа) и контрольную группу. Пациенты основной группы (n = 22) принимали препарат Мертенил® в дозе 40 мг/сут в течение трех месяцев без титрации доз. Пациенты контрольной группы (n = 20) находились на рутинной терапии другими статинами.
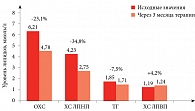
В группе Мертенила наблюдалось заметное улучшение липидных показателей: уровень общего холестерина (ОХС) снизился на 23,1%, ХС ЛПНП – на 34,8%, триглицеридов (ТГ) – на 7,5%, уровень ХС липопротеинов высокой плотности (ЛПВП) увеличился на 4,2% (рис. 1).
Предварительные данные свидетельствуют о том, что краткосрочная трехмесячная терапия препаратом Мертенил® в дозе 40 мг/сут способствует регрессу каротидных бляшек. Для иллюстрации сказанного А.В. Сусеков привел исходные и конечные данные двух участников исследования.
Больной К., 57 лет. Диагноз: ишемическая болезнь сердца (ИБС), состояние после транслюминальной баллонной коронарной ангиопластики со стентированием передней нисходящей артерии, атеросклероз сонных артерий, гиперхолестеринемия. Терапия Мертенилом 40 мг/сут в течение трех месяцев позволила снизить показатель ХС ЛПНП на 23% (с 3,92 до 3,03 ммоль/л) и объем атеромы на 21% (с 62 до 49 мм3).
Больной З., 64 года. Диагноз: ИБС, стенокардия напряжения функционального класса II, состояние после транзиторной ишемической атаки, АГ стадии II. На фоне приема Мертенила уровень ХС ЛПНП снизился на 62% (с 4,46 до 1,69 ммоль/л), объем атеромы – на 13% (с 368 до 320 мм3). «Если рутинно рассматривать с помощью УЗИ сонные артерии, величина стеноза не меняется, но бляшка как бы сжимается, усыхает. Мертенил® также продемонстрировал хороший профиль безопасности: на конец сентября 2014 г. не зафиксировано ни одного случая серьезных нежелательных явлений, плохой переносимости. Все пациенты продолжают участвовать в исследовании», – пояснил А.В. Сусеков.
Мертенил® зарекомендовал себя как наиболее мощный гиполипидемический препарат среди статинов. Это подтверждают и данные 24-недельного исследования «40 × 40», в котором оценивали гиполипидемическую эффективность и безопасность Мертенила в дозе 40 мг/сут у пациентов с очень высоким сердечно-сосудистым риском, не достигших целевого уровня ХС ЛПНП на фоне текущей терапии статинами в повседневной клинической практике4. Согласно полученным данным, дополнительное воздействие Мертенилом в дозе 40 мг/сут в течение 24 недель способствовало достоверному снижению уровня ОХС на 23%, ХС ЛПНП – на 35% (р < 0,001) при хорошей переносимости.
По словам докладчика, в нашей стране Мертенил® является первым и наиболее изученным препаратом, биоэквивалентным оригинальному розувастатину. В общей сложности в исследованиях, подтвердивших высокую эффективность и безопасность препарата Мертенил®, участвовало свыше 6500 пациентов. Очевидно, что для достижения эффективности статинов в отношении снижения риска сердечно-сосудистых заболеваний и их осложнений терапия должна быть длительной. Согласно метаанализу 189 работ, минимальный период лечения статинами атеросклеротических бляшек около 19,7 месяца5. «Имеется в виду адекватная терапия Мертенилом 40 мг, причем минимальная длительность лечения коронарных артерий составляет 12 месяцев, сонных – 27 месяцев», – подчеркнул А.В. Сусеков, завершая выступление.
Торможение сосудистого ремоделирования при артериальной гипертензии: как подобрать эффективную комбинацию
В начале своего выступления д.м.н., профессор кафедры терапии и кардиологии Иркутской государственной медицинской академии последипломного образования Константин Викторович ПРОТАСОВ отметил, что сосуды являются своеобразным плацдармом для развития АГ. Если рассматривать поражение сосудов при АГ с позиции сердечно-сосудистого континуума, несложно заметить, что на каждом этапе, начиная с факторов риска и заканчивая тяжелыми симптомными сердечно-сосудистыми заболеваниями, имеется определенная последовательность поражения сосудов.
На этапе функциональной стадии АГ фундаментальным сдвигом считается дисфункция эндотелия, затем гиперреактивность сосудов и вазоспазм. В центре этого континуума – стойкая АГ с бессимптомным субклиническим ремоделированием сосудов, которое выражается в утолщении стенки, артериолосклерозом, разряжением сосудистого русла, повышением жесткости сосудов и в конечном итоге субклиническим атеросклерозом. На завершающем этапе – ИБС, периферический атеросклероз, аневризма аорты и сердечно-сосудистая смерть.
Доказано прогностическое значение дисфункции эндотелия: ее наличие трехкратно увеличивает риск сердечно-сосудистых событий6.
Функцию эндотелия следует определять, во-первых, молодым пациентам с невысоким сердечно-сосудистым риском для уточнения дальнейшей тактики их ведения, а во-вторых, больным для прогнозирования сердечно-сосудистых исходов и эффективности лечения.
Золотым стандартом оценки признаков АГ, в частности ремоделирования сосудов (определение толщины комплекса «интима – медиа»), является каротидная ультрасонография. Особый интерес также вызывают характеристики жесткости сосудистой стенки – скорость распространения пульсовой волны (СРПВ) по аорте, центральное давление в аорте. Большая прогностическая ценность повышенной СРПВ характерна для пациентов среднего возраста в отсутствие признаков поражения других органов-мишеней.
В настоящее время наибольшую значимость в медикаментозной коррекции эндотелиальной дисфункции имеют два класса препаратов – ингибиторы ангиотензинпревращающего фермента (АПФ) и статины.
Что касается снижения жесткости сосудов с помощью антигипертензивных препаратов, интерес представляют два завершенных контролируемых исследования. В исследовании PREMIER (2001 г.) показано, что на фоне применения комбинации «периндоприл + индапамид» в большей степени, чем при лечении атенололом, снижается центральное давление в аорте7. Результаты исследования CAFÉ-ASCOT продемонстрировали, что комбинация ингибитора АПФ и амлодипина не только снижает центральное давление в аорте, но и улучшает сердечно-сосудистый прогноз8. В целом, по мнению докладчика, проблема выбора наиболее эффективной комбинации антигипертензивных препаратов для торможения сосудистого ремоделирования остается нерешенной.
«В нашей академии в течение года проводится исследование динамики маркеров поражения сосудов у больных АГ высокого риска под влиянием различных режимов комбинированной антигипертензивной терапии с целью выявления клинических тонкостей их воздействия на отдельные параметры жесткости сосудов», – констатировал профессор К.В. Протасов. В исследовании участвуют 75 пациентов (40 мужчин, 35 женщин) с АГ высокого риска, как правило 2–3-й степени (56%). Средний возраст пациентов – 52,2 ± 8,6 года, длительность АГ – 10,6 ± 9,6 года. Согласно исходной характеристике состояния сосудов, 95% участников исследования имеют дисфункцию эндотелия, 80% – поражение сонной артерии, более 30% – повышенную жесткость аорты.
Докладчик ознакомил участников симпозиума с результатами первого этапа исследования (24 недели). В ходе исследования оценивали влияние на ремоделирование сосудов:
-
фиксированной комбинации ингибитора АПФ и амлодипина – препарата Экватор®;
-
комбинации препаратов Экватор® и Мертенил® 20 мг;
-
комбинации препаратов Экватор® и Верошпирон (спиронолактон) 25 мг.
Все участники были рандомизированы на четыре группы – группу Экватора (n = 25), группу Экватора и Мертенила (n = 20), группу Экватора и Верошпирона (n = 11) и контрольную группу стандартного антигипертензивного лечения (n = 19). Изначально Экватор® назначали в дозе 5/10 мг с последующим увеличением дозы (5/20 мг, 10/20 мг) у ряда пациентов.
Степень снижения АД оценивали строго по данным его суточного мониторирования. Данные показали высокую антигипертензивную эффективность комбинаций «Экватор® и Мертенил®» и «Экватор® и Верошпирон»: в группе Экватора и Мертенила уровня АД < 130/80 мм рт. ст. достигли 80%, группе Экватора и Верошпирона – 73% пациентов, группе Экватора – 64%, контрольной группе – 39%.
Во всех трех группах, за исключением контрольной, отмечался достоверный прирост эндотелийзависимой вазодилатации плечевой артерии (р < 0,05). Анализ динамики центрального давления в аорте продемонстрировал наибольшую достоверную степень снижения показателей, особенно в отношении аугментационного индекса, в группах Экватора и Экватора и Мертенила (р < 0,05). Во всех группах отмечалось снижение СРПВ, но пока недостоверное.
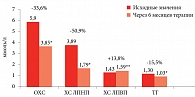
«Порадовали результаты липидного обмена в группе, получавшей комбинацию препаратов Экватор® и Мертенил®. За шесть месяцев терапии уровень ОХС снизился на 33,6%, ХС ЛПНП – почти на 51%, ТГ – на 15,5%, а уровень ЛПВП увеличился почти на 14%», – отметил профессор К.В. Протасов (рис. 2).
Из побочных эффектов на фоне применения различных комбинаций препаратов в 12% случаев имел место сухой кашель, в 2,7% – отеки голени.
В заключение профессор К.В. Протасов сформулировал несколько выводов.
Во-первых, для оценки сосудистого ремоделирования у больных АГ наиболее информативным и доступным методом является ультразвуковое исследование (дуплексное сканирование) сонной артерии.
Во-вторых, требуют широкого внедрения в реальную клиническую практику методы оценки жесткости сосудистой стенки (СРПВ, центральное давление в аорте).
В-третьих, у пациентов с АГ высокого риска прием фиксированной комбинации амлодипина и лизиноприла (Экватор®) приводит к значительному улучшению функции эндотелия, снижению жесткости аорты.
В-четвертых, максимальный гипотензивный эффект достигается на фоне применения комбинации Экватора и Верошпирона (спиронолактона).
И наконец, в-пятых, использование комбинации Экватора и Мертенила 20 мг способствует двукратному снижению уровня холестерина ЛПНП, а также максимальному снижению индекса аугментации.
НАЖБП и сердечно-сосудистый риск. Гепатокардиальные связи
Неалкогольная жировая болезнь печени (НАЖБП) привлекает внимание не только гепатологов, гастроэнтерологов, но и кардиологов. По мнению д.м.н., профессора кафедры пропедевтики внутренних болезней Первого Московского государственного медицинского университета им. И.М. Сеченова Оксаны Михайловны ДРАПКИНОЙ, НАЖБП можно считать дополнительным независимым фактором риска сердечно-сосудистых заболеваний, в том числе атеросклероза: «Атеросклероз – это болезнь печени. И что хорошо для сердца, то хорошо и для печени. Поэтому, если мы с помощью статинов, особенно розувастатина, снижаем сердечно-сосудистый риск, мы улучшаем и функцию печени».
Изучению патогенетических аспектов заболевания посвящено множество современных исследований. Но инсулинорезистентность, окислительный стресс и воспалительный процесс по-прежнему считаются ключевыми патогенетическими механизмами НАЖБП. Процесс биохимических изменений начинается с инсулинорезистентности. Утрата чувствительности к инсулину гормонозависимых тканей приводит к дисбалансу липидного обмена. Активируются ферменты, расщепляющие ТГ в жировой ткани, высвобождающиеся жирные кислоты накапливаются в печени. В гепатоцитах блокируется бета-окисление жирных кислот, и ферментная система печени не способна метаболизировать их избыток.
Таким образом, инсулинорезистентность приводит к чрезмерному поглощению гепатоцитами высвобождающихся свободных жирных кислот и формированию стеатоза. На фоне стеатоза и образования активных форм кислорода за счет сложных взаимодействий между клетками иммунной системы, макрофагами, гепатоцитами стеатоз трансформируется в стеатогепатит.
При НАЖБП жировая ткань находится в условиях персистирующего воспаления, сопровождающегося повышенным синтезом провоспалительных цитокинов. Среди них следует выделить ФНО-альфа, который снижает секрецию адипонектина, адипокина, обладающего противоатерогенными свойствами. По словам докладчика, в настоящее время на клиническом уровне получены данные, подтверждающие, что НАЖБП – хронический воспалительный процесс9, 10. Например, в ходе исследований у некурящих пациентов со стеатозом печени отмечался повышенный уровень СРБ, фибриногена по сравнению с пациентами без признаков стеатоза. Кроме того, наблюдалась корреляция между уровнем СРБ и ИЛ-6 и степенью воспаления и фиброза при НАЖБП.
«Все большее распространение получает концепция, согласно которой атеросклероз – хронический воспалительный процесс. Не случайно СРБ играет особую роль на всех стадиях сердечно-сосудистого континуума. Сначала он нужен для того, чтобы бляшка сформировалась, а затем – для того, чтобы она разорвалась11», – констатировала профессор О.М. Драпкина. Именно СРБ, который имеет большое значение в отношении прогноза воспаления при НАЖБП, выбран в качестве маркера воспаления в исследовании JUPITER, посвященном оценке влияния розувастатина на субклинический атеросклероз3.
По мнению профессора О.М. Драпкиной, изменяющиеся в ходе лечения функция эндотелия и показатели жесткости, тонуса сосудов и микроциркуляции представляются ранними маркерами поражения сердечно-сосудистой системы, позволяющими прогнозировать отдаленный эффект терапии. В качестве примера она привела результаты клинического исследования «СТРЕЛА», целью которого стала оценка влияния розувастатина (Мертенила) на показатели микроциркуляции и функцию эндотелия сосудов у пациентов с АГ и дислипидемией в сравнении с аторвастатином12. В исследовании приняли участие 82 пациента старше 35 лет с АГ высокого риска (риск по SCORE > 5%) и дислипидемией. Они были рандомизированы в группу Мертенила (n = 42) и группу аторвастатина (n = 40). Участники исследования исходно получали вместе с базовой терапией 5 мг Мертенила или 10 мг аторвастатина с последующей титрацией дозы до 10 мг Мертенила и 20 мг аторвастатина. Период наблюдения составил пять недель.
Оценка изменения параметров пульсовой волны по завершении основной терапии показала достоверное (р < 0,05) снижение индекса жесткости в обеих группах, но более выраженное в группе Мертенила – -0,89 м/с (в группе аторвастатина – -0,87 м/с). При оценке эндотелиальной функции в обеих группах выявлен прирост амплитуды пульсовой волны – 1,82 для группы аторвастатина и 1,95 для группы Мертенила. Соответственно более выраженное увеличение прироста амплитуды пульсовой волны отмечалось в группе Мертенила.
На фоне терапии Мертенилом и аторвастатином также удалось добиться целевых значений липидограммы. При этом отмечалось достоверно более значимое снижение уровней ОХС и ХС ЛПНП в группе Мертенила по сравнению с группой аторвастатина (р < 0,001).
Таким образом, добавление Мертенила к стандартным антигипертензивным препаратам способствовало повышению эффективности лечения и улучшению эластичности сосудов.
Профессор О.М. Драпкина привела убедительные доказательства того, что атеросклероз можно считать болезнью печени: «Жирная печень – это путь к атеросклерозу, поскольку само по себе наличие бомбы замедленного действия в виде ТГ и холестерина в печени у пациента увеличивает риск развития клинического атеросклероза. В плане неизбежной полипрагмазии розувастатин является препаратом выбора».
Заключение
Доказано, что Мертенил® – статин нового поколения, наиболее изученный и терапевтически эквивалентный оригинальному розувастатину, способен улучшать прогноз и течение сердечно-сосудистых заболеваний. Это подтверждают и данные, приведенные докладчиками.
Предварительные результаты исследования «ФРЕГАТ», посвященного оценке эффективности трехмесячной интенсивной терапии препаратом Мертенил® в дозе 40 мг/сут у пациентов с очень высоким сердечно-сосудистым риском, продемонстрировали способность Мертенила приводить к регрессии каротидного атеросклероза.
Данные 24-недельного исследования влияния различных комбинаций гипотензивной терапии на ремоделирование сосудов у больных АГ высокого риска показали наибольшую эффективность фиксированной комбинации амлодипина и лизиноприла – препарата Экватор® в улучшении эндотелиальной функции, а в сочетании с Мертенилом – в двукратном снижении ХС ЛПНП и ремоделировании сосудов в целом.
Высокая способность Мертенила улучшать показатели жесткости сосудистой стенки и микроциркуляции была продемонстрирована в исследовании «СТРЕЛА». Результаты подтвердили более высокую эффективность Мертенила по сравнению с аторвастатином как в повышении эластичности сосудов, так и в снижении уровня ХС ЛПНП у пациентов с АГ высокого риска и дислипидемией.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.