Российское общество акушеров-гинекологов (РОАГ)
- Аннотация
- Статья
- Ссылки
Данный выпуск информационного письма РОАГ посвящен коррекции метаболизма эстрогенов, как профилактике пролиферативных заболеваний женской репродуктивной системы.
Гинекологи, маммологи, врачи общей практики сегодня придают особое значение ранней диагностике и профилактике пролиферативных процессов. Это связано с тем, что подобные заболевания в случаях их неудержимого процесса приводят женщин, с одной стороны, к необходимости использовать и постоянно менять гормональные препараты, обладающие большим количеством нежелательных побочных эффектов. С другой стороны, для лечения некоторых гиперпластических процессов показано оперативное вмешательство, что не гарантирует пациенток от рецидива. И одна из самых тревожных ситуаций – это возможная трансформация пролиферации в онкологические заболевания.
Нарушениями, которые способствуют поддержанию пролиферации, являются дисбаланс ферментативных систем, отвечающих за метаболизм эстрогенов, иммунный дисбаланс, инфекционные агенты, снижение антиоксидантных свойств. Изучение этих проблем представляется особенно важным для решения органосберегающих методов лечения и профилактики пролиферативных процессов женской репродуктивной системы.
Данный выпуск информационного письма РОАГ посвящен коррекции метаболизма эстрогенов, как профилактике пролиферативных заболеваний женской репродуктивной системы.
Гинекологи, маммологи, врачи общей практики сегодня придают особое значение ранней диагностике и профилактике пролиферативных процессов. Это связано с тем, что подобные заболевания в случаях их неудержимого процесса приводят женщин, с одной стороны, к необходимости использовать и постоянно менять гормональные препараты, обладающие большим количеством нежелательных побочных эффектов. С другой стороны, для лечения некоторых гиперпластических процессов показано оперативное вмешательство, что не гарантирует пациенток от рецидива. И одна из самых тревожных ситуаций – это возможная трансформация пролиферации в онкологические заболевания.
Нарушениями, которые способствуют поддержанию пролиферации, являются дисбаланс ферментативных систем, отвечающих за метаболизм эстрогенов, иммунный дисбаланс, инфекционные агенты, снижение антиоксидантных свойств. Изучение этих проблем представляется особенно важным для решения органосберегающих методов лечения и профилактики пролиферативных процессов женской репродуктивной системы.



Информационное письмо
Существуют 3 физиологически важных эстрогена:
- эстрон (Е1),
- эстрадиол (Е2),
- эстриол (Е3).
У небеременной взрослой женщины эстрадиол является главным стероидом яичников. Эстрона яичник секретирует в 2 раза больше, чем эстрадиола, причем активность первого составляет 10% от второго. Эстриол – наименее активный из 3 указанных эстрогенов и у небеременных женщин образуется лишь при метаболической деградации эстрона и эстрадиола. Однако плацента производит значительные количества эстриола, и при беременности этот гормон играет важную роль. Непосредственными предшественниками эстрона и эстрадиола являются андрогены (андростендион и тестестерон). Решающей стадией в синтезе эстрогена является ароматизация А-кольца с одновременным удалением метильной группы положения С-19. Это превращение катализирутся ферментом ароматазой (Р450CYP19), для него необходимы НАДФ и О2, происходит оно в гладком эндоплазматическом ретикулюме. Основная часть эстрогенов синтезируется гранулярными клетками из андрогенов, предоставляемых тканью оболочки. Малая часть эстрогенов вырабатывается клетками оболочки. Яичник – первичный источник циркулирующего эстрадиола, а эстрон поступает из ряда других источников. Кроме яичников кора надпочечников секретирует некоторое количество эстрона, значительное количество этого эстрогена образуется в результате ароматизации андростендиона в других тканях. Жировая ткань является главной областью этого превращения и может стать клинически важным источником эстрона.
После синтеза эстрогены поступают в системный кровоток. В системном кровотоке большая часть (95%) эстрогенов связывается с белком, который переносит гормоны (SHBG-sex hormone binding globulin – глобулин, связывающий половые гормоны). Связанные гормоны являются «оперативным» запасом организма и в случае возрастания потребности в них мобилизуются из связанного состояния, переходя в свободную форму. Лишь небольшая часть эстрогенов находится в свободном состоянии. Биологической активностью обладает только свободная форма гормона. Свободная фракция эстрогенов, благодаря липофильности легко проникает в клетку.
Но необходимо учитывать наличие в клетке 2 видов рецепторов к эстрогену, а именно альфа (ERà) и бета (ERß) изоформ. Взаимодействие эстрогенов с рецептором альфа приводит к активной стимуляции экспрессии эстроген-зависимых генов, в то время как взаимодействие с бета – к относительно более слабому пролиферативному сигналу.
Ранние этапы реализации гормонального эффекта – это изменение уровней метаболических процессов, протекающих в клетке через 1–24 часа или более после начала взаимодействия ее с гормоном. Наиболее значимыми являются ранние гормональные эффекты, сопряженные с увеличением общего количества структурных и функциональных белков в клетке и обусловливающее увеличение ее массы и размеров.
Поздние этапы реализации гормонального эффекта – это процессы, развивающиеся в клетках-мишенях после 24–48 часов от начала введения гормона. Наиболее ярко поздние события проявляются лишь при длительном и многократном введении гормональных веществ.
Существует спектр ферментов, участвующих в метаболизме эстрогенов, – цитохромы Р450 (CYP 450) м гидроксистероиддегидрогеназы (HSD).
(HSD)-ферменты, вовлеченные в конверсию стероидных гормонов посредством образования их гидроксипроизводных в положениях углерода 3, 5, 11, 17 и 20. Класс ферментов, осуществляющих присоединение гидроксила в положении 17 эстрона (Е1), называются 17ß-гидроксидстероид дегидрогеназы (17ß-HSD). Биохимическая роль изоформы 17ß-HSD1 – конверсия Е1 в более активный Е2, тогда как 17ß-HSD2 преобразует Е2 в Е1 посредством элиминации гидроксила. Наиболее активным стимулятором 17ß-HSD2 является прогестерон и его производные.
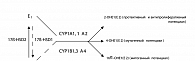
Метаболическая активность эстрогенов модулируется посредством особых ферментных систем – цитохромов Р450. Эти ферменты составляют основу монооксигеназной системы печени и катализируют образование гидроксипроизводных эстрогенов. Как субстрат, процесс может катализироваться разными цитохромами Р450, и в зависимости от этого образуются разные, зачастую противоположные по своим свойствам метаболиты. Среди цитохромов в конверсию эстрогенов вовлечены изоформы CYP1А1 и CYP1В1. Первая форма катализирует присоединение гидроксила в положении 2 углерода в молекуле эстрона (Е1) и образуется 2-гидроксипроизводное (2-ОНЕ1), тогда как вторая – в положениях 4 и 16 с образованием 16à-гидрокси- и 4-гидроксипроизводных (16à-ОНЕ1 и 4-ОНЕ1), причем 4-ОНЕ1 образуется меньше, чем 16à-ОНЕ1. Вторая изоформа CYP1В1 является конститутивной, ее экспрессия все время стимулируется эстрогенами, которые фермент в свою очередь конверсирует в более активные метаболиты. Что касается первой изоформы, то она появляется при наличии «соответствующего» субстрата.
В процессах, которые запускают пролиферативные заболевания женской репродуктивной системы, важную роль играют не только сами эстрогены, но и их метаболиты. Было показано, что эстрон и эстрадиол представляют собой только 10–15% от всего количества эстрогеновых производных, а 85–90% – это метаболиты эстрогенов (преимущественно гидроксипроизводные).
2-гидроксиэстрон (2-ОНЕ1) является антиэстрогеном: связываясь с эстрогеновыми рецепторами, он оказывает блокирующее действие и способен индуцировать апоптоз в клетках .
16α-гидроксиэстрон (16α-ОНЕ) является мощным агонистом эстрогенов: необратимо и длительно связывается с эстрогеновыми рецепторами, что обеспечивает их постоянную стимуляцию, усиливает пролиферацию клеток, по своей активности он значительно превосходит 2-ОНЕ1.
4-гидроксиэстрон (4-ОНЕ1) является агонистом эстрогенов, так же как и 16α-ОНЕ1, но еще обладает способностью повреждать ДНК клеток через фермент тирозинкиназу.
Основные этапы передачи гормонального сигнала:
- Гормон
- Комплекс гормон-рецептор
- Транспорт комплекса гормон-рецептор в ядро
- Взаимодействие с ДНК (энхансер, сайленсер)
- Индукция или репрессия синтеза белков
- Изменение количества белков (ферментов)
- Изменение скорости метаболизма (изменение функции клетки)
- Физиологический эффект эстрогенов.
Исследования уровней метаболитов 2-ОНЕ1/16α-ОНЕ1(ИМЕ) проводилось при различных пролиферативных заболеваниях женской репродуктивной системы, в частности раке тела матки, раке молочной железы. Во многих странах, включая США, с 2001 года проводится определение ИМЕ по моче с целью определения групп риска по развитию эстрогензависимых пролиферативных заболеваний и оценки эффективности коррекции эстрогенового баланса.
Данные уровня метаболитов
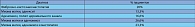
Уровень 16a-гидроксиэстрона у здоровых женщин:
2–40 ng/ml (пременопауза), 0.6–10 ng/ml (постменопауза).
Уровень 2-гидроксиэстрона у здоровых женщин:
4–100 ng/ml (пременопауза) 1 - 20 ng/ml (постменопауза).
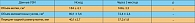
Индекс метаболитов эстрогена:
0.6–6 (у здоровых женщин в пре- и постменопаузе).
Средний уровень индекса метаболитов эстрогена (2OHE1/16aOHE1):
2.3 (пременопауза), 2.0 (постменопауза).
Однако нельзя не учитывать и неблагоприятные факторы внешней среды, способные также повлиять на пути превращения эстрогенов, такие как курение, контакт с инсектицидами и фталатами, потребление гормонов (в том числе и с продуктами питания), ожирение, заболевания желудочно-кишечного тракта, стрессы, дефицит нутриентов. В сочетании эти факторы способны запускать механизм пролиферативных заболеваний женской репродуктивно й системы.
Учитывая огромные компенсаторные возможности организма, дисбаланс метаболитов эстрогенов может существовать длительное время без клинических проявлений, и выявить подобные нарушения можно только с учетом специфических тестов. Клиническая значимость выявления нарушений баланса метаболитов эстрогенов крайне актуальна.
При неблагоприятном соотношении метаболитов 2/16α-ОНЕ1 (ИМЕ) менее 2 и отсутствии пролиферативных заболеваний женской репродуктивной системы необходимо корректировать уровень ИМЕ выше 2, тем самым снизить риск возникновения этих заболеваний.
ОАО «ДИОД» представил новый парафармацевтический препарат Стелла. Он разработан на основе рекомендаций РОАГ под руководством президента, академика РАМН В.Н. Серова по использованию активных фитосоединений для регуляции и коррекции метаболизма эстрогенов. Основой являлся отчет Всемирного фонда исследования рака «Продукты питания и предупреждение рака: глобальная перспектива» (1995 г.), где рекомендованы вещества вторичного биосинтеза, полученные из лекарственных и пищевых растений, обладающие антипролиферативным, антимутагенным действием. В основе препарата лежит использование сразу потенциала 3 активных соединений, таких как индол-3-карбинол,
100 мг, эпигаллокатехин-3-галлат, 60 мг, изофлавоны сои, 60 мг.
Основные механизмы коррекции:
- Стимулирование предпочтительного (2-гидрокси-) пути детоксикации эстрогенов:
- индол-3-карбинол;
- соевые изофлавоны (генистеин и дзадзеин).
- Ингибирование нежелательных (16-гидрокси- и 4-гидрокси-) путей метаболизма эстрогенов:
- соевые изофлавоны.
- Модулирование функции рецепторов женских половых гормонов:
- индол-3-карбинол;
- соевые изофлавоны;
- эпигаллокатехин-3-галлат.
- Снижение активности ароматазы:
- эпигаллокатехин-3-галлат.
- Уменьшение выработки белка, связывающего эстрогены:
- изофлавоны сои.
- Предупреждение тонкокишечно-печеночной рециркуляции эстрогенов:
- изофлавоны сои.
- Борьба с оксидативным стрессом:
- эпигаллокатехин-3-галлат.
Данный препарат прошел добровольную сертификацию на основе клинических испытаний и доказал эффективность как комплекс, способствующий нормализации обмена эстрогенов.
Все пациентки в течение 1 месяца принимали БАД Стелла, по 1 капсуле желтого цвета утром, по 1 капсуле зеленого цвета днем, по 1 капсуле красного цвета вечером во время еды в течение 1 месяца. Через 1 месяц после проведения исследования уровня метаболитов было решено продолжить прием БАД Стелла у пациенток с патологией репродуктивной системы еще в течение 2 месяцев.
Через 1,3 месяца на фоне приема БАД было выявлено статистически достоверное изменение значений метаболитов: увеличение значений 2-ОНЕ и снижение 16α-ОНЕ, также ИМЕ достоверно увеличилось. Не было выявлено зависимости значений уровней метаболитов от установленного диагноза.
Контрольное УЗИ молочных желез проводилось в те же сроки менструального цикла, что и исходное исследование. Через 3 месяца после приема БАД Стелла отмечалось по УЗИ уменьшение плотности тканей, исчезновение отека и изменения в кистах в сторону их уменьшения в размерах на 2–3мм (с 1,2–1,5 до 0,9–1,2 см в диаметре).
Большинство пациенток (87,5%) с миомой и аденомиозом предъявляли жалобы, у 3 пациенток с миомой диагноз поставлен после проведения УЗИ. При оценке клинических проявлений было выявлено уменьшение болей при менструации, объема кровопотери, сокращение дней менструаций, нормализация менструального цикла.
У 6 пациенток было выявлено повышение эстрадиола до использования БАД, при этом эти значения колебались от 458 000 пг/мл до 370 000 пг/мл (N в 1 фазу цикла 57.000–227.000 пг/мл), при повторном исследовании эстрадиола через 3 месяца после приема БАД отметилась тенденция к снижению эстрадиола – от 380 000 пг/мл до 343 000 пг/мл.
За весь период исследования не было выявлено нежелательных явлений: все пациентки отметили хорошую переносимость БАД.
Таким образом, через 1 месяц после приема БАД Стелла отмечалось увеличение уровня 2-ОНЕ и соотношение 2-ОНЕ/16α-ОНЕ у всех участников исследования: как у пациенток с патологией репродуктивной системы, так и у относительно здоровых женщин, что подтверждает эффективность и безопасность.
Рекомендации по употреблению БАД Стелла.
- Для профилактики гормонозависимых заболеваний женской репродуктивной системы по 1 капсуле из каждого блистера курсом 1 месяц 1–2 раза в год всем практически здоровым женщинам с целью коррекции возможных нарушений метаболизма эстрогенов на этапе клинического здоровья (компенсаторной и дезадаптационной стадиях) и предболезни.
- В качестве вспомогательного (неосновного) средства в составе комплексной терапии (гормональной, нейротропной, метаболической) гормонозависимых заболеваний женской репродуктивной системы курсом по 2 капсуле из каждого блистера в течение 1–3 месяцев с целью нормализации метаболизма эстрогенов, что практически не превышает верхние допустимые уровни потребления активных веществ.
Используя потенциал активных фитосоединений, полученных вторичным синтезом можно проводить коррекцию, профилактику многих заболеваний репродуктивной сферы и включать в комплекс лечебных мероприятий, без побочных эффектов и осложнений, присущих гормональному лечению.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.