количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Сахароснижающие препараты в лечении метаболического синдрома
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №2
- Аннотация
- Статья
- Ссылки
Метаболический синдром (МС) представляет собой комплекс патогенетически взаимосвязанных метаболических и сердечно-сосудистых нарушений, включающих артериальную гипертензию (АГ), инсулинорезистентность (ИР), нарушение толерантности к глюкозе (НТГ), абдоминальное ожирение и атерогенную дислипидемию [1].
Метаболический синдром (МС) представляет собой комплекс патогенетически взаимосвязанных метаболических и сердечно-сосудистых нарушений, включающих артериальную гипертензию (АГ), инсулинорезистентность (ИР), нарушение толерантности к глюкозе (НТГ), абдоминальное ожирение и атерогенную дислипидемию [1].
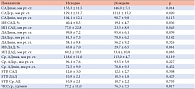
Таблица. Результаты на фоне 24-недельной монотерапии метформином

Рис. 1. Динамика уровня глюкозы на фоне монотерапии метформином
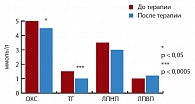
Рис. 2. Динамика показателей липидного обмена на фоне монотерапии метформином
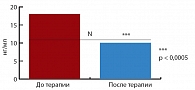
Рис. 3. Динамика уровня лептина на фоне терапии метформином
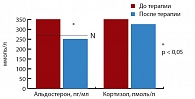
Рис. 4. Динамика уровня альдостерона и кортизола на фоне терапии метформином
Метаболический синдром (МС) является серьезной медико-социальной проблемой. Распространенность этого синдрома в настоящее время достигла уровня эпидемии. Около 64% населения развитых стран страдают ожирением [2, 3].
МС может быть причиной угрожающих жизни сердечно-сосудистых заболеваний (ССЗ) и СД 2 типа. В связи с этим в мире проводится большое число научных исследований, направленных на поиск и разработку эффективных методов лечения и профилактики МС и его осложнений. Пристальное внимание уделяется изучению метаболических эффектов лекарственных препаратов, применяемых для лечения больных с МС, и их безопасности.
Одним из препаратов, зарекомендовавших себя в качестве профилактики СД 2 типа и ССЗ, является метформин. В настоящее время метформин – единственный бигуанид, рекомендованный для фармакотерапии больных СД 2 типа [4, 5]. Вопреки тому, что метформин применяется в лечебной практике в течение довольно длительного времени, детальные механизмы его действия остаются до конца не ясными. Первичный антигипергликемический эффект метформина вызван снижением синтеза глюкозы печенью, а также продукции свободных жирных кислот (СЖК), окисления жира и частично − усилением периферического захвата глюкозы [6, 7].
Антигипергликемические эффекты метформина − это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой ткани [8]. Хотя преобладающим является влияние метформина на продукцию глюкозы печенью, именно комбинация его эффектов на уровне всех трех тканей, по-видимому, обусловливает благоприятный фармакологический профиль препарата. В ряде плацебоконтролируемых исследований показано, что инсулинозависимое поглощение глюкозы повышается на 20–30% под влиянием метформина [5, 6]. Метформин осуществляет антигипергликемическое действие, в основном снижая продукцию глюкозы печенью, которая в 2–3 раза повышена у больных c МС и СД 2 типа.
Исследования in vivo и in vitro показали, что этот механизм действия препарата связан с подавлением процессов глюконеогенеза и, в меньшей степени, гликогенолиза, что приводит к снижению на 25–30% уровня гликемии натощак [9]. Хорошо известно, что важным этапом обеспечения компенсации углеводного обмена является достижение нормогликемии натощак. Последствия повышенной гепатической продукции глюкозы в ночное время у больных с МС и СД типа 2 крайне неблагоприятны ввиду стимуляции процессов атерогенеза и развития резистентности к действию сахароснижающих препаратов в течение дня [10].
Метформин способствует подавлению глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол и некоторых аминокислот, а также противодействует глюконеогенетическому действию глюкагона. В первую очередь это происходит вследствие торможения поступления перечисленных субстратов глюконеогенеза в гепатоциты и ингибирования его ключевых ферментов − пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы [7]. Препарат, усиливая кровообращение в печени и ускоряя процесс превращения глюкозы в гликоген, увеличивает синтез гликогена в печени [11]. Наряду с этим, возрастает утилизация глюкозы скелетными мышцами и жировой тканью, что приводит к повышению чувствительности тканей к инсулину на 18–50%.
В мышечной и жировой ткани метформин повышает связывание инсулина с рецепторами, увеличивает их число и аффинность [12]. Кроме того, происходит активирование пострецепторных механизмов действия инсулина, в частности тирозинкиназы и фосфотирозин фосфатазы. Оказывая влияние на всасывание углеводов в желудочно-кишечном тракте, замедляя его скорость, а также снижая аппетит, метформин способствует уменьшению постпрандиальной гликемии. Кроме того, метформин значительно повышает утилизацию глюкозы в кишечнике, усиливая в нем анаэробный гликолиз, как в состоянии насыщения, так и натощак. Поэтому интестинальные эффекты метформина вносят существенный вклад в предотвращение постпрандиальных пиков гликемии, ассоциированных с риском преждевременной смертности от сердечно-сосудистых заболеваний. В результате на фоне терапии метформином постпрандиальная гликемия снижается в среднем на 20–45%.
Повышая печеночную и периферическую чувствительность к эндогенному инсулину, метформин напрямую не влияет на секрецию инсулина. При этом на фоне уменьшения инсулинорезистентности снижается базальный уровень инсулина в сыворотке крови. Благодаря всем указанным эффектам метформина, происходит снижение уровня глюкозы без риска гипогликемических состояний, что является несомненным достоинством препарата. Наряду с этим, метформин обладает рядом других метаболических эффектов, включая и влияние на жировой обмен [11].
Лечение бигуанидами оказывает благоприятный эффект на метаболизм липидов плазмы в связи с гиполипидемическим и антиатерогенным действием. Метформин обладает способностью снижать на 10–30% окисление СЖК. Снижая концентрацию СЖК, он не только улучшает чувствительность к инсулину, но и способствует коррекции нарушенной секреции инсулина. Лечение метформином сопровождается снижением концентрации триглицеридов (ТГ) (на 10–20%) и, как следствие, снижением печеночного синтеза и повышением клиренса липопротеидов очень низкой плотности (ЛПОНП) [5, 6, 13].
Снижение поступления СЖК в печень, синтеза триглицеридов и повышение чувствительности к инсулину сопровождается уменьшением отложения жира в этом органе. Кроме того, уменьшение концентрации и окисления СЖК способствует улучшению профиля действия эндогенного инсулина.
Снижая уровень СЖК, метформин улучшает не только чувствительность тканей к инсулину, но и секрецию инсулина, а также обладает протективными эффектами в отношении липо- и глюкозотоксичности [12].
Наряду с хорошо известным антигипергликемическим действием метформин обладает целым рядом кардиопротективных эффектов. Первым крупным исследованием, подтвердившим кардиопротективную эффективность метформина (Глюкофажа) у больных СД 2 типа, явилось многоцентровое рандомизированное исследование UKPDS (UK Prospective Diabetes Study, 1998). Результаты исследования показали, что применение Глюкофажа, в отличие от лечения препаратами сульфонилмочевины, позволило достоверно снизить риск сосудистых осложнений на 40% [14].
В последнее время большое внимание уделяется активной профилактике СД 2 типа [15, 16]. В крупнейшем исследовании DPP (Diabetes Prevention Program, 2002) было показано, что терапия Глюкофажем может эффективно и безопасно предотвращать развитие СД 2 типа у пациентов с НТГ, особенно у пациентов с индексом массы тела (ИМТ) более 25 и имеющих высокий риск развития СД [17]. Так, у пациентов с НТГ и избыточной массой тела, получавших Глюкофаж в дозе 850 мг дважды в сутки, отмечалось снижение риска развития СД 2 типа на 31% по сравнению с группой пациентов, не получавших медикаментозной терапии.
В отличие от производных сульфонилмочевины, инсулина и тиазолидиндионов, метформин обладает уникальным действием − он может стабилизировать и даже снижать массу тела у лиц с ожирением [18], в т.ч. без СД 2 типа. Многими исследователями высказывается положение, что терапия метформином сопровождается снижением именно висцеро-абдоминального отложения жира.
В связи с этим целью нашего исследование являлось изучение влияния 24-недельной монотерапии метформином на суточный профиль артериального давления, углеводный и липидный обмены, уровень лептина, пролактина, альдостерона, кортизола, тиреотропного гормона, Т3, Т4 у больных с метаболическим синдромом и артериальной гипертензией 1 степени.
Материалы и методы
В исследование было включено 20 пациентов обоего пола в возрасте от 30 до 60 лет с МС с высоким нормальным давлением и с АГ 1 степени (САД 130–159 мм рт. ст. и/или ДАД 85–99 мм рт. ст.), которые находились на монотерапии Глюкофажем по 850 мг 2 раза в день на протяжении 24 недель. Средний возраст пациентов на момент включения в исследование составил 47,03 ± 8,75 года, ИМТ 33,53 ± 5,59 кг/м², длительность АГ 2,91 ± 0,92 года, систолическое АД клиническое (САД кл.) 143,30 ± 7,59 мм рт. ст., диастолическое АД клиническое (ДАД кл.) 87,93 ± 6,31 мм рт. ст., уровень глюкозы натощак – 5,58 ± 0,75 ммоль/л, уровень ОХС 5,53 ± 0,97 ммоль/л, ХС ЛПВП 1,27 ± 0,35ммоль/л, ХС ЛПНП 3,56 ± 1,05 ммоль/л, ТГ 1,98 ± 0,46 ммоль/л. Такой фактор риска ИБС, как курение, отмечался у 24 человек.
Диагностическими критериями МС являлись Рабочие критерии МС, разработанные экспертами Международной федерации диабета (International Diabetes Federation, 2005) [19].
Критериями, исключавшими участие пациентов в исследовании, явились: инсульт любой этиологии в анамнезе, стенозы магистральных артерий головного мозга, умеренная и тяжелая АГ, АГ эндокринного генеза (гиперальдостеронизм, феохромацитома, болезнь Иценко–Кушинга, гипоталамический синдром); реноваскулярная и почечно-паренхиматозная АГ; злокачественная и рефрактерная АГ; сердечная и дыхательная недостаточность; ИБС: инфаркт миокарда в анамнезе, стенокардия; нарушения ритма сердца (частая экстрасистолия, мерцательная аритмия); СД 1 типа; СД 2 типа; нарушение функции почек (уровень креатинина крови выше 130 мкмоль/л); заболевания печени (гепатит, цирроз) и/или исходное повышение уровней АСТ и АЛТ на 20% и более от верхней границы нормы; беременность, лактация; злоупотребление алкоголем.
В исследование включались пациенты, не получавшие ранее антигипертензивную, гиполипидемическую и гипогликемическую терапию, а также терапию, направленную на снижение веса.
Исходно и через 24 недели терапии всем пациентам проводили физикальный осмотр и антропометрическое обследование: измерение роста, массы тела, окружности талии и бедер, расчет ИМТ. Характер распределения жировой ткани оценивали по отношению объема талии к объему бедер (ОТ/ОБ).
Проводили биохимическое исследование венозной крови (ОХС, ХС ЛПНП, ХС ЛПВП, ТГ, глюкоза, мочевая кислота). Для оценки толерантности к глюкозе использовался стандартный пероральный тест толерантности к глюкозе с определением уровней глюкозы, эндогенного инсулина и С-пептида. Измеряли АД клиническим методом Короткова и проводили СМАД.
Учитывая отсутствие нормальных значений содержания в крови лептина, была сформирована группа здоровых добровольцев из 20 человек (8 мужчин и 12 женщин), средний возраст которых составил 38,7 ± 7,9 лет, среднее значение ИМТ 22,7 ± 4,8 кг/м², средний уровень САД кл. 115 ± 6,3 мм рт. ст., средний уровень ДАД кл. 70 ± 5,8 мм рт. ст. Участникам данной группы проводилось определение уровня лептина в сыворотке крови, составившее 10,80 (6,52; 14,78) нг/мл. Полученные результаты принимались за норму.
Уровни инсулина и С-пептида определяли иммуноферментным методом с использованием наборов INSULIN и C-PEPTIDE на анализаторе IMMULITE (DPC, США). Обсчет результатов производили на IMMULITE 100 (США).
Уровень лептина определяли иммуноферментным методом с использованием наборов HUMAN LEPTIN (DSLabs, США) (N 10,80 (6,52; 14,78) нг/мл).
Уровень альдостерона, кортизола, ТТГ, Т3 и Т4 определяли радиоиммунным методом с использованием наборов фирмы Immunotech (Чехия) (N альдостерон 34–274 нг/мл, N кортизол 260–720 нмоль/л).
Уровень пролактина определяли электрохемилюминесцентным методом на анализаторе «Элесис 2010» (Roche, Австрия) (N пролактин: мужчины 86–324 мЕД/мл, женщины 102–496 мЕД/мл).
Статистическая обработка данных проводилась с использованием пакета компьютерных программ Statistica 6.0, предусматривающих возможность как параметрического, так и непараметрического анализа.
Результаты
У больных с АГ и МС на фоне терапии Глюкофажем в дозе 1700 мг/сут отмечалось снижение клинического АД: САД снизилось в среднем на 4% с 141,4 ± 7,4 мм рт. ст. до 136,1 ± 8,3 мм рт. ст. (р < 0,05), ДАД снизилось на 3% с 86,4 ± 8,4 мм рт. ст. до 83,3 ± 4,8 мм рт. ст. (р > 0,05), но недостоверно. Целевых уровней АД менее 130/80 мм рт. ст. по САД достигли 8 (40%) пациентов, по ДАД 9 (45%) больных, по САД и ДАД 6 (30%) пациентов. Уровень АД менее 140/90 мм рт. ст. зафиксирован у 9 (45%), 10 (50%) и 8 (40%) больных соответственно.
По результатам СМАД на фоне 24-недельной монотерапии метформином в целом по группе обнаружено достоверное снижение среднесуточных значений АД. Так, САДmах и САДср. снизилось с 153,3 ± 11,5 мм рт. ст. до 146,0 ± 7,1 мм рт. ст. (р = 0,014) и с 129,1 ± 11,7 до 121,1 ± 15,2 мм рт. ст. (р = 0,020) соответственно. ДАДmах также снизилось достоверно с 99,8 ± 7,2 мм рт. ст. до 95,4 ± 6,1 мм рт. ст. (р = 0,039). Кроме того, отмечена достоверная динамика показателей «нагрузки давлением» САД: ИВ САД снизился с 40,4% до 19,1% (р = 0,036), ИП САД − с 77,0 мм рт. ст. до 23,3 мм рт. ст. (р = 0,043). ИВ ДАД снизился с 43,8% до 29,6%, а ИП ДАД – с 69,2 мм рт. ст. до 33,4 мм рт. ст., но недостоверно в обоих случаях (р > 0,05) (см. табл.).
Вариабельность среднесуточных АД и ЧСС на фоне монотерапии метформином значимо не менялась. После 24 недель монотерапии метформином наблюдается высокодостоверная динамика всех антропометрических показателей. Масса тела уменьшилась с 92,22 ± 17,2 кг до 88,00 ± 15,8 кг (р < 0,0005), ИМТ снизился с 32,05 ± 5,17 кг/м² до 29,84 ± 5,22 кг/м² (р < 0,0005), ОТ − с 99,83 ± 11,74 см до 95,89 ± 10,81 см (р < 0,0005), а индекс ОТ/ОБ − с 0,92 ± 0,04 до 0,90 ± 0,04 (р < 0,0005).
На монотерапии Глюкофажем выявлено достоверное снижение уровня постпрандиальной глюкозы с 7,62 ± 1,56 ммоль/л до 6,46 ± 0,99 ммоль/л (р = 0,0003). Уровень глюкозы натощак значимой динамики не претерпел, до начала терапии составляя 5,67 ± 0,64 ммоль/л и после терапии 5,61 ± 0,57 ммоль/л (р > 0,05) (рис. 1). 24-недельная терапия привела к достоверному снижению уровня ОХС с 5,38 ± 0,75 ммоль/л до 4,97 ± 0,91 ммоль/л (р = 0,032) и уровня ТГ с 1,94 (1,74; 2,11) ммоль/л до 1,32 (1,12; 1,59) ммоль/л (р = 0,0004). Содержание ХС ЛПНП в сыворотке крови у пациентов с МС на фоне лечения достоверно не менялось, составляя 3,67 ± 0,97 ммоль/л до лечения и 3,46 ± 0,70 ммоль/л после лечения (р > 0,05). Отмечена тенденция к повышению уровня ХС ЛПВП с 1,26 ± 0,32 ммоль/л до 1,40 ± 0,29 ммоль/л (р = 0,063) (рис. 2). Исходно у 11 (55%) больных зафиксирован высокий уровень лептина по сравнению с контрольной группой, в которой он составил 10,80 (6,52; 14,78) нг/мл. Уровень лептина сыворотки крови в среднем по группе наблюдения − 17,27 (7,76; 23,96) нг/мл (р < 0,05).
На фоне 24-недельной монотерапии Глюкофажем у пациентов данной группы произошло значительное снижение уровня лептина до 10,72 (5,94; 16,58) нг/мл (р = 0,0004) (рис. 3). Терапия препаратом не привела к достоверной динамике уровня пролактина. До начала терапии повышение уровня альдостерона (максимально до 558,4 пг/мл) обнаружено у 11 пациентов (55%). На фоне монотерапии Глюкофажем произошло достоверное снижение уровня альдостерона в плазме крови с 369,16 (256,70; 428,20) пг/мл до 283,84 (242,35; 387,10) пг/мл (p = 0,036) (рис. 4).
До начала терапии у всех пациентов уровень кортизола сыворотки крови не выходил за рамки нормальных значений. После терапии достоверной динамики уровня кортизола в сыворотке крови в среднем по группе не обнаружено (рис. 4). До начала исследования у всех пациентов зафиксированы уровни ТТГ, Т3 и Т4, соответствующие норме. На фоне проводимой 24-недельной монотерапии метформином не было выявлено достоверного изменения уровней ТТГ, Т3 и Т4. Субъективная переносимость метформина в дозе 1700 мг/сут была хорошей. На протяжении всего исследования ни у одного пациента не отмечалось побочных реакций. Случаев повышения активности ферментов печени, уровней общего билирубина и креатинина крови не зарегистрировано.
Обсуждение результатов
Ведущие ученые, занимающиеся проблемой МС, склонны рассматривать его как предстадию атеросклероза и СД 2 типа. Ключевыми факторами патогенеза МС являются ожирение, ИР и АГ. Разнообразие клинических и метаболических проявлений МС требует назначения нескольких препаратов с различным механизмом действия. Это гиполипидемические, сахароснижающие, влияющие на чувствительность к инсулину и антигипертензивные препараты.
По данным нашего исследования, монотерапия Глюкофажем наряду с хорошим гипогликемическим эффектом оказала также позитивное влияние на показатели липидного обмена, АД, массы тела и висцерального ожирения. Так, отмечено достоверное снижение уровня ОХС, ТГ и тенденция к повышению уровня ХС ЛПВП, что согласуется с результатами ранее проводимых исследований. Гиполипидемический эффект Глюкофажа объясняется способностью препарата снижать концентрацию СЖК, что не только улучшает чувствительность к инсулину, но и способствует профилактике прогрессирования нарушения секреции инсулина у больных с МС. В целом нормализация концентраций СЖК приводит к устранению эффектов липотоксичности на всех уровнях, включая печень, жировую и мышечную ткань и островки Ларгенганса.
Суммируя эти наблюдения, можно предположить, что действие Глюкофажа на метаболизм липопротеидов вносит значительный вклад в его кардиопротективное действие.
На фоне терапии Глюкофажем у большинства пациентов отмечалось достоверное снижение массы тела, ОТ и индекса ОТ/ОБ. По результатам метаанализа 14 трайлов показано, что лечение Глюкофажем, приводит к достоверному снижению ИМТ, и наибольший эффект снижения ИМТ наблюдается у пациентов, принимавших его в дозе более 1500 мг/сут и длительностью более 8 недель [20].
В настоящем исследовании у больных с МС и АГ, получавших монотерапию Глюкофажем, отмечался хороший гипотензивный эффект по данным клинического измерения АД и показателей СМАД. По данным офисного измерения АД целевой уровень АД менее 130/80 мм рт. ст. достигли 30% пациентов, а уровня АД менее 140/90 мм рт. ст. − 40% больных. По результатам СМАД выявлено не только достоверное снижение среднесуточных показателей САД, но и показателей «нагрузки давлением» ИВ САД и ИП САД. Гипотензивный эффект Глюкофажа может быть обусловлен снижением массы тела вследствие уменьшения гиперинсулинемии [4, 6] и угнетения аппетита [21]. Наряду со снижением массы тела, ОТ, индекса ОТ/ОБ, характеризующих выраженность абдоминального ожирения, на фоне терапии Глюкофажем заметные изменения отмечались и в динамике уровня лептина в виде достоверного снижения его уровня. Схожие данные получены в результате исследования зависимости ИМТ и уровня тощакового инсулина от концентрации лептина сыворотки крови у пациентов с ожирением и АГ.
В ходе настоящей работы не выявлено какого-либо значимого влияния Глюкофажа на секрецию гормона аденогипофиза пролактина, средние значения которого до и после лечения не выходили за рамки нормы. Наши данные согласуются с результатами исследований влияния препарата на функцию аденогипофиза у пациенток с МС и синдромом поликистозных яичников [22].
В группе больных, принимавших Глюкофаж, до начала терапии было зафиксировано превышение концентрации альдостерона плазмы крови у 11 пациентов. На фоне монотерапии этим препаратом отмечено достоверное снижение уровня альдостерона у 8 больных. Этот неожиданный для сахароснижающего препарата эффект можно объяснить его способностью снижать центральную симпатическую активность [23]. Кроме этого, результатами проведенных исследований показано, что уменьшение массы тела сопровождается снижением уровня альдостерона плазмы крови. Еще одним возможным механизмом влияния Глюкофажа на секрецию альдостерона является его антиоксидантная активность, заключающаяся в торможении клеточных окислительных реакций [7, 9]. Снижая концентрацию и окисление СЖК, препарат усиливает их реэстерификацию, тем самым уменьшая концентрацию стимулирующих секрецию альдостерона агентов.
Заключение
Таким образом, больным с МС и АГ рекомендовано назначение бигуаниада Глюкофаж с целью коррекции метаболических нарушений, снижения массы тела и в целом снижения высокого риска развития ССЗ и СД 2 типа.
МС может быть причиной угрожающих жизни сердечно-сосудистых заболеваний (ССЗ) и СД 2 типа. В связи с этим в мире проводится большое число научных исследований, направленных на поиск и разработку эффективных методов лечения и профилактики МС и его осложнений. Пристальное внимание уделяется изучению метаболических эффектов лекарственных препаратов, применяемых для лечения больных с МС, и их безопасности.
Одним из препаратов, зарекомендовавших себя в качестве профилактики СД 2 типа и ССЗ, является метформин. В настоящее время метформин – единственный бигуанид, рекомендованный для фармакотерапии больных СД 2 типа [4, 5]. Вопреки тому, что метформин применяется в лечебной практике в течение довольно длительного времени, детальные механизмы его действия остаются до конца не ясными. Первичный антигипергликемический эффект метформина вызван снижением синтеза глюкозы печенью, а также продукции свободных жирных кислот (СЖК), окисления жира и частично − усилением периферического захвата глюкозы [6, 7].
Антигипергликемические эффекты метформина − это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой ткани [8]. Хотя преобладающим является влияние метформина на продукцию глюкозы печенью, именно комбинация его эффектов на уровне всех трех тканей, по-видимому, обусловливает благоприятный фармакологический профиль препарата. В ряде плацебоконтролируемых исследований показано, что инсулинозависимое поглощение глюкозы повышается на 20–30% под влиянием метформина [5, 6]. Метформин осуществляет антигипергликемическое действие, в основном снижая продукцию глюкозы печенью, которая в 2–3 раза повышена у больных c МС и СД 2 типа.
Исследования in vivo и in vitro показали, что этот механизм действия препарата связан с подавлением процессов глюконеогенеза и, в меньшей степени, гликогенолиза, что приводит к снижению на 25–30% уровня гликемии натощак [9]. Хорошо известно, что важным этапом обеспечения компенсации углеводного обмена является достижение нормогликемии натощак. Последствия повышенной гепатической продукции глюкозы в ночное время у больных с МС и СД типа 2 крайне неблагоприятны ввиду стимуляции процессов атерогенеза и развития резистентности к действию сахароснижающих препаратов в течение дня [10].
Метформин способствует подавлению глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол и некоторых аминокислот, а также противодействует глюконеогенетическому действию глюкагона. В первую очередь это происходит вследствие торможения поступления перечисленных субстратов глюконеогенеза в гепатоциты и ингибирования его ключевых ферментов − пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы [7]. Препарат, усиливая кровообращение в печени и ускоряя процесс превращения глюкозы в гликоген, увеличивает синтез гликогена в печени [11]. Наряду с этим, возрастает утилизация глюкозы скелетными мышцами и жировой тканью, что приводит к повышению чувствительности тканей к инсулину на 18–50%.
В мышечной и жировой ткани метформин повышает связывание инсулина с рецепторами, увеличивает их число и аффинность [12]. Кроме того, происходит активирование пострецепторных механизмов действия инсулина, в частности тирозинкиназы и фосфотирозин фосфатазы. Оказывая влияние на всасывание углеводов в желудочно-кишечном тракте, замедляя его скорость, а также снижая аппетит, метформин способствует уменьшению постпрандиальной гликемии. Кроме того, метформин значительно повышает утилизацию глюкозы в кишечнике, усиливая в нем анаэробный гликолиз, как в состоянии насыщения, так и натощак. Поэтому интестинальные эффекты метформина вносят существенный вклад в предотвращение постпрандиальных пиков гликемии, ассоциированных с риском преждевременной смертности от сердечно-сосудистых заболеваний. В результате на фоне терапии метформином постпрандиальная гликемия снижается в среднем на 20–45%.
Повышая печеночную и периферическую чувствительность к эндогенному инсулину, метформин напрямую не влияет на секрецию инсулина. При этом на фоне уменьшения инсулинорезистентности снижается базальный уровень инсулина в сыворотке крови. Благодаря всем указанным эффектам метформина, происходит снижение уровня глюкозы без риска гипогликемических состояний, что является несомненным достоинством препарата. Наряду с этим, метформин обладает рядом других метаболических эффектов, включая и влияние на жировой обмен [11].
Лечение бигуанидами оказывает благоприятный эффект на метаболизм липидов плазмы в связи с гиполипидемическим и антиатерогенным действием. Метформин обладает способностью снижать на 10–30% окисление СЖК. Снижая концентрацию СЖК, он не только улучшает чувствительность к инсулину, но и способствует коррекции нарушенной секреции инсулина. Лечение метформином сопровождается снижением концентрации триглицеридов (ТГ) (на 10–20%) и, как следствие, снижением печеночного синтеза и повышением клиренса липопротеидов очень низкой плотности (ЛПОНП) [5, 6, 13].
Снижение поступления СЖК в печень, синтеза триглицеридов и повышение чувствительности к инсулину сопровождается уменьшением отложения жира в этом органе. Кроме того, уменьшение концентрации и окисления СЖК способствует улучшению профиля действия эндогенного инсулина.
Снижая уровень СЖК, метформин улучшает не только чувствительность тканей к инсулину, но и секрецию инсулина, а также обладает протективными эффектами в отношении липо- и глюкозотоксичности [12].
Наряду с хорошо известным антигипергликемическим действием метформин обладает целым рядом кардиопротективных эффектов. Первым крупным исследованием, подтвердившим кардиопротективную эффективность метформина (Глюкофажа) у больных СД 2 типа, явилось многоцентровое рандомизированное исследование UKPDS (UK Prospective Diabetes Study, 1998). Результаты исследования показали, что применение Глюкофажа, в отличие от лечения препаратами сульфонилмочевины, позволило достоверно снизить риск сосудистых осложнений на 40% [14].
В последнее время большое внимание уделяется активной профилактике СД 2 типа [15, 16]. В крупнейшем исследовании DPP (Diabetes Prevention Program, 2002) было показано, что терапия Глюкофажем может эффективно и безопасно предотвращать развитие СД 2 типа у пациентов с НТГ, особенно у пациентов с индексом массы тела (ИМТ) более 25 и имеющих высокий риск развития СД [17]. Так, у пациентов с НТГ и избыточной массой тела, получавших Глюкофаж в дозе 850 мг дважды в сутки, отмечалось снижение риска развития СД 2 типа на 31% по сравнению с группой пациентов, не получавших медикаментозной терапии.
В отличие от производных сульфонилмочевины, инсулина и тиазолидиндионов, метформин обладает уникальным действием − он может стабилизировать и даже снижать массу тела у лиц с ожирением [18], в т.ч. без СД 2 типа. Многими исследователями высказывается положение, что терапия метформином сопровождается снижением именно висцеро-абдоминального отложения жира.
В связи с этим целью нашего исследование являлось изучение влияния 24-недельной монотерапии метформином на суточный профиль артериального давления, углеводный и липидный обмены, уровень лептина, пролактина, альдостерона, кортизола, тиреотропного гормона, Т3, Т4 у больных с метаболическим синдромом и артериальной гипертензией 1 степени.
Материалы и методы
В исследование было включено 20 пациентов обоего пола в возрасте от 30 до 60 лет с МС с высоким нормальным давлением и с АГ 1 степени (САД 130–159 мм рт. ст. и/или ДАД 85–99 мм рт. ст.), которые находились на монотерапии Глюкофажем по 850 мг 2 раза в день на протяжении 24 недель. Средний возраст пациентов на момент включения в исследование составил 47,03 ± 8,75 года, ИМТ 33,53 ± 5,59 кг/м², длительность АГ 2,91 ± 0,92 года, систолическое АД клиническое (САД кл.) 143,30 ± 7,59 мм рт. ст., диастолическое АД клиническое (ДАД кл.) 87,93 ± 6,31 мм рт. ст., уровень глюкозы натощак – 5,58 ± 0,75 ммоль/л, уровень ОХС 5,53 ± 0,97 ммоль/л, ХС ЛПВП 1,27 ± 0,35ммоль/л, ХС ЛПНП 3,56 ± 1,05 ммоль/л, ТГ 1,98 ± 0,46 ммоль/л. Такой фактор риска ИБС, как курение, отмечался у 24 человек.
Диагностическими критериями МС являлись Рабочие критерии МС, разработанные экспертами Международной федерации диабета (International Diabetes Federation, 2005) [19].
Критериями, исключавшими участие пациентов в исследовании, явились: инсульт любой этиологии в анамнезе, стенозы магистральных артерий головного мозга, умеренная и тяжелая АГ, АГ эндокринного генеза (гиперальдостеронизм, феохромацитома, болезнь Иценко–Кушинга, гипоталамический синдром); реноваскулярная и почечно-паренхиматозная АГ; злокачественная и рефрактерная АГ; сердечная и дыхательная недостаточность; ИБС: инфаркт миокарда в анамнезе, стенокардия; нарушения ритма сердца (частая экстрасистолия, мерцательная аритмия); СД 1 типа; СД 2 типа; нарушение функции почек (уровень креатинина крови выше 130 мкмоль/л); заболевания печени (гепатит, цирроз) и/или исходное повышение уровней АСТ и АЛТ на 20% и более от верхней границы нормы; беременность, лактация; злоупотребление алкоголем.
В исследование включались пациенты, не получавшие ранее антигипертензивную, гиполипидемическую и гипогликемическую терапию, а также терапию, направленную на снижение веса.
Исходно и через 24 недели терапии всем пациентам проводили физикальный осмотр и антропометрическое обследование: измерение роста, массы тела, окружности талии и бедер, расчет ИМТ. Характер распределения жировой ткани оценивали по отношению объема талии к объему бедер (ОТ/ОБ).
Проводили биохимическое исследование венозной крови (ОХС, ХС ЛПНП, ХС ЛПВП, ТГ, глюкоза, мочевая кислота). Для оценки толерантности к глюкозе использовался стандартный пероральный тест толерантности к глюкозе с определением уровней глюкозы, эндогенного инсулина и С-пептида. Измеряли АД клиническим методом Короткова и проводили СМАД.
Учитывая отсутствие нормальных значений содержания в крови лептина, была сформирована группа здоровых добровольцев из 20 человек (8 мужчин и 12 женщин), средний возраст которых составил 38,7 ± 7,9 лет, среднее значение ИМТ 22,7 ± 4,8 кг/м², средний уровень САД кл. 115 ± 6,3 мм рт. ст., средний уровень ДАД кл. 70 ± 5,8 мм рт. ст. Участникам данной группы проводилось определение уровня лептина в сыворотке крови, составившее 10,80 (6,52; 14,78) нг/мл. Полученные результаты принимались за норму.
Уровни инсулина и С-пептида определяли иммуноферментным методом с использованием наборов INSULIN и C-PEPTIDE на анализаторе IMMULITE (DPC, США). Обсчет результатов производили на IMMULITE 100 (США).
Уровень лептина определяли иммуноферментным методом с использованием наборов HUMAN LEPTIN (DSLabs, США) (N 10,80 (6,52; 14,78) нг/мл).
Уровень альдостерона, кортизола, ТТГ, Т3 и Т4 определяли радиоиммунным методом с использованием наборов фирмы Immunotech (Чехия) (N альдостерон 34–274 нг/мл, N кортизол 260–720 нмоль/л).
Уровень пролактина определяли электрохемилюминесцентным методом на анализаторе «Элесис 2010» (Roche, Австрия) (N пролактин: мужчины 86–324 мЕД/мл, женщины 102–496 мЕД/мл).
Статистическая обработка данных проводилась с использованием пакета компьютерных программ Statistica 6.0, предусматривающих возможность как параметрического, так и непараметрического анализа.
Результаты
У больных с АГ и МС на фоне терапии Глюкофажем в дозе 1700 мг/сут отмечалось снижение клинического АД: САД снизилось в среднем на 4% с 141,4 ± 7,4 мм рт. ст. до 136,1 ± 8,3 мм рт. ст. (р < 0,05), ДАД снизилось на 3% с 86,4 ± 8,4 мм рт. ст. до 83,3 ± 4,8 мм рт. ст. (р > 0,05), но недостоверно. Целевых уровней АД менее 130/80 мм рт. ст. по САД достигли 8 (40%) пациентов, по ДАД 9 (45%) больных, по САД и ДАД 6 (30%) пациентов. Уровень АД менее 140/90 мм рт. ст. зафиксирован у 9 (45%), 10 (50%) и 8 (40%) больных соответственно.
По результатам СМАД на фоне 24-недельной монотерапии метформином в целом по группе обнаружено достоверное снижение среднесуточных значений АД. Так, САДmах и САДср. снизилось с 153,3 ± 11,5 мм рт. ст. до 146,0 ± 7,1 мм рт. ст. (р = 0,014) и с 129,1 ± 11,7 до 121,1 ± 15,2 мм рт. ст. (р = 0,020) соответственно. ДАДmах также снизилось достоверно с 99,8 ± 7,2 мм рт. ст. до 95,4 ± 6,1 мм рт. ст. (р = 0,039). Кроме того, отмечена достоверная динамика показателей «нагрузки давлением» САД: ИВ САД снизился с 40,4% до 19,1% (р = 0,036), ИП САД − с 77,0 мм рт. ст. до 23,3 мм рт. ст. (р = 0,043). ИВ ДАД снизился с 43,8% до 29,6%, а ИП ДАД – с 69,2 мм рт. ст. до 33,4 мм рт. ст., но недостоверно в обоих случаях (р > 0,05) (см. табл.).
Вариабельность среднесуточных АД и ЧСС на фоне монотерапии метформином значимо не менялась. После 24 недель монотерапии метформином наблюдается высокодостоверная динамика всех антропометрических показателей. Масса тела уменьшилась с 92,22 ± 17,2 кг до 88,00 ± 15,8 кг (р < 0,0005), ИМТ снизился с 32,05 ± 5,17 кг/м² до 29,84 ± 5,22 кг/м² (р < 0,0005), ОТ − с 99,83 ± 11,74 см до 95,89 ± 10,81 см (р < 0,0005), а индекс ОТ/ОБ − с 0,92 ± 0,04 до 0,90 ± 0,04 (р < 0,0005).
На монотерапии Глюкофажем выявлено достоверное снижение уровня постпрандиальной глюкозы с 7,62 ± 1,56 ммоль/л до 6,46 ± 0,99 ммоль/л (р = 0,0003). Уровень глюкозы натощак значимой динамики не претерпел, до начала терапии составляя 5,67 ± 0,64 ммоль/л и после терапии 5,61 ± 0,57 ммоль/л (р > 0,05) (рис. 1). 24-недельная терапия привела к достоверному снижению уровня ОХС с 5,38 ± 0,75 ммоль/л до 4,97 ± 0,91 ммоль/л (р = 0,032) и уровня ТГ с 1,94 (1,74; 2,11) ммоль/л до 1,32 (1,12; 1,59) ммоль/л (р = 0,0004). Содержание ХС ЛПНП в сыворотке крови у пациентов с МС на фоне лечения достоверно не менялось, составляя 3,67 ± 0,97 ммоль/л до лечения и 3,46 ± 0,70 ммоль/л после лечения (р > 0,05). Отмечена тенденция к повышению уровня ХС ЛПВП с 1,26 ± 0,32 ммоль/л до 1,40 ± 0,29 ммоль/л (р = 0,063) (рис. 2). Исходно у 11 (55%) больных зафиксирован высокий уровень лептина по сравнению с контрольной группой, в которой он составил 10,80 (6,52; 14,78) нг/мл. Уровень лептина сыворотки крови в среднем по группе наблюдения − 17,27 (7,76; 23,96) нг/мл (р < 0,05).
На фоне 24-недельной монотерапии Глюкофажем у пациентов данной группы произошло значительное снижение уровня лептина до 10,72 (5,94; 16,58) нг/мл (р = 0,0004) (рис. 3). Терапия препаратом не привела к достоверной динамике уровня пролактина. До начала терапии повышение уровня альдостерона (максимально до 558,4 пг/мл) обнаружено у 11 пациентов (55%). На фоне монотерапии Глюкофажем произошло достоверное снижение уровня альдостерона в плазме крови с 369,16 (256,70; 428,20) пг/мл до 283,84 (242,35; 387,10) пг/мл (p = 0,036) (рис. 4).
До начала терапии у всех пациентов уровень кортизола сыворотки крови не выходил за рамки нормальных значений. После терапии достоверной динамики уровня кортизола в сыворотке крови в среднем по группе не обнаружено (рис. 4). До начала исследования у всех пациентов зафиксированы уровни ТТГ, Т3 и Т4, соответствующие норме. На фоне проводимой 24-недельной монотерапии метформином не было выявлено достоверного изменения уровней ТТГ, Т3 и Т4. Субъективная переносимость метформина в дозе 1700 мг/сут была хорошей. На протяжении всего исследования ни у одного пациента не отмечалось побочных реакций. Случаев повышения активности ферментов печени, уровней общего билирубина и креатинина крови не зарегистрировано.
Обсуждение результатов
Ведущие ученые, занимающиеся проблемой МС, склонны рассматривать его как предстадию атеросклероза и СД 2 типа. Ключевыми факторами патогенеза МС являются ожирение, ИР и АГ. Разнообразие клинических и метаболических проявлений МС требует назначения нескольких препаратов с различным механизмом действия. Это гиполипидемические, сахароснижающие, влияющие на чувствительность к инсулину и антигипертензивные препараты.
По данным нашего исследования, монотерапия Глюкофажем наряду с хорошим гипогликемическим эффектом оказала также позитивное влияние на показатели липидного обмена, АД, массы тела и висцерального ожирения. Так, отмечено достоверное снижение уровня ОХС, ТГ и тенденция к повышению уровня ХС ЛПВП, что согласуется с результатами ранее проводимых исследований. Гиполипидемический эффект Глюкофажа объясняется способностью препарата снижать концентрацию СЖК, что не только улучшает чувствительность к инсулину, но и способствует профилактике прогрессирования нарушения секреции инсулина у больных с МС. В целом нормализация концентраций СЖК приводит к устранению эффектов липотоксичности на всех уровнях, включая печень, жировую и мышечную ткань и островки Ларгенганса.
Суммируя эти наблюдения, можно предположить, что действие Глюкофажа на метаболизм липопротеидов вносит значительный вклад в его кардиопротективное действие.
На фоне терапии Глюкофажем у большинства пациентов отмечалось достоверное снижение массы тела, ОТ и индекса ОТ/ОБ. По результатам метаанализа 14 трайлов показано, что лечение Глюкофажем, приводит к достоверному снижению ИМТ, и наибольший эффект снижения ИМТ наблюдается у пациентов, принимавших его в дозе более 1500 мг/сут и длительностью более 8 недель [20].
В настоящем исследовании у больных с МС и АГ, получавших монотерапию Глюкофажем, отмечался хороший гипотензивный эффект по данным клинического измерения АД и показателей СМАД. По данным офисного измерения АД целевой уровень АД менее 130/80 мм рт. ст. достигли 30% пациентов, а уровня АД менее 140/90 мм рт. ст. − 40% больных. По результатам СМАД выявлено не только достоверное снижение среднесуточных показателей САД, но и показателей «нагрузки давлением» ИВ САД и ИП САД. Гипотензивный эффект Глюкофажа может быть обусловлен снижением массы тела вследствие уменьшения гиперинсулинемии [4, 6] и угнетения аппетита [21]. Наряду со снижением массы тела, ОТ, индекса ОТ/ОБ, характеризующих выраженность абдоминального ожирения, на фоне терапии Глюкофажем заметные изменения отмечались и в динамике уровня лептина в виде достоверного снижения его уровня. Схожие данные получены в результате исследования зависимости ИМТ и уровня тощакового инсулина от концентрации лептина сыворотки крови у пациентов с ожирением и АГ.
В ходе настоящей работы не выявлено какого-либо значимого влияния Глюкофажа на секрецию гормона аденогипофиза пролактина, средние значения которого до и после лечения не выходили за рамки нормы. Наши данные согласуются с результатами исследований влияния препарата на функцию аденогипофиза у пациенток с МС и синдромом поликистозных яичников [22].
В группе больных, принимавших Глюкофаж, до начала терапии было зафиксировано превышение концентрации альдостерона плазмы крови у 11 пациентов. На фоне монотерапии этим препаратом отмечено достоверное снижение уровня альдостерона у 8 больных. Этот неожиданный для сахароснижающего препарата эффект можно объяснить его способностью снижать центральную симпатическую активность [23]. Кроме этого, результатами проведенных исследований показано, что уменьшение массы тела сопровождается снижением уровня альдостерона плазмы крови. Еще одним возможным механизмом влияния Глюкофажа на секрецию альдостерона является его антиоксидантная активность, заключающаяся в торможении клеточных окислительных реакций [7, 9]. Снижая концентрацию и окисление СЖК, препарат усиливает их реэстерификацию, тем самым уменьшая концентрацию стимулирующих секрецию альдостерона агентов.
Заключение
Таким образом, больным с МС и АГ рекомендовано назначение бигуаниада Глюкофаж с целью коррекции метаболических нарушений, снижения массы тела и в целом снижения высокого риска развития ССЗ и СД 2 типа.
1. Eckel R.H., Grundy S.M., Zimmet P.Z. The metabolic syndrome // Lancet. 2005; 365: 1415–28.
2. Flegal K.M., Carroll M.D., Ogden C.L. Prevalence and trends in obesity among US adults, 1999–2000 // JAMA. 2002; 288: 1723–27.
3. Forclaz A., Maillard M., Nussberger J. Angiotensin II receptor blockade: is there truly a benefit of adding an ACE inhibitor? // Hypertension. 2003; 41: 31–36.
4. Старостина Е.Г., Древаль А.В. Бигуаниды в лечении сахарного диабета // Мед. практика. 2000; 44.
5. Cusi К., DeFronzo R.A. Metformin: a review of its metabolic effect // Diabetes. 1998; 6: 89–131.
6. Davidson M.B., Peters A.L. An overview of metformin in the treatment of type 2 diabetes mellitus // Am J Med. 1997; 102: 99–110.
7. Kirpichnikov D., McFarlane S.I., Sowers J.R. Metformin:An Update // An Intern Med. 2002; 137: 25–33.
8. Арутюнов Г.П. Сахарный диабет и атеросклероз: какова оптимальная стратегия сдерживания атеросклеротического процесса? // Сердце. 2004; 3, 1(13): 36–40.
9. Musi N., Hirshman M.F., Nygren J. et al. Metformin increases AMP-activated protein kinase activity in skeletal muscle of subjects with type 2 diabetes // Diabetes. 2002; 51: 2074–81.
10. Gregori F., Ambrosi F., Manfrini S. et al. Poorly controlled elderly Type 2 diabetic patients: the effects of increasing sulphonylurea dosages or adding metformin // Diabet. Med. 1999; 16(12): 1016–24.
11. Lalau J.D., Vermersch A., Hary L. et al. Type 2 diabetes in elderly: an assessment of metformin // Int J Clin Pharmacol Ther Toxicol. 1990; 28: 329–32.
12. Patane G., Piro S., Rabuazzo A.M. et al. Metformin restores insulin secretion altered by chronic exposure to free fatty acids or high glucose: a direct metformin effect on pancreatic beta-cells // Diabetes. 2001; 49(5): 735–740.
13. Соболев А.В. Новый подход к оценке индивидуальной суточной вариабельности ритма сердца у пациента // Кардиология. 2003; 8: 16–21.
14. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complication in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. 1998; 352: 854–65.
15. Dunstan D.W., Zimmet P.Z., Welborn Т.D. et al. The rising prevalence of diabetes and imparted glucose tolerance. The Australian diabetes, obesity and lifystyle study // Diabetes Care. 2002; 25: 829–34.
16. Edelstein S.L., Knowler W.C., Bain R.P. et al. Predictor of progression from impaired glucose tolerance to NIDDM: an analysis of six prospective studies // Diabetes. 1997; 46: 701–710.
17. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N EngI J Med. 2002; 346: 393–403.
18. Salpeter S.R., Greyber E., Pasternak G.A. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus: systematic review and meta-analysis //Arch Intern Med. 2003; 163(21): 2594–602.
19. International Diabetes Federation (IDF). Global guideline for type 2 diabetes. 2005.
20. Nieuwenhuis-Ruifrok A.E., Kuchenbecker W.K.H., Hoek A. et al. Insulin sensitizing drugs for weight loss in women of reproductive age who are overweight or obese: systematic review and meta-analysis // Hum. Reprod. Update. 2009; 15: 57–68.
21. DeFronzo R.A. Pharmacologic therapy for type 2 diabetes mellitus // Ann Intern Med. 1999; 131: 281–303.
22. Trolle B., Flyvbjerg A., Kesmodel U. et al. Efficacy of metformin in obese and non-obese women with polycystic ovary syndrome: a randomized, double-blinded, placebo-controlled cross-over trial // Hum. Reprod. 2007; 22: 2967–2973.
23. Petersen J.S., DiBona G.F. Acute Sympathoinhibitory Actions of Metformin in Spontaneously Hypertensive Rats // Hypertension. 1996; 27: 619–625.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Метаболический синдром (МС) представляет собой комплекс патогенетически взаимосвязанных метаболических и сердечно-сосудистых нарушений, включающих артериальную гипертензию (АГ), инсулинорезистентность (ИР), нарушение толерантности к глюкозе (НТГ), абдоминальное ожирение и атерогенную дислипидемию [1].
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
