количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Применение небиволола у больных с метаболическим синдромом и сахарным диабетом 2 типа
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №4
- Аннотация
- Статья
- Ссылки
В связи с высоким риском развития сердечно-сосудистых осложнений, приводящих к ранней инвалидизации и преждевременной смерти, сахарный диабет 2 типа (СД 2 типа) в недалеком будущем может стать главной проблемой здравоохранения в мире.
В связи с высоким риском развития сердечно-сосудистых осложнений, приводящих к ранней инвалидизации и преждевременной смерти, сахарный диабет 2 типа (СД 2 типа) в недалеком будущем может стать главной проблемой здравоохранения в мире.
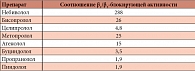
Таблица. Небиволол – высокоселективный β1-адреноблокатор (T. Cleophas, 1994)
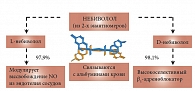
Рис. 1. Активное вещество небиволола представляет собой рацемат, состоящий из двух энантиомеров
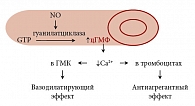
Рис. 2. Оксид азота – одна из самых простых межклеточных сигнальных молекул
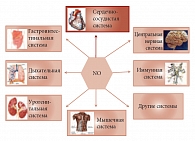
Рис. 3. NO участвует в регуляции функций всех систем организма

Рис. 4. Динамика показателей систолического АД на фоне терапии Небилетом
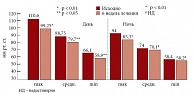
Рис. 5. Динамика показателей диастолического АД на фоне терапии Небилетом
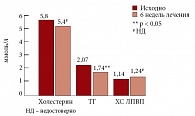
Рис. 6. Динамика показателей липидного обмена на фоне терапии Небилетом

Рис. 7. Динамика глюкозы и С-пептида крови на фоне терапии Небилетом
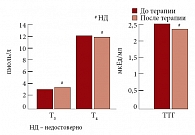
Рис. 8. Динамика уровня тиреоидных гормонов на фоне терапии Небилетом
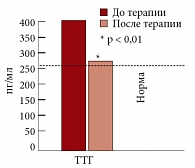
Рис. 9. Динамика уровня альдостерона на фоне терапии Небилетом
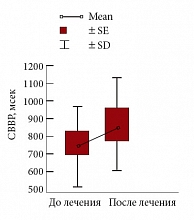
Рис. 10. Среднегрупповые значения СВВР у больных с МС и АГ (n = 20) на фоне терапии Небилетом
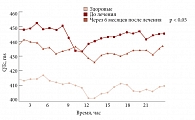
Рис. 11. Динамика QT на фоне терапии Небилетом (5 мг) больных с мягкой АГ и МС
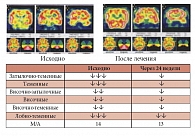
Рис. 12. Динамика изменений перфузии головного мозга у пациентов с МС (n = 20) на фоне терапии Небилетом
Артериальной гипертонией (АГ) страдает до 80% больных СД 2 типа. Риск преждевременной смерти у них значительно выше, на 1/3 снижена продолжительность жизни [1]. Распространенность ишемической болезни сердца (ИБС) больше в 2–4 раза, риск развития острого инфаркта миокарда (ОИМ) в 6–10 раз и мозговых инсультов в 4–7 раз выше у больных с АГ и СД 2 типа, чем без него [2].
Необходимость применения β-адреноблокаторов в лечении АГ у больных с метаболическим синдромом и СД 2 типа
Повышенная смертность больных с метаболическим синдромом (МС) и СД 2 типа связана с тремя основными факторами риска: АГ, гипергликемией и гиперлипидемией. Важную роль в патогенезе АГ при МС и СД 2 типа играет повышение активности симпатической нервной системы (СНС), которая вызвана гиперинсулинемией и гиперлептинемией. И инсулин, и лептин, действуя на уровне гипоталамических ядер, вызывают активацию ряда симпатических нервов (почечных, надпочечниковых, висцеральных) и повышение концентрации катехоламинов в плазме [3]. Участие повышенной активности СНС в патогенезе АГ при МС и СД 2 типа диктует необходимость применения бета-адреноблокаторов в лечении АГ у этих категорий больных. У больных с МС и СД 2 типа с АГ гораздо раньше формируется гипертрофия миокарда левого желудочка, которая является важным фактором риска внезапной смерти вследствие асистолии и развития тяжелых нарушений ритма сердца (НРС). НРС у больных СД 2 типа встречаются в 37,7%, бета-адреноблокаторы в таком случае могут служить средством не только антиаритмической терапии, но и профилактики развития НРС и асистолии.
АГ может быть как следствием, так и причиной развития МС и СД 2 типа. Длительное течение АГ вследствие хронического снижения кровотока и повышения общего сосудистого сопротивления приводит к снижению чувствительности периферических тканей к инсулину и последующему развитию МС и СД 2 типа. Таким образом, гипотензивная терапия с достижением целевого уровня АД является не только симптоматической, но и патогенетической терапией МС и СД 2 типа.
Эффективность лечения АГ у больных СД 2 типа была подтверждена данными исследования UKPDS (United Kingdom Prospective Diabetes Study). В исследовании UKPDS тщательный контроль АД приводил к снижению частоты осложнений СД на 24%, смертности от осложнений СД на 32%, риска развития мозгового инсульта на 44%, риска развития диабетической микроангиопатии на 37%, прогрессирования диабетической ретинопатии на 34% и ослабления остроты зрения на 47% [4].
Эффективность β-адреноблокаторов для лечения и профилактики ИБС у больных СД 2 типа
Основной причиной смерти почти 50% больных СД 2 типа является инфаркт миокарда (ИМ). Характерной особенностью ИБС при СД 2 типа является частое развитие безболевой ишемии миокарда, что затрудняет своевременную диагностику ИМ и значительно ухудшает прогноз у больных ИБС.
Результаты многочисленных исследований по изучению применения высокоселективных бета-адреноблокаторов как вторичной профилактики повторных ИМ и постинфарктной стенокардии показали снижение смертности на 25% и снижение случаев повторных ИМ на 29%. Причем у больных СД 2 типа отмечалось почти в 3 раза большее снижение смертности по сравнению с больными без диабета (37% и 13% соответственно) в результате приема селективных бета-адреноблокаторов [5].
Достоверное снижение смертности среди перенесших ИМ больных СД отмечалось в исследовании ISIS-1 (The First International Study of Infarct Survival) [6], MIAMI (The Metoprolol In Acute Myocardial Infarction) [7] и The Goteborg Metoprolol Trial [8]. В исследовании The Bezafibrate Infarction Prevention Study (BIP) терапия бета-адреноблокаторами сопровождалась достоверным снижением общей смертности и смертности от сердечно-сосудистых осложнений у больных СД, в первую очередь – у лиц, перенесших ИМ [5].
Всем пациентам, страдающим СД 2 типа и перенесшим ОИМ или нестабильную стенокардию, показано назначение селективных бета-адреноблокаторов как стандартное средство вторичной профилактики ИБС.
Выбор β-адреноблокаторов для лечения больных СД и МС
На протяжении длительного времени применение бета-адреноблокаторов у больных СД 2 типа было ограничено и даже противопоказано. Связано это с неблагоприятным влиянием неселективных бета-адреноблокаторов на углеводный и липидный обмен. Многие селективные бета-адреноблокаторы, применявшиеся ранее, в больших дозах утрачивают свою селективность и проявляют антагонизм по отношению к β2-адренорецепторам. Такие бета-адреноблокаторы способны удлинять гипогликемические состояния и маскировать симптомы гипогликемии. В ряде случаев они приводят к гипергликемии и даже к гипергликемической коме, блокируя β-адренорецепторы поджелудочной железы и таким образом препятствуя высвобождению инсулина. Неселективные бета-адреноблокаторы негативно влияют на липидный обмен, стимулируя атерогенез.
За последние годы для устранения побочных эффектов фармакологи создали ряд бета-адреноблокаторов, способных блокировать в достаточных терапевтических дозах только β1-адренорецепторы.
В рекомендациях Европейского общества по АГ и Европейского общества кардиологов 2007 г., рекомендациях по АГ ВНОК 2010 г.,
рекомендациях МС ВНОК 2010 г. у больных МС и СД допускается применение бета-адреноблокаторов с вазодилятирующими свойствами. К ним относятся высокоселективный бета-адреноблокатор небиволол (Небилет, «Берлин-Хеми АГ/Менарини Групп», Германия) и карведилол.
Небиволол
Небиволол – один из современных высокоселективных препаратов. Его особенностью является не только исключительно высокая β1-селективность, но и вазодилятирующий эффект [9–12]. Эффективность и безопасность терапии небивололом была продемонстрирована в исследовании SENIORS [9]. В результате экспериментальных исследований было установлено, что даже назначаемый в относительно больших дозах препарат не утрачивает свою β1-селективность благодаря соотношению β1- и β2-блокирующей активности [13, 14] (табл.).
Активное вещество небиволола представляет собой рацемат, состоящий из двух энантиомеров: D-небиволола и L-небиволола. D-небиволол является конкурентным и высокоселективным блокатором β-адренорецепторов, а L-небиволол оказывает мягкое вазодилятирующее действие за счет модуляции высвобождения релаксирующего фактора NО (оксида азота) из эндотелия сосудов (рис. 1).
В последние годы возрос научный и практический интерес к роли эндотелия и оксида азота в развитии и прогрессировании сердечно-сосудистых заболеваний. В настоящее время дефициту содержания NO придается большое значение при многих распространенных патологических состояниях, в частности при ИБС, АГ, атеросклерозе, сердечной недостаточности. В 1998 г. трем американским ученым была присуждена Нобелевская премия в области медицины за работы, посвященные роли оксида азота.
NO является, пожалуй, одной из самых простых межклеточных сигнальных молекул. Он образуется в эндотелиальных клетках сосудистой системы. Этот оксид активизирует фермент гуанилатциклазу, которая, в свою очередь, катализирует реакцию образования циклического гуанозинмонофосфата (цГМФ) из гуанозинтирозинфосфата. При нарушении функций сердечно-сосудистой системы NO повышает уровень цГМФ, что ведет к расширению кровеносных сосудов, то есть вазодилятации, регулируя тем самым уровень АД (рис. 2). Тот факт, что вазодилятирующее действие небиволола опосредуется его влиянием на обмен NO, был установлен на животных моделях. Клинические исследования это подтвердили [15].
NO, проникая в тромбоциты, препятствует их агрегации, то есть препятствует образованию тромбозов. NO препятствует развитию воспаления в поврежденной эндотелиальной стенке сосуда, замедляя таким образом прогрессирование атеросклероза. NO снижает рост гладкомышечных клеток, тем самым уменьшая прогрессирование хронической сердечной недостаточности. NO обладает также множественными физиологическими эффектами. Являясь нейромедиатором ЦНС, NO способен улучшать память, возможно, тем самым предотвращая прогрессирование болезни Альцгеймера. NO обладает свойствами антиоксиданта, нейтрализуя свободные радикалы. В дыхательной системе он является вазо- и бронходилататором. В гастроинтестинальной – стимулирует нормальную перистальтику кишечника. В урогенитальной системе NO участвует в регуляции функций мочевого пузыря. Кроме того, являясь важным медиатором, участвует в механизме эрекции у мужчин. NO улучшает кровообращение скелетных мышц, тем самым увеличивая приток питательных веществ и кислорода к ним и удаляя избыток молочной кислоты (рис. 3). Это особенно важно для больных СД 2 типа и ожирением.
Небиволол обладает хорошим профилем эффективности и безопасности. Так, препарат эффективен в качестве монотерапии у 70% больных, он снижает как систолическое, так и диастолическое артериальное давление (АД), не нарушая его суточный ритм. Небиволол обладает пролонгированным действием, что подтверждается высоким значением показателя Т/Р (отношение остаточного гипотензивного эффекта к максимальному, рассчитывается как отношение среднего снижения АД в промежутке между 20 и 24 ч. после приема препарата к максимальному снижению АД после приема препарата и позволяет получить представление о длительности и равномерности действия антигипертензивного препарата, %) – 90% при однократном приеме [16]. Антигипертензивное действие небиволола сохраняется даже при его длительном применении. Отмена препарата не приводит к развитию ребаунд-синдрома (синдром рикошета) [17, 18]. Его назначение не требует титрации дозы, так как 5 мг небиволола в сутки, по данным ряда клинических исследований, является наиболее оптимальным. Исключение составляют пациенты в возрасте старше 65 лет с поражением почек. У этой категории пациентов стартовая доза препарата – 2,5 мг. Прием пищи не влияет на его абсорбцию, таким образом, небиволол можно принимать во время, до и после еды. Небиволол эффективен как у молодых пациентов, так и у лиц старшего возраста [19]. В серии контролируемых исследований было показано, что частота побочных эффектов при назначении небиволола сопоставима с таковой в группе плацебо [20]. Антигипертензивная эффективность и переносимость небиволола сравнивалась с эффективностью и переносимостью антагонистов кальция, ингибиторов АПФ и других бета-адреноблокаторов, при этом было показано, что он, как минимум, так же эффективен, а профиль его переносимости даже несколько лучше, чем у других антигипертензивных препаратов [21, 22].
Наш собственный опыт применения Небилета у больных с АГ и МС, то есть с нарушениями углеводного, липидного обмена и ожирением, убедительно доказал преимущества этого препарата для данной категории больных. За все время приема пациентами Небилета не было зарегистрировано нежелательных побочных явлений.
Лечение АГ у больных с МС Небилетом привело к хорошему мягкому гипотензивному эффекту с улучшением суточного профиля АД (рис. 4, 5). Эффективно снижалась частота сердечных сокращений. При этом не было отмечено чрезмерной брадикардии и нарушения проводимости при анализе электрокардиограммы [23]. Хороший антигипертензивный эффект Небилета сопровождался позитивным влиянием на показатели углеводного и липидного обменов (рис. 6, 7).
Считается, что высокоселективные бета-адреноблокаторы характеризуются отсутствием влияния на метаболические показатели. Однако на фоне терапии Небилетом эти показатели даже достоверно улучшались. На фоне его приема достоверно уменьшился уровень триглицеридов – на 12%. Кроме того, в нашем исследовании получено достоверное снижение уровня глюкозы в крови через 2 ч после приема пищи на 14% и выявлена тенденция к повышению чувствительности к инсулину [24]. Такие позитивные метаболические эффекты Небилета (небиволола) можно объяснить, с одной стороны – его высокой селективностью: выше, чем у всех других препаратов этой группы, и с другой – дополнительным механизмом действия, связанным со стимуляцией синтеза мощного сосудорасширяющего вещества (NO).
Влияние небиволола на уровень гормонов щитовидной железы и альдостерона у больных с МС
У больных с МС гиперлептинемия и гиперинсулинемия приводят к повышению секреции тиреотропин-рилизинг гормона в гипоталамусе, что в свою очередь вызывает нарушение секреции тиреотропного гормона и пролактина в гипофизе и, как следствие, вызывает снижение функции щитовидной железы и повышение продукции альдостерона в надпочечниках. В то же время известно, что бета-адреноблокаторы могут подавлять функцию щитовидной железы, в связи с чем нами было проведено исследование по изучению влияния небиволола на показатели гормонов щитовидной железы Т3, Т4, ТТГ, а также альдостерона. Терапия Небилетом (небивололом) не приводила к существенному изменению уровня гормонов щитовидной железы (рис. 8), в то время как уровень альдостерона, исходно повышенный у больных МС и АГ, достоверно снижался с 355,82 ± 176,17 до 176,17 ± 118,06 (р < 0,005) (рис. 9) [24].
Динамика вариабельности ритма сердца и интервала QT у больных с МС и АГ на фоне терапии небивололом
Прогноз у больных с АГ и МС зависит не только от эффективности антигипертензивной терапии, но и от степени поражения органов мишеней. За последние три десятилетия получено много доказательств связи между снижением вариабельности ритма сердца (ВРС) и повышением вероятности летального исхода при ИБС, прежде всего – при ИМ [25]. Результаты ряда исследований демонстрируют, что у больных СД также имеется снижение ВРС [26]. Одним из наиболее изученных факторов риска внезапной сердечной смерти и желудочковых аритмий, в том числе фатальных, является удлинение интервала QT. Существуют исследования, свидетельствующие о связи между нейропатическим удлинением интервала QT у больных СД и внезапной коронарной смертью [27]. Однако у больных МС и АГ таких исследований не проводилось.
В связи с этим нами было проведено исследование влияния Небилета (небиволола) на динамику QT и ВРС у больных с МС и АГ. 18 больных с метаболическим синдромом и АГ получали Небилет в дозе 5 мг в течение 24 недель. Всем больным проводилось бифункциональное мониторирование ЭКГ и АД с программой автоматической обработки интервала QT до и через 24 недели лечения Небилетом. При исследовании ВРС и мониторировании АД использовалась система «Союз» фирмы «ДМС Передовые технологии». Главной особенностью используемого нами метода анализа ВРС на длительных промежутках времени являлось исследование функции, характеризующей зависимость синусовой аритмии от величины среднего значения частоты сердечных сокращений (ЧСС).
У больных МС и АГ I ст. показатели средневзвешенной вариации ритмограммы (СВВР) были существенно ниже, чем в группе «нормы». На фоне терапии Небилетом, через 24 недели лечения отмечалось увеличение СВВР у 90% больных, у 10% – СВВР оставалась без динамики (рис. 10). Увеличение вариабельности ритма сердца сопровождалось хорошим антигипертензивным эффектом, снижением ЧСС и улучшением клинического статуса больных.
До лечения среднесуточное значение длительности интервала QT у всех пациентов с метаболическим синдромом было достоверно больше, чем в группе здоровых добровольцев – 445 ± 26 мс и 425 ± 34 мс соответственно (р < 0,05). После 24 недель лечения Небилетом длительность интервала QT достоверно уменьшилась с 445 ± 26 мс до 433 ± 17 мс (р < 0,05) (рис. 11). Таким образом, наше исследование продемонстрировало положительное влияние Небилета (небиволола) также на электрофизиологические свойства миокарда [28].
Влияние небиволола на перфузию головного мозга у больных с МС и АГ
Поражение головного мозга при АГ начинается с патологических изменений микроциркуляторного русла, приводящих к потере физиологических свойств, одним из которых является способность к регуляции перфузионного давления в головном мозге в ответ на изменения общего системного артериального давления. Нарушение ауторегуляции мозгового кровотока является наиболее ранним признаком вовлечения микроциркуляторного русла в патогенетический процесс при гипертонической ангиоэнцефалопатии, основной причиной которой, как и острой недостаточности мозгового кровообращения (ОНМК) у больных АГ, является снижение мозгового кровотока вследствие хронического повышения АД и снижение или утрата способности сосудов микроциркуляторного русла глубоких отделов мозга к ауторегуляции мозгового кровотока, то есть поддержанию его адекватного уровня с помощью вазодилятации, возникающей в ответ на ишемию. Изменение ответа мозговых артерий на ишемию, выявляемое на ранних стадиях нарушения перфузии головного мозга, может являться предиктором ОНМК. Обнаружение этих нарушений мозгового кровотока до того, как в мозговых артериях возникнут необратимые изменения, может повлиять на дальнейшую тактику лечения пациентов с АГ.
Сведения литературы о влиянии бета-адреноблокаторов на состояние перфузии головного мозга у пациентов, страдающих АГ, противоречивы. В одних исследованиях было показано, что кратковременная терапия бета-адреноблокаторами приводила к снижению перфузии головного мозга с развитием ишемической симптоматики [29, 30], в других – длительная терапия вызывала увеличение мозгового кровотока, уменьшение асимметрии и восстановление реактивности церебральных сосудов [31].
Это послужило причиной для проведения собственных исследований, посвященных изучению перфузии головного мозга методом однофотонной эмиссионной компьютерной томографии (ОЭКТ) у пациентов с МС исходно и на фоне приема Небилета (небиволола) в течение 24 недель. У всех больных с МС исходно наблюдалось нарушение перфузии головного мозга. Из 20 пациентов со сниженным мозговым кровотоком в затылочно-теменных областях у 15 выявлены нарушения слева (средний показатель уровня перфузии по группе 64,47 ± 6,64%) и у 13 пациентов справа (средний показатель – 64,74 ± 5,89%). У 8 человек изменения перфузии наблюдались в затылочно-теменных отделах обоих полушарий. В теменных отделах слева отмечено снижение мозговой перфузии у 10 человек, при этом средний показатель уровня перфузии по группе составлял 76,05 ± 11,85%, то же справа – у 8 человек, средний показатель по группе – 77,37 ± 13,88%. В височно-затылочных отделах изменения были выявлены у 5 человек слева и у 6 человек справа, при этом средний показатель уровня перфузии по всей группе был близок к нормальному значению и составлял 93,68 ± 5,49% и 95 ± 4,71% соответственно. Височные отделы левого полушария (ЛП) были поражены у 8 человек, правого – также у 8 человек. В среднем по группе уровень мозгового кровотока доходил до 88,42 ± 13,95% и 84,74 ± 14,09% соответственно. В височно-теменных отделах изменения перфузии были отмечены у 9 человек слева (в среднем по группе до 88,95 ± 11,74%) и справа у 8 человек (в среднем по группе 89,47 ± 11,41%). В лобно-височно-теменных отделах слева наблюдались изменения у 5 человек, справа – у 6 человек. Средний по группе уровень перфузии в этих областях был близок к физиологической норме и составлял 91,84 ± 10,44% и 95,53 ± 6,43% соответственно. В лобно-теменных отделах снижение мозговой перфузии отмечено у 15 человек слева (в среднем до 77,89 ± 12,84%) и у 13 человек справа (в среднем по группе 77,63 ± 12,06%). В связи с разной степенью выраженности поражений в полушариях головного мозга, наблюдалась патологическая межполушарная асимметрия, составлявшая в среднем по группе 21,3 ± 5,6%. Таким образом, наиболее выраженные изменения обнаружены в затылочно-теменных, теменных и лобно-теменных отделах. По частоте встречаемости первое место занимают затылочно-теменные, затем лобно-теменые отделы головного мозга [23].
Повторное исследование перфузии головного мозга, проведенное после 24-недельной терапии Небилетом (небивололом), выявило следующую динамику показателей мозгового кровотока. 7 человек по показателям перфузии головного мозга достигли физиологической нормы. В затылочно-теменных областях слева сниженный мозговой кровоток отмечался у 8 человек, справа – у 6 человек. Достоверно в среднем по группе улучшилось кровоснабжение затылочно-теменных областей как слева (исходно 64,47 ± 6,64%, после терапии 84,47 ± 10,79% (p < 0,05)), так и справа (исходно 64,74 ± 5,89%, после терапии 82,89 ± 12,17% (p < 0,05)). Число пациентов, имевших дефекты перфузии в теменных областях ЛП, снизилось с 10 до 5 (в среднем по группе исходно 76,05 ± 11,85%, после терапии 80,53 ± 11,04% (p < 0,05)), и в ПП – с 8 до 4 человек (77,37 ± 13,88% и 86,58 ± 14,91% соответственно). В височных отделах слева изменения наблюдались у 3 человек, в среднем уровень перфузии по группе составлял 92,11 ± 8,87% (исходно 88,42 ± 13,95% (p < 0,05)), то же справа у 3 человек, в среднем по группе 92,11 ± 10,32% (исходно 84,74 ± 14,09% (p < 0,05). По остальным областям не получено достоверной динамики изменения перфузии. Отмечена лишь тенденция повышения мозгового кровотока в височно-затылочных, височно-теменных и лобно-теменных областях (рис. 12).
Достоверное улучшение состояния перфузии головного мозга на фоне терапии Небилетом, предположительно, обусловлено несколькими факторами. Повышение продукции NO, как дополнительное свойство небиволола, приводит к улучшению способности сосудов микроциркуляторного русла головного мозга к вазодилятации. Наряду с этим, достоверное снижение уровня триглицеридов и постпрандиального уровня глюкозы на фоне применения небиволола способствует улучшению реологических свойств крови и снижению повышенной способности к тромбообразованию. Кроме того, небиволол не снижает сердечный выброс. Все эти эффекты небиволола, вероятно, обеспечивают улучшение кровотока в сосудах микроциркуляторного русла головного мозга [23].
Заключение
Проведенные нами исследования свидетельствуют об эффективности и безопасности применения Небилета (небиволола) у больных МС и АГ. Небилет не только заметно снижал АД в течение суток при однократном приеме, не нарушая его суточного ритма, но и оказывал положительное влияние на углеводный и липидный обмен, что выгодно отличает его от всех известных препаратов этой группы. Способность небиволола стимулировать синтез NO эндотелием сосудов приводила к достоверному улучшению состояния перфузии головного мозга, выявляемому при сцинтиграфии. Эффективное снижение АД на фоне приема Небилета сопровождалось улучшением показателей ВРС (нарастанием исходно сниженной СВВР). Отсутствие улучшения показателей ВРС или их ухудшение в ходе антигипертензивной терапии является фактором, который следует учитывать при подборе терапии. Динамика ВРС лучше отражает динамику самочувствия пациента, чем динамика АД. На фоне терапии Небилетом было отмечено среднесуточное укорочение исходно удлиненного значения интервала QT, что также является важным предиктором эффективности антигипертензивной терапии. Вместе с тем нами не было выявлено отрицательного влияния небиволола на уровень гормонов щитовидной железы, тогда как уровень альдостерона у исследуемых нами больных существенно снижался. Сходные данные в отношении альдостерона были получены зарубежными исследователями у больных АГ [32].
Таким образом, Небилет (небиволол) – бета-адреноблокатор третьего поколения, обладающий уникальными свойствами, – представляется перспективным препаратом для применения у больных МС и АГ.
1. Kannel W.B., McGee D.L. Diabetes and cardiovascular risk factors: the Framingham Study // Circulation. 1979. Vol. 59. № 1. P. 8–13.
2. Haffner S., Lehto S., Ronnemaa T., Pyorala K., Laakso M. Mortality from coronary heart disease in subject with type 2 diabetes and nondiabetic subjects with and without prior myocardial infarction // N. Engl. J. Med. 1998. Vol. 339. № 4. P. 229–234.
3. Pickup J.C., Crook M.A. Is type II diabetes mellitus a disease of innate immune system? // Diabetologia. 1998. Vol. 41. № 10. P. 1241–1248.
4. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in Type 2 diabetes: UKPDS 38 // Br Med J. 1998. Vol. 317. № 7160. P. 703–713.
5. Jonas M., Reicher-Reiss H., Boyko V., Shotan A., Mandelzweig L., Goldbourt U., Behar S. Usefulness of beta-blocker therapy in patients with non-insulin-dependent diabetes mellitus and coronary artery disease. Bezafibrate Infarction Prevention (BIP) Study Group // Am. J. Cardiol. 1996. Vol. 77. № 15. P. 1273–1277.
6. Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1. First International Study of Infarct Survival Collaborative Group // Lancet. 1986. Vol. 2. № 8498. P. 57–66.
7. The MIAMI Trial Research Group. Metoprolol in acute myocardial infarction (MIAMI). A randomized placebo-controlled international trial // Eur. Heart J. 1985. Vol. 6. № 3. P. 199–226.
8. Hjalmarson A., Elmfeldt D., Herlitz J., Holmberg S., Málek I., Nyberg G., Rydén L., Swedberg K., Vedin A., Waagstein F., Waldenström A., Waldenström J., Wedel H., Wilhelmsen L., Wilhelmsson C. Effect on mortality of metoprolol in acute myocardial infarction. A double blind randomized trial // Lancet. 1981. Vol. 2. № 8251. P. 823–827.
9. Cleophas T.J. Experimental evidence of selective antagonistic action of Nebivolol on β1-adrenergic receptors // J. Clin. Med. 1998. Vol. 2. P. 1–8.
10. Van Nueten J.M. et al. In vitro pharmacological profile of R065824, a potent and selective β1-adrenergic antagonist // JRF Preclinical Research Report R065834/8. November 1985.
11. Flather M.D., Shibata M.C., Coats A.J., Van Veldhuisen D.J., Parkhomenko A., Borbola J., Cohen-Solal A., Toman J., Bohm M., Anker S.D., Thompson S.G., Poole-Wilson P.A. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patient with heart failure (SENIORS) // Eur Heart J. 2005. Vol. 26. № 3. P. 215–225.
12. Cockcroft J.R., Chowienczyk P.J., Brett S.E., Chen C.P., Dupont A.G., Van Nueten L., Wooding S.J., Ritter J.M. Nebivolol vasodilates human forearm vasculature: evidence of L-arginine/NO-dependent mechanism // J. Pharmacol. Exp. Ther. 1995. Vol. 274. № 3. P. 1067–1071.
13. Van de Water A., Janssens W., Van Neuten J., Xhonneux R., De Cree J., Verhaegen H., Reneman R.S., Janssen P.A. Pharmacological and hemodynamic profile of Nebivolol, a chemically novel, potent, and selective beta 1-adrenergic antagonist // J Cardiovasc Pharm. 1988. Vol. 11. № 5. P. 552–563.
14. Janssens W.J., Geyskens D., Proost F. Comparison of the β-adrenergic antagonistic effects of Nebivolol, carvedilol, celiprolol and bisoprolol on isolated right atria and trachea of the guinea-pig. Preclinical Research Report. June 1996.
15. Cockcroft J.R., Chowienczyk P.J., Brett S.E., Chen C.P., Dupont A.G., Van Nueten L., Wooding S.J., Ritter J.M. Nebivolol vasodilates human forearm vasculature: evidence of L-arginine/NO-dependent mechanism // J. Pharmacol. Exp. Ther. 1995. Vol. 274. № 3. P. 1067–1071.
16. De Cree J. et al. Double blind placebo-controlled cross-over study evaluating the acute haemodynamic effects of dl-Nebivolol 5 mg, d-Nebivolol 2,5 mg an l-Nebivolol 2,5 mg in healthy volunteers // JRF Clinical Research Report on R67555 NO-35. February 1989.
17. Blankestijn P.J. et al. Nebivolol. An acute and long term study in essential hypertension // Drug Invest. 1991. Vol. 3. Suppl. 1. P. 152–154.
18. Jennings G. et al. Effects of Nebivolol on haemodynamics, cardiac dimensions and function, cardiovascular reflexes and biochemical measures of sympathetic activity in normal human subjects // Drug Invest. 1991. Vol. 3. Suppl. 1. P. 51–59.
19. Louis W.J. et al. A study to establish the acute effects of Nebivolol on blood pressure and whether or not there are first dose postural effects in middle aged and elderly patients // Unpublished report on NEB-AUS-3. March 1995.
20. Kleiger R.E., Miller J.P., Bigger J.T. Jr., Moss A.J. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction // Am. J. Cardiol. 1987. Vol. 59. № 4. P. 256–262.
21. Zanchetti A. Trough: peak ratio of the blood pressure response to dihydropiridine calcium antagonists // J. Hypertens. 1994. Vol. 12. № 8. P. S97–S106.
22. Van Nueten L., Lacourcière Y., Vyssoulis G., Korlipara K., Marcadet D.M., Dupont A.G., Robertson J.I. Nebivolol versus nifedipine in treatment of essential hypertension: a double-blind, randomized, comparative trial // Am. J. Ther. 1998. Vol. 5. № 4. P. 237–243.
23. Чазова И.Е., Мычка В.Б. Метаболический синдром. М.: Медиа Медика, 2008. 324 с.
24. Мычка В.Б., Жернакова Ю.В., Зюзина Н.Е., Шишова Т.А., Рябыкина Г.В., Лаптев Д.Н., Масенко В.П., Чазова И.Е. Эффективность небиволола у больных сахарным диабетом и метаболическим синдромом // Consilium medicum. 2008. Т. 10. № 5. C. 86–90.
25. Kleiger R.E., Miller J.P., Bigger J.T., Moss A.J. and the Multicenter Post-Infarction Reseach GrouP. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction // Am. J. Cardiol. 1987. Vol. 59. № 4. P. 256–262.
26. Дощицин В.Л. Внезапная аритмическая смерть // Клиническая медицина. 1992. № 9–10. С. 30–34.
27. Rossing P., Breum L., Major-Pedersen A., Sato A., Winding H., Pietersen A., Kastrup J., Parving H.H. Prolonged QTc interval predicts mortality in patients with I type dibets mellitus // Diabet. Med. 2001. Vol. 18. № 3. P. 199–205.
28. Шишова Т.А., Мычка В.Б., Лаптев Д.Н., Кожемякина Е.Ш., Лютикова Л.Н., Рябыкина Г.В. Влияние небиволола на уровень АД, длительность интервала QT и показатели ВРС у больных с мягкой артериальной гипертонией и метаболическим синдромом при бифункциональном мониторироварии ЭКГ и АД // Вестник аритмологии. 2009. Приложение А. С. 41.
29. Bertel O. Marx B.E., Conen D. Effects of antihypertensive treatment on cerebral perfusion // Am. J. Med. 1987. Vol. 82. № 3B. P. 29–36.
30. Meyer J.S., Rogers R.L., Mortel R.F. Prospective analysis of long-term control of mild hypertension in cerebral blood flow // Stroke. 1985. Vol. 16. Supp. 6. P. 985–990.
31. Hares P., James I.M., Griffith D. The effect of acebutolol on the cerebral circulation of man // Br. J. Clin. Pharmacol. 1977. Vol. 4. № 3. P. 373–375.
32. Chan T.Y., Woo K.S., Nicholls M.G. The application of nebivolol in essential hypertension: a double-blind, randomized, placebo-controlled study // Int. J. Cardiol. 1992. Vol. 35. № 3. P. 387–395.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
В связи с высоким риском развития сердечно-сосудистых осложнений, приводящих к ранней инвалидизации и преждевременной смерти, сахарный диабет 2 типа (СД 2 типа) в недалеком будущем может стать главной проблемой здравоохранения в мире.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
