Саксаглиптин – высокоселективный ингибитор ДПП-4 в лечении сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки
Для обозначения гормональной активности кишечника, которая повышает секрецию инсулина, в 1932 г. в научный оборот введен термин инкретин. В настоящее время не вызывает сомнений то, что эндокринное регулирование функции островков Лангерганса может участвовать в процессе поддержания гомеостаза глюкозы.
Для обозначения гормональной активности кишечника, которая повышает секрецию инсулина, в 1932 г. в научный оборот введен термин инкретин. В настоящее время не вызывает сомнений то, что эндокринное регулирование функции островков Лангерганса может участвовать в процессе поддержания гомеостаза глюкозы.
![Рис. 1. Регуляция обмена глюкозы инкретинами после приема пищи [41].](/upload/resize_cache/iblock/d9b/195_350_1/d9be45be713cf1a193efb731bf003f3a.png)
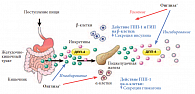

Эффект инкретина
После приема глюкозы внутрь отмечается более выраженное увеличение секреции инсулина по сравнению с тем, которое наблюдается после внутривенной инфузии глюкозы, сопровождающейся идентичным повышением уровня глюкозы крови [17]. Этот эффект, названный «инкретиновым», свидетельствует о большой значимости сигналов ЖКТ в гормональной регуляции гомеостаза глюкозы. У пациентов с сахарным диабетом (СД) 2 типа наблюдается почти полная потеря инкретинового эффекта [7]. Это значит, что в основе секреторной недостаточности β-клеток при СД 2 типа лежит преимущественно недостаток инкретина. Инкретины относятся к семейству гормонов, стимулирующих секрецию инсулина в ответ на прием пищи. Около 60% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов [17], который значительно снижен у больных с СД 2 типа и НТГ [3, 12, 17]. Двумя самыми важными гормонами-инкретинами являются:
- глюкозозависимый инсулинотропный полипептид (ГИП, GIP);
- глюкагоноподобный пептид (ГПП-1, GLP-1) [8, 9].
Глюкозозависимый инсулинотропный полипептид состоит из 42 аминокислот, принадлежит (как и ГПП-1) к семейству пептидных гормонов глюкагон-секретинов, которых объединяет схожесть аминокислотной последовательности с молекулой глюкагона, составляющая от 21% до 48% [2]. Несмотря на то что эти пептиды происходят из одного предшественника – проглюкагона, они существенно различаются по влиянию на основные метаболические процессы. Предшественником ГИП является полипептид с 153 аминокислотами [10], но специфические функции других фрагментов предшественника пока не идентифицированы. Рецептор ГИП клонирован и относится к семейству рецепторов глюкагона-секретина. Его экспрессия наблюдается в островках Лангерганса, а также в кишечнике, жировой ткани, сердце, гипофизе, коре надпочечников и нескольких областях мозга [11]. ГИП секретируется К-клетками, самая высокая плотность которых наблюдается в двенадцатиперстной кишке, однако они обнаружены и в слизистой всего тонкого кишечника [12]. Стимуляторами секреции ГИП являются углеводы и жиры химуса. Обычно наблюдается 10–20-кратное повышение плазменной концентрации ГИП в ответ на прием пищи [13].
Взаимодействие ГИП с его рецептором на β-клетках вызывает повышение уровня цАМФ, которое в свою очередь увеличивает внутриклеточную концентрацию кальция и усиливает экзоцитоз гранул, содержащих инсулин [14]. Среди пептидов, которые вырабатываются в ЖКТ в ответ на поступление пищи, наибольшее внимание ученых привлекает глюкагоноподобный пептид-1 (GLP-1; ГПП-1). Подобно ГИП он взаимодействует с G-протеинсвязывающим рецептором β-клеток, вызывающим накопление цАМФ. Известно, что у здоровых людей ГПП-1 является одним из сильных стимулятором секреции инсулина [2, 5, 12]. ГПП-1 представляет собой продукт гена, кодирующего глюкагон [2, 12]. Экспрессия этого гена происходит не только в β-клетках поджелудочной железы, но также и в L-клетках слизистой тонкого кишечника [15]. По-видимому, L-клетки – самые многочисленные эндокринные клетки кишечника, а по распространенности в кишечнике их популяция является второй после энтерохромафиновых клеток [15]. В L-клетках первичный продукт трансляции гена проглюкагон расщепляется не с образованием глюкагона, как в α-клетках, а с отщеплением от С-конца двух глюкагоноподобных пептидов ГПП-1 и ГПП-2 [2, 12, 20], которые характеризуются практически 50% гомологией по аминокислотной последовательности с глюкагоном [1, 2].
ГПП-1 имеет короткий период полужизни, который составляет около 60–90 секунд [1, 3, 5]. Элиминация ГПП-1 из системной циркуляции осуществляется тремя основными механизмами: почечная и печеночная экскреции, а также деградация гормона в крови. Под влиянием дипептидилпептидазы-4 (ДПП-4) происходит его быстрая инактивация с образованием неактивных метаболитов амида ГПП-1 (9–36) и ГПП-1 (9–37), выступающих в роли антагонистов ГПП-1 рецепторов [7, 15]. ГПП-1 выделяется в системную циркуляцию после приема пищи [1, 2, 15]. Многочисленные исследования показали, что секреция ГПП-1 дистальными отделами ЖКТ контролируется нервными и эндокринными сигналами, которые инициируются поступлением пищи в проксимальные отделы ЖКТ, а также прямым воздействием пищевых нутриентов на L-клетки [3, 5, 21]. Быструю секрецию ГПП-1 одинаково эффективно стимулирует прием как смешанной пищи, так и пищи, богатой жирами и углеводами. Более значительное выделение ГПП-1 наблюдается после приема жидкой пищи, нежели твердой (при идентичности состава) [2, 15]. Основным фактором, стимулирующим секрецию ГПП-1, являются углеводы пищи. В реализацию инициирующих эффектов глюкозы и галактозы вовлечен котранспортер кишечного эпителия натрий / глюкоза [2, 15]. Такие сахара, как фруктоза, 2-деоксиглюкоза и лактоза, не влияют на секрецию ГПП-1 L-клетками тонкого кишечника [15]. Наряду с глюкозой, пищевой жир и смешанная пища, включающая белки, также стимулирует секрецию ГПП-1 [2, 3, 15, 17, 20].
Физиологические эффекты ГПП-1 реализуются после его взаимодействия с ГПП-1-рецепторами, которые экспрессируются во многих органах и тканях, включающих поджелудочную железу, желудок, тонкий кишечник, мозг, гипофиз, легкие, почки, сердце [1, 3, 19]. Функция этих рецепторов во многих из этих тканей остается до конца неизученной. Основным органом-мишенью для ГПП-1 являются островки Лангерганса [1, 3, 12]. Инсулинотропная активность ГПП-1, которая четко зависит от уровня гликемии, реализуется путем взаимодействия ГПП-1 со специфическими рецепторами, расположенными на мембране β-клетки [1, 2, 5]. Необходимо отметить, что ГПП-1 активирует ген глюкокиназы и ген, кодирующий транспортер глюкозы GLUT 2, которые ответственны за внутриклеточный механизм секреции инсулина [13, 15]. Инфузия ГПП-1 вызывает снижение концентрации глюкозы крови до уровня гликемии натощак [6, 17, 18]. Как только уровень гликемии снижается и приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается [15]. Таким образом, клинически важным следствием зависимости эффектов ГПП-1 от уровня глюкозы крови является то, что ГПП-1 не может вызвать развитие выраженной гипогликемии (рис. 1).
Действие ГПП-1 способствует адекватному секреторному ответу β-клеток на глюкозу. Это важное свойство ГПП-1 может улучшить способность β-клеток к восприятию глюкозы и их секреторный ответ на глюкозу у пациентов с нарушенной толерантностью к глюкозе. Существует обратная зависимость между пищевой секрецией ГПП-1 и ростом инсулинорезистентности [2, 3, 12]. Другим важным физиологическим эффектом ГПП-1 является его влияние на секрецию глюкагона [1, 4, 13]. ГПП-1 подавляет секрецию глюкагона панкреатическими α-клетками в ответ на повышение уровня глюкозы [13, 15]. Таким образом, ГПП-1 регулирует концентрацию глюкозы плазмы, модулируя секрецию как инсулина, так и глюкагона, и необходим для поддержания нормальной толерантности к глюкозе и адекватной постпрандиальной секреции инсулина.
Хорошо известно, что в регуляции работы желудка принимает участие дистальная часть тонкого кишечника [2]. ГПП-1 представляет собой один из тех гормонов, которые контролируют скорость опорожнения желудка [1, 3, 18] путем связывания с мозговыми рецепторами с последующей стимуляцией парасимпатических нервов [17, 20]. ГПП-1 замедляет опорожнение желудка, снижает желудочную (стимулированную пентагастрином и пищевыми стимулами) и панкреатическую секрецию. Такой эффект ГПП-1, как замедление опорожнения желудка, перспективен для использования в терапии СД 2 типа с целью снижения прандиальной экскурсии глюкозы [19, 21, 24] . Наиболее неожиданным действием ГПП-1 оказалось, по-видимому, подавление поглощения пищи и воды [8, 15, 22]. Согласно последним данным, ГПП-1 является сильным анорексигенным гормоном, схожим по действию с лептином, и антагонистом таких орексигенных гормонов, как нейропептид Y и кортиколиберин. ГПП-1 участвует в процессах регуляции пищевого поведения, действуя через центральные механизмы, и способствует развитию чувства насыщения [1, 2, 5].
Mai-Britt Toft-Nielsen и др., используя определение высоко специфичного COOH-концевого отрезка ГИП у пациентов с диабетом 2 типа, обнаружили почти нормальные уровни ГИП (пиковые и натощак) в ответ на прием пищи при очень существенном нарушении секреции ГПП-1. При СД 2 типа нарушенный «инкретиновый эффект» является одним из патофизиологических механизмов, приводящих к неадекватной секреции инсулина. При проведении тестов с изогликемической пероральной и внутривенной нагрузкой глюкозой у пациентов с СД 2 типа практически полностью отсутствовал или был значительно снижен «эффект инкретинов» [13, 19].
Введение гормонов-инкретинов пациентам СД 2 типа может полностью нормализовать у них чувствительность β-клеток к глюкозе, а также частично восстановить утраченную первую фазу и полностью – вторую фазу секреции инсулина в условиях гипергликемического клэмп-теста [13]. Крайне важно заметить, что физиологические эффекты ГПП-1 могут воздействовать на практически все хорошо известные патофизиологические нарушения при СД 2 типа, а именно: дисфункция β-клеток; сниженный «эффект инкретинов»; гиперсекреция глюкагона, приводящая к избыточному эндогенному образованию глюкозы и гипергликемии натощак и постпрандиально; ускоренное опорожнение желудка; повышенный аппетит и избыточная масса тела; прогрессивное снижение количества β-клеток поджелудочной железы [4, 22, 24, 25].
Создание высокоселективного ингибитора ДПП-4 – Саксаглиптина – серьезный прорыв в терапии СД 2 типа.
В связи с тем, что ГПП-1 инактивируется в организме в течение нескольких минут вследствие отщепления аминокислоты аланина под действием дипептидилпептидазы-4 (ДПП-4), особый интерес представляют ингибиторы данного фермента, позволяющие в полной мере использовать потенциал эндогенного ГПП-1. Ингибиторы ДПП-4 продлевают период полужизни инкретинов, благодаря чему усиливается их инсулинотропное действие. ДПП-4 относится к семейству серин-пептидаз, куда входят также ДПП-8 и ДПП-9. Функция ДПП-8 и ДПП-9 пока не ясна, при их экспериментальном введении у крыс развивалась алопеция, наблюдалась тромбоцито- и ретикулоцитопения, увеличение селезенки и повышенная смертность. Введение ДПП-4 в экспериментах не сопровождалось побочными эффектами.
Одним из современных ингибиторов ДПП-4 является препарат Саксаглиптин (Онглиза®). Саксаглиптин (Онглиза) обладает высокой селективностью и сродством к ДПП-4, что позволяет ему сохранять ингибирующее действие в отношении фермента в течение 24 часов. Являясь высокоселективным ингибитором ДПП-4, Саксаглиптин связывается с ферментом и блокирует его действие, что сопровождается увеличением концентрации ГПП-1 в 2–3 раза (рис. 2). На фоне приема Саксаглиптина снижается концентрация глюкагона, усиливается глюкозозависимая активность β-клеток, что приводит к увеличению концентрации инсулина и С-пептида у больных СД 2 типа. Воздействие Саксаглиптина на секрецию инсулина и глюкагона путем увеличения концентрации нативного ГПП-1 приводит к снижению уровня глюкозы не только в постпрандиальном периоде, но и натощак, и таким образом способствует достижению целевых значений HbA1с у больных СД 2 типа [16].
Общая характеристика препарата
При приеме внутрь Саксаглиптин быстро всасывается из желудочно-кишечного тракта независимо от приема пищи. Биодоступность препарата при его пероральном применении составляет не менее 75%. При многократном приеме Саксаглиптина отсутствуют признаки его накопления в организме и снижения скорости его метаболизма под действием высоких концентраций препарата. Саксаглиптин метаболизируется главным образом в печени при участии изоферментов цитохрома P450 3A4/5 (CYP3A4/5) с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у Саксаглиптина. Саксаглиптин выделяется через желудочно-кишечный тракт и почки. Связывание Саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение Саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Применение препарата у особых групп пациентов
У пациентов с легкой степенью почечной недостаточности (клиренс креатинина 50–80 мл/мин) величина площади под кривыми «концентрация – время» (AUC) Саксаглиптина и его основного метаболита были соответственно в 1,2 и 1,7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек (клиренс креатинина > 80 мл/мин). Данное увеличение значений AUC не является клинически значимыми, поэтому коррекции дозы Саксаглиптина у этой категории пациентов не требуется. В связи с тем, что при назначении препарата пациентам с почечной недостаточностью средней степени тяжести (клиренс креатинина 30–50 мл/мин) значения AUC для Саксаглиптина и его метаболита были в 1,4 и 2,9 раза, а при тяжелой степени (клиренс креатинина < 30 мл/мин) почечной недостаточности – в 2,1 и 4,5 раза выше, чем у пациентов без признаков почечной недостаточности, необходимо снижение дозы Саксаглиптина до 2,5 мг в сутки этим больным [36] .
При проведении 12-недельного двойного слепого рандомизированного, контролируемого в параллельных группах исследования по оценке эффективности и безопасности 2,5 мг Саксаглиптина у пациентов с неадекватным гликемическим контролем на фоне СД 2 типа и легкой или умеренной почечной недостаточности было показано, что Саксаглиптин в дозе 2,5 мг значительно снижает уровень HbA1c в сравнении с плацебо (-0,86% на фоне препарата против -0,44% на фоне плацебо, р = 0,007). При этом профиль безопасности 2,5 мг Саксаглиптина у данной категории пациентов был сопоставим с показателями безопасности плацебо [39]. У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики Саксаглиптина, поэтому коррекции дозы препарата у таких пациентов не требуется [37].
У пациентов 65–80 лет не было выявлено клинически значимых различий параметров фармакокинетики Саксаглиптина по сравнению с пациентами более молодого возраста (18–40 лет), поэтому коррекции дозы у пожилых пациентов не требуется [38] . Ретроспективный анализ объединенных данных исследований 3 фазы моно- и комбинированной терапии Саксаглиптином также показал, что препарат эффективен в отношении всех показателей гликемического контроля (HbA1c, глюкоза плазмы натощак и после еды) как у молодых лиц, так и у пациентов старше 65 лет, при этом профиль безопасности препарата сопоставим с плацебо как у молодых лиц, так и у пациентов старше 65 лет [40].
Эффективность Саксаглиптина
Терапевтическая эффективность Саксаглиптина у больных СД 2 типа при монотерапии и в комбинации с другими пероральными сахаропонижающими препаратами (ПСП) изучалась в нескольких клинических исследованиях длительностью от 24 до 102 недель. В исследования II/III фазы было включено более 4 000 пациентов СД 2 типа в возрасте от 18 до 77 лет. У всех пациентов СД был в состоянии декомпенсации (HbA1c 8–12%). При этом эффективность препарата оценивалась как у пациентов с СД 2 типа, не получавших ранее медикаментозную терапию, так и на фоне ранее назначенного лечения ПСП [26–32].
Саксаглиптин назначался в дозах 2,5 мг, 5 мг или 10 мг 1 раз в день. Поскольку применение Саксаглиптина в дозе 10 мг не сопровождалось значимым увеличением эффективности препарата по сравнению с дозой 5 мг, последняя, по результатам клинических исследований, была признана наиболее оптимальной для лечения больных СД 2. Критериями оценки эффективности Саксаглиптина была динамика уровней HbA1c, глюкозы плазмы натощак и после приема пищи по сравнению с исходными значениями и результатами, полученными в группе плацебо, а также число пациентов (в %), достигших целевого уровня HbA1c < 7,0% [26–32]. Эффективность монотерапии Саксаглиптином оценивалась в трех рандомизированных двойных слепых плацебо-контролируемых исследованиях у пациентов СД 2 типа, не получавших ранее медикаментозную терапию.
Проведенные исследования продемонстрировали эффективность Саксаглиптина в отношении снижения уровней постпрандиальной гликемии и гликемии натощак, а также HbA1c по сравнению с исходными данными и результатами в группах плацебо. При назначении Саксаглиптина в дозе 5 мг в сутки в течение 12–24 недель произошло снижение уровня HbA1c на 0,46–0,9%, тогда как в группах плацебо динамика HbA1c составила 0,26–0,27% по сравнению с исходными данными (p < 0,05). Снижение HbA1c наблюдалось начиная с четвертой недели применения Саксаглиптина и было более выраженным у пациентов с изначально более высоким значением HbA1c. У пациентов, принимавших Саксаглиптин, начиная со второй недели применения наблюдалось статистически более значимое, чем в группе плацебо, снижение уровня глюкозы плазмы как натощак, так и в постпрандиальном периоде [26, 27].
Эффективность комбинированной терапии Саксаглиптином и метформином была оценена в двух клинических исследованиях у пациентов СД 2 типа, не получавших медикаментозного лечения до начала исследования, и у больных СД 2 типа на фоне ранее назначенной терапии метформином. Как показали эти исследования, комбинированная терапия данными лекарственными средствами является более эффективной, чем монотерапия каждым из этих препаратов.
В исследовании, где пациентам, не получавшим ранее медикаментозного лечения, была назначена стартовая терапия двумя препаратами, снижение HbA1c на фоне комбинированного применения Саксаглиптина и метформина составило в среднем 2,5% по сравнению с исходными значениями. Степень снижения уровня HbA1c в группе комбинированной терапии зависела от исходных значений HbA1c и была более выраженной у пациентов с наиболее высокими значениями показателя до начала исследования. Уровень глюкозы в плазме натощак (ГПН) и после приема пищи у пациентов группы комбинированной терапии также снизился в большей степени, чем в группах монотерапии Саксаглиптином или метформином. Число пациентов (в %), достигших целевого значения HbA1c [28], было достоверно выше в группе комбинированной терапии в сравнении с результатами, полученными в группе монотерапии метформином (рис. 3).
Эффективность комбинированной терапии Саксаглиптином и метформином была продемонстрирована и в исследовании, в котором приняли участие пациенты с СД 2 типа и неадекватным гликемическим контролем на фоне рекомендованной им ранее монотерапии метформином. У всех пациентов, получавших 5 мг Саксаглиптина в комбинации с метформином, было отмечено снижение уровней HbA1c в среднем на 0,7%, ГПН на 1,2 ммоль/л, а постпрандиальной глюкозы на 3,2 ммоль/л по сравнению с исходными значениями показателей. Эти данные были достоверно более значимыми изменениями в сравнении с результатами в группе монотерапии метформином. Назначение Саксаглиптина на фоне терапии метформином также сопровождалось снижением постпрандиальной секреции глюкагона и увеличением постпрандиальной секреции инсулина по сравнению с исходными данными [29].
В настоящее время получены результаты долгосрочного наблюдения по оценке эффективности комбинированной терапии Саксаглиптином и метформином на протяжении 102 недель лечения. Эти данные свидетельствуют о том, что комбинированная терапия Саксаглиптином и метформином обеспечивает более длительный, клинически значимый гликемический контроль в сравнении с монотерапией метформином [35]. Применение Саксаглиптина в качестве второго препарата в комбинированой терапии с производными сульфонилмочевины и тиазолидиндионами сопровождалось достоверно более выраженным снижением показателей углеводного обмена (HbA1c, ГПН и ППГ) по сравнению с исходными данными, чем на фоне монотерапии глибенкламидом или тиазолидиндионами (p < 0,001). Снижение уровня HbA1c на фоне комбинированной терапии Саксаглиптином и глибенкламидом составило в среднем 0,6%, тогда как в группе пациентов, получающих монотерапию субмаксимальными и максимальными дозами глибенкламида, произошло увеличение HbA1c на 0,1%. У пациентов, получавших 5 мг Саксаглиптина в комбинации с тиазолидиндионами, динамика HbA1c составила -0,9% по сравнению с исходными данными.
После 24 недель лечения количество пациентов, достигших уровня HbA1c < 7%, было достоверно выше в группе больных, получавших Саксаглиптин, чем в группах монотерапии глибенкламидом или тиазолидиндионами, и составило 22,8% в группе «Саксаглиптин + глибенкламид» (против 9,1% на монотерапии глибенкламидом) и 41,8% в группе «Саксаглиптин + тиазолидиндион» (против 25,6% на монотерапии тиазолидиндионами) [30–32]. Безусловный интерес представляют результаты исследования по оценке эффективности и безопасности комбинированной терапии Саксаглиптином и метформином в сравнении с комбинированной терапией метформином и производными сульфонилмочевины (глипизидом). Результаты этого 52-недельного многоцентрового двойного слепого рандомизированного исследования с включением 858 пациентов с СД 2 типа и неадекватным гликемическим контролем на фоне монотерапии метформином показали следующее:
- Саксаглиптин в комбинации с метформином не уступает по эффективности комбинированной терапии глипизидом и метформином (динамика HbA1c: -0,74% на фоне «Саксаглиптин + метформин» против -0,80% на фоне «глипизид + метформин»);
- на фоне комбинированной терапии Саксаглиптином и метформином значительно реже развивалась гипогликемия (число пациентов, перенесших гипогликемию: 3% при лечении комбинацией «Саксаглиптин + метформин» против 36,3% на фоне терапии «глипизид + метформин», р < 0,0001);
- при терапии Саксаглиптином и метформином наблюдается снижение массы тела (динамика массы тела: в среднем -1,1 кг на фоне терапии «Саксаглиптин + метформин» против + 1,1 кг на фоне терапии «глипизид + метформин», р < 0,0001);
- комбинированная терапия Саксаглиптином и метформином обеспечивает более длительный, клинически значимый гликемический контроль в сравнении с комбинированной терапией глипизидом и метформином [34].
Безопасность Саксаглиптина
Клинические исследования доказали не только эффективность Саксаглиптина в лечении СД 2 типа, но и его безопасность. При назначении Саксаглиптина в дозе, в 80 раз превышающей терапевтическую (400 мг в сутки) в течение 2 недель, не было выявлено неблагоприятных побочных реакций или клинически значимых патологических изменений со стороны лабораторных показателей. Частота возникновения побочных реакций у пациентов, получавших Саксаглиптин, была сопоставима с результатами, полученными в группе плацебо. При применении Саксаглиптина в комбинации с метформином, глибенкламидом и тиазолидиндионами частота возникновения неблагоприятных побочных реакций была сопоставима с данными, полученными в группах монотерапии этими препаратами.
Наиболее частыми неблагоприятными побочными реакциями были головная боль, инфекционные заболевания верхних дыхательных путей, урологические инфекции и ринофарингит [26–32]. Безусловным преимуществом Саксаглиптина является отсутствие негативного влияния на массу тела, которое имеет огромное значение у этой категории больных, поскольку увеличение массы тела на фоне лечения производными сульфонилмочевины и тиазолидиндионами не только затрудняет достижение целевых значений гликемии, но и со временем становится одной из причин ухудшения гликемического контроля [26–29].
Не менее важным преимуществом применения Саксаглиптина является низкий риск гипогликемии на фоне лечения этим препаратом [26–29]. На фоне комбинированной терапии Саксаглиптином и глибенкламидом была отмечена более высокая частота гипогликемических состояний – у 14,6% пациентов, принимавших Саксаглиптин в дозе 5 мг, и у 10,1% пациентов в группе монотерапии глибекламидом. В связи с этим следует помнить, что применение Саксаглиптина в комбинации с производными сульфонилмочевины может потребовать снижения ранее рекомендованной дозы данной группы препаратов [30]. Метаанализ восьми клинических исследований показал, что применение Саксаглиптина в качестве монотерапии или в комбинации с другими ПСП не сопровождается увеличением риска осложнений со стороны сердечно-сосудистой системы. Безопасность применения Саксаглиптина у пациентов с СД 2 типа в отношении риска сердечно-сосудистых заболеваний очень важна, поскольку СД 2 типа уже является независимым фактором риска ССЗ [33].
Показания к применению
Саксаглиптин показан при сахарном диабете 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
- монотерапии;
- стартовой комбинированной терапии с метформином;
- добавления к монотерапии метформином, тиазолидиндионами, производными сульфониломочевины, при отсутствии адекватного гликемического контроля данной терапии.
Противопоказания к применению
В связи с тем, что применение Саксаглиптина в период беременности не изучено, не следует принимать препарат в этот период. Неизвестно, проникает ли Саксаглиптин в грудное молоко. Поскольку такая возможность не исключена, следует прекратить грудное вскармливание на период лечения Саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери. Препарат противопоказан, если имеется:
- повышенная индивидуальная чувствительность к любому компоненту препарата;
- сахарный диабет 1 типа (применение не изучено);
- применение совместно с инсулином (не изучено);
- диабетический кетоацидоз;
- врожденная непереносимость галактозы, врожденная лактазная недостаточность и врожденная глюкозо-галактозная мальабсорбция;
- беременность, лактация;
- возраст до 18 лет (безопасность и эффективность не изучены).
Заключение
Результаты проведенных клинических исследований позволяют сделать вывод об эффективности Саксаглиптина в отношении улучшения показателей гликемического контроля у больных СД 2 типа при назначении препарата как в качестве монотерапии, так и в комбинации с другими противодиабетическими препаратами. При этом применение Саксаглиптина не увеличивает риск возникновения гипогликемии и сердечно-сосудистых заболеваний, не влияет на массу тела. Препарат хорошо переносится и характеризуется частотой развития неблагоприятных побочных реакций, сопоставимой с плацебо. Назначение препарата не требует коррекции в зависимости от возраста, пола пациента, наличия заболеваний печени, сопровождающихся нарушением функции, и легкой почечной недостаточности. Таким образом, благоприятное соотношение риск/польза при применении Саксаглиптина расширяет терапевтические возможности при лечении пациентов с сахарным диабетом 2 типа.
Для обозначения гормональной активности кишечника, которая повышает секрецию инсулина, в 1932 г. в научный оборот введен термин инкретин. В настоящее время не вызывает сомнений то, что эндокринное регулирование функции островков Лангерганса может участвовать в процессе поддержания гомеостаза глюкозы.
