Как повысить эффективность лечения диабетической нейропатии?
- Аннотация
- Статья
- Ссылки

Несмотря на достижения в области диагностики и лечения сахарного диабета (СД), хронические осложнения заболевания до сих пор остаются главной проблемой для большинства пациентов. Диабетическая нейропатия (ДН) – наиболее часто встречающееся осложнение СД. Ее частота, по данным различных авторов, варьирует от 30 до 90% и прогрессивно нарастает по мере увеличения длительности и степени тяжести диабета [5, 16, 17, 22]. Тяжелые проявления ДН наблюдаются более чем у 10% больных СД [3, 11, 18]. В то же время латентные бессимптомные формы ДН при проведении комплексного электронейромиографического исследования обнаруживаются у 100% больных СД [5]. Риск развития ДН повышается на 10–15% на каждый один ммоль/л подъема концентрации гликемии натощак или на 1% уровня HbA1c [7].
Это одно из наиболее тяжелых осложнений СД, которое характеризуется ранней инвалидизацией пациентов, значительным ухудшением качества жизни больных в целом [11, 22]. Доказан факт, что ДН является основой развития 75% случаев синдрома диабетической стопы, который, в свою очередь, может привести к необходимости ампутации нижних конечностей [3, 4, 28]. Частота случаев ампутации нижних конечностей у больных СД в 15–30 раз превышает показатель в общей популяции и составляет 50–70% общего количества всех нетравматических ампутаций [11, 28]. Наиболее распространенной клинической формой является дистальная симметричная ДН, на долю которой приходится более половины всех случаев поражения периферической нервной системы при СД [6, 16, 22].
Хотя почти в 50% случаев этот синдром протекает бессимптомно, пациенты в связи с утратой болевой чувствительности подвергаются риску повреждения ног [13]. Как следствие, на стопах образуются язвы, усугубление которых в тяжелых случаях может привести к ампутации конечности [4]. Вторая по частоте – автономная ДН, наблюдаемая у 15–30% больных СД 2 типа при постановке диагноза и у половины – спустя 20 лет от начала заболевания [5, 11, 16]. При этом повышается смертность, особенно в случае нарушения иннервации сердца [17, 31].
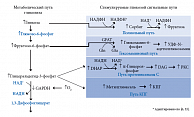
Ключевая роль в патогенезе ДН принадлежит хронической гипергликемии, повреждающее действие которой не сводится к одному механизму или процессу [1, 6, 16]. Гипергликемия является пусковым механизмом каскада биохимических реакций, приводящих к дегенерации и демиелинизации нервного волокна (рис. 1). В условиях гипергликемии активируется каскад патологических путей метаболизма глюкозы. Избыток глюкозы неизбежно направляется по полиоловому пути: накопление сорбитола в нейронах подавляет синтез важнейшего компонента миелина – миоинозитола – и снижает активность Na(+),K(+)-АТФазы; накопление фруктозо-6-фосфата стимулирует гексозаминовый путь; повышение уровня дигидроксиацетонфосфата (DHAP) приводит к продукции глицеральдегид-3-фосфата, глицерол-3-фосфата и других метаболитов, которые активируют путь протеинкиназы С [16, 21, 29].
Эти триозофосфаты также являются предшественниками метилглиоксаля – основного гликирующего вещества, приводящего к образованию конечных продуктов гликирования (КПГ). Внутриклеточная продукция КПГ, изменяя транскрипцию генов, структуру белков внеклеточного матрикса и циркулирующих белков крови, приводит к нарушению функции клеток, воспалению и сосудистым повреждениям. Активация протеинкиназы C приводит к активации ядерного фактора каппа-B, подавляет эндотелиальную синтазу оксида азота, а также ведет к повышению уровня эндотелина-1, трансформирующего фактора роста β и ингибитора активатора плазминогена-1. В результате нарушается кровоток и возникает окклюзия капилляров. Ведущая роль в патогенезе ДН отводится избыточному образованию активных форм кислорода и последующему формированию оксидативого стресса [16, 22].
Клинические проявления ДН возникают, как правило, не ранее чем через 5 лет после манифестации СД 1 типа, а у части пациентов, страдающих СД 2 типа, одновременно с диагностикой заболевания [11, 16, 22]. Несмотря на то что ДН встречается часто и имеет характерные клинические проявления, она обычно плохо диагностируется, особенно на ранних стадиях заболевания, когда своевременный диагноз особенно важен. В исследовании GOAL A1c (Glycemic Optimization with Algorithms and Labs At Po1nt of Care) с участием 7892 больных СД 2 типа продемонстрировано, что правильный диагноз легких или умеренных форм ДН был поставлен лишь одной трети пациентов [13]. Электромиографическое исследование позволяет выявлять ДН у 100% больных СД [16, 22].
ДН имеет чрезвычайно разнообразные клинические проявления в зависимости от поражения проксимальных или дистальных нервных волокон, чувствительных или двигательных нервов, вовлечения в процесс соматического или вегетативного отделов периферической нервной системы [22]. При вовлечении крупных волокон ухудшаются ощущения вибрации, прикосновения (тактильное чувство) и положения. Наоборот, если затронуты тонкие нервные волокна, наблюдаются нарушения болевых и температурных ощущений. В большинстве случаев затронуты все типы волокон.
С морфологических позиций существуют различные формы ДН [16, 22]. Одна из них – демиелинизирующая форма, при которой повреждена миелиновая оболочка нейрона, аксон, тем не менее, остается нетронутым. При таком виде поражения отчетливо снижена сенсорная скорость проведения нервного импульса; поврежденные фрагменты миелиновой оболочки могут регенерировать в процессе деления клеток, поэтому прогноз благоприятен. При аксональной нейропатии, напротив, происходит дегенерация аксонального цилиндра. Это означает, что вследствие нарушения аксоноплазматического транспорта важные структурные элементы не могут больше перемещаться, и дистальные участки нейронов погибают. Вначале скорость проведения нервного импульса не снижается или снижается медленно, но только до тех пор, пока еще не затронута миелиновая оболочка. Прогноз неблагоприятен, так как регенерация аксона может происходить вплоть до самого поражения, и процесс происходит очень медленно.
При идеальных условиях аксон в человеческом нерве за 1 день вырастает примерно на 1 мм [16]. Когда дегенерации подвержено нервное волокно длиной 30 см, на регенерацию необходимо около 1 года. За этот период могут произойти такие тяжелые вторичные изменения, как атрофия мышц и изменения суставов, поэтому исходное состояние уже не может быть достигнуто. В случае ДН речь в основном идет о смешанной форме повреждений нейронов, следовательно, различным бывает и прогноз [16, 22]. В любом случае тяжесть заболевания по мере увеличения его срока прогрессирует и соответственно ухудшается прогноз [11]. По этой причине первостепенное значение имеет ранняя диагностика и своевременное начало лечения [3, 15, 21].
Симптоматика ДН чаще начинается с дистальных отделов нижних конечностей, иннервируемых наиболее длинными волокнами, и затем, по мере вовлечения все более коротких волокон, распространяется в проксимальном направлении [16]. Метаболические изменения преимущественно поражают сенсорные нервные волокна, в результате чего возникают парестезии и боли в конечностях [22]. Кроме того, пациентов беспокоят покалывания, онемение, зябкость стоп или чувство жжения, мышечная слабость. Возможна повышенная реакция на болевой раздражитель (гипералгезия) или прикосновение (гиперестезия), а также восприятие неболевого раздражителя как болевого (аллодиния), например болезненность прикосновения одеяла, простыни. В течение нескольких лет болезненные симптомы появляются преимущественно в покое, в ночное время и, прежде всего, в горизонтальном положении; а затем упомянутые проявления ДН становятся все более постоянными и интенсивными.
Обычно с самого начала заболевания удается выявить нарушения болевой, температурной и/или вибрационной чувствительности; развиваются гипо- и арефлексия, двигательные расстройства. Скорость распространения возбуждения по нервным волокнам у больных СД снижается приблизительно на 0,5 м/с в год. Снижение периферической чувствительности повышает риск развития язвенных дефектов стоп в 7 раз [22]. Из-за снижения или полного отсутствия чувствительности ДН часто протекает бессимптомно и остается незамеченной, однако предрасполагает к микротравматизации и последующему формированию язв нижних конечностей, заживление которых охватывает длительный период времени (примерно 11–14 недель) [4, 11, 13].
Развиваясь примерно у 15% больных диабетом, язвы стоп являются основной причиной госпитализации [3, 22]. В течение года 15% случаев трофического поражения нижних конечностей приводит к ампутации. Одно из самых сильных страданий больных СД, трудно поддающихся терапии, – нейропатическая боль – наблюдается у каждого десятого пациента с СД 1 типа и каждого третьего с СД 2 типа [22, 23, 32]. В целом нейропатический болевой синдром наблюдается у 10% больных СД, у каждого третьего пациента с диабетической дистальной полинейропатией [11, 22]. Часто именно стойкий болевой синдром является основным инвалидизирующим фактором, поскольку ограничивает возможность пациента продолжать трудовую деятельность [3, 11, 32].
Оптимальный контроль гликемии является признанным подходом к предупреждению или замедлению развития ДН [7, 8, 18]. Тем не менее в крупном европейском исследовании у 28% больных СД 1 типа развивалась ДН, вопреки оптимальному гликемическому контролю (HbA1c 6,8 ± 1,9%) [28]. Наши представления о заболевании пополнились знаниями о феномене метаболической памяти, что убедительно свидетельствует не только о срочной необходимости раннего эффективного контроля гликемии, но также о необходимости применения препаратов, снижающих количество внутриклеточных активных форм кислорода и уровень гликирования, с целью уменьшения скорости развития или устранения последствий отдаленных осложнений СД [15]. Ведь если гликемический контроль длительное время был недостаточным, повреждающее действие может сохраняться и в будущем даже после оптимизации уровня глюкозы [8]. Иначе говоря, новые данные о патогенетических механизмах диабетических микрососудистых поражений помимо оптимизации метаболического контроля требуют разработки специальных эффективных методов фармакотерапии.
Кроме того, на практике симптомы ДН нередко остаются резистентными к традиционным терапевтическим воздействиям, поэтому главным залогом их эффективности является системный фармакологический подход [16, 25]. Прочные позиции в комплексном лечении ДН занимают витамины группы В, среди которых в клинической практике наиболее широкое распространение получили препараты тиамина [9, 14, 20, 24]. В целом это обусловлено их полимодальным нейротропным действием, анальгетическим эффектом, а также способностью существенно улучшать регенерацию нервов и, соответственно, замедлять прогрессирование ДН [23, 25, 29, 32]. Однако на практике клинические проявления ДН нередко остаются резистентными к терапии традиционными препаратами тиамина. С фармакологических позиций существует несколько объяснений недостаточному терапевтическому эффекту традиционных препаратов [2, 9].
Тиамин, или витамин В1, участвует в белковом, углеводном и жировом обмене, является коферментом более чем 24 ферментов, наиболее важные из которых пируватдегидрогеназа (утилизация глюкозы в цикле Кребса) и транскетолаза (липидный обмен, метаболизм глюкозы). В физиологических условиях тиамин фосфорилируется до тиаминдифосфата (ТДФ), который является кофактором нескольких ключевых ферментов, участвующих в метаболизме глюкозы [19]. Известно, что тиамин – это водорастворимое соединение, процесс его всасывания в кишечном тракте происходит за счет активного транспорта, возможности которого существенно ограничены. В целом всасывается примерно 10% принятой внутрь дозы (90% тиамина разрушается под действием тиаминазы I и II). Вследствие низкой биодоступности пероральное применение тиамина даже в больших дозах оказывается недостаточно эффективным. Являясь водорастворимой субстанцией, тиамин плохо проникает через мембрану нейронов, в результате его концентрация в тканях очень низкая [1, 2].
Введение в клиническую практику жирорастворимых производных тиамина, прежде всего бенфотиамина, открыло новые перспективы в фармакотерапии ДН [14, 26, 27]. Бенфотиамин имеет фармакологические преимущества по сравнению с водорастворимым тиамином (табл. 1) [9, 19, 26]. Так, в отличие от тиамина, бенфотиамин в 8–10 раз лучше всасывается в желудочно-кишечном тракте, почти 100% дозы переходит в активную форму и легче проникает в нервную ткань [29]. Бенфотиамин устойчив к действию тиаминазы I и II, что создает более высокую концентрацию тиамина в крови, чем традиционные препараты тиамина [2, 10]. Важно, что достаточно высокая концентрация препарата после приема поддерживается в течение более длительного времени. В целом сравнение бенфотиамина с традиционным препаратом тиамина в эквимолярных концентрациях (по 100 мг) показало: биологическая эффективность бенфотиамина была выше в 10 раз [2, 14]. Бенфотиамин повышает также эффективность синтеза АТФ, что ослабляет дегенеративные процессы в нервной ткани и улучшает кровоток в нервных волокнах.
Важно подчеркнуть, что бенфотиамин препятствует активации патогенетических механизмов изменения направления промежуточных продуктов распада глюкозы – фруктозо-6-фосфата и глицеральдегид-3-фосфата – в пентозофосфатный цикл [25, 27, 29]. Это происходит в результате активации транскетолазы – витамин В1-зависимого фермента, активность которого у больных СД снижается [1, 22, 30]. Кофактор транскетолазы – тиамина дифосфат – образуется путем фосфорилирования витамина B1 (рис. 1). Когда транскетолаза полностью активирована своим кофактором, патологические молекулярные механизмы, запускаемые гипергликемией, могут быть переключены на пентозофосфатный путь [29].
Напомним, что транскетолаза является ферментом, лимитирующим скорость реакций восстановительного пентозофосфатного пути, создает обратимую связь между пентозофосфатным путем и гликолизом. Являясь основным источником НАДФ у человека, пентозофосфатный путь поставляет ионы водорода, необходимые для биосинтеза и антиоксидантной активности [1, 29]. В условиях гипергликемии активируются патологические пути метаболизма глюкозы, что приводит к образованию избытка полиолов, гексозаминов, конечных продуктов избыточного гликирования (КПИГ), развитию окислительного стресса и активации протеинкиназы С [1, 6, 16]. Пентозофосфатный шунт может служить обходным путем для отведения глюкозы из этих путей, при этом его работа опосредована активностью тиаминзависимого фермента транскетолазы [1, 22, 29].
Активацию транскетолазы, согласно результатам недавних экспериментальных и клинических исследований, можно рассматривать как самостоятельную стратегию предупреждения микрососудистых осложнений СД, так как при этом избыток метаболитов глюкозы активно переходит в пентозофосфатный путь [27, 29]. Два метаболита гликолиза также являются конечными продуктами пентозофосфатного пути – фруктозо-6-фосфат и глицеральдегид-3-фосфат. Иначе говоря, при высокой концентрации глюкозы ее поток может быть переключен с гликолитического пути на пентозофосфатный путь, однако это возможно лишь при полной активации транскетолазы ее кофактором ТДФ [29].
Бенфотиамин повышает активность транскетолазы до 400% и таким образом устраняет «задержку утилизации» и эффективно блокирует аномальные пути гликолиза [6, 29]. Метаболизм глюкозы может снова нормализоваться [1, 10]. Экспериментальные данные показывают, что бенфотиамин блокирует несколько путей гипергликемического разрушения, то есть гексозаминовый путь, образование КПИГ, активацию протеинкиназы С и активизацию NFkB путем активации транскетолазы, фермента, ограничивающего скорость в неокислительной ветви пентозофосфатного шунта [27, 29]. Более того, он предотвращает микро- и макрососудистую эндотелиальную дисфункцию, вызванную КПИГ [29].
Плацебоконтролируемые исследования у больных с ДН продемонстрировали положительное влияние бенфотиамина на боль и сенсорные симптомы. Так, в исследовании BEDIP (BEnfotiamin in the treatment of Diabetic Polyneuropathy) у 40 больных, страдающих ДН, по сравнению с плацебо достоверно снизилась оценка по шкале TSS (Total Symptom Score) и выраженность боли по Katzenwadel после трех недель лечения бенфотиамином по 400 мг в сутки [12]. Наиболее выраженное влияние препарат оказал на боль (p = 0,0414). Субъективное улучшение также чаще отмечали пациенты, получавшие бенфотиамин (p = 0,052). Проведенное после этого исследование BENDIP (BENfotiamine in DIabetic Polineuropathy) продемонстрировало положительный эффект шестинедельной терапии бенфотиамином (600 мг/день) на оценку по шкале невропатии NSS (Neuropathy Symptom Score) [26]. В исследовании приняли участие 165 пациентов с симметричной дистальной ДН, которых разделили на 3 группы: 1-я группа принимала 600 мг бенфотиамина в день, 2-я – 300 мг, пациенты 3-й группы – плацебо.
Позитивная невропатическая симптоматика (жалобы больных на боль, жжение, онемение и др.) в почти одинаковой мере уменьшались при использовании доз 300 и 600 мг бенфотиамина. Значительное уменьшение неврологических симптомов ДН (сила мышц, рефлексы, чувствительность) на 6-й неделе по сравнению с исходным уровнем наблюдалось в группе больных СД, получавших 300 и 600 мг бенфотиамина, достоверно отличаясь от группы плацебо. Улучшение было более выражено в группе пациентов, принимавших бенфотиамин в более высокой дозе (600 мг), и нарастало с продолжительностью лечения (p < 0,033). Спустя 6 недель непрерывной терапии параметры шкалы NSS значимо отличались между группами с различными режимами приема (р = 0,033). Наилучшие результаты по шкале TSS были получены для симптома «боль». Терапия одинаково хорошо переносилась во всех группах.
Следует подчеркнуть, что в обоих исследованиях эти эффекты были достигнуты без значительных изменений уровня HbA1c и содержания глюкозы в крови. Иначе говоря, с практических позиций важно, что бенфотиамин влияет на нарушенный метаболизм даже в условиях гипергликемии. Этот вывод особенно важен, поскольку дает возможность практическим врачам применять бенфотиамин как на стадии компенсации углеводного обмена, так и когда СД не компенсирован. Учитывая широкий спектр сопутствующих заболеваний у большинства пациентов с диабетом и необходимость длительного лечения, особенно важным преимуществом бенфотиамина, отмеченным в клинических исследованиях, является его хорошая переносимость и низкая частота нежелательных явлений [12, 23, 26]. В исследовании BENDIP, как и в других, оптимальное действие бенфотиамина наблюдалось в отношении невропатической боли, которая относится к числу наиболее беспокоящих пациентов симптомов [11, 22, 32].
Следует подчеркнуть, что для клиницистов, использующих в своей практике препараты, содержащие бенфотиамин, важным аспектом является отсутствие сообщений о каком-либо взаимодействии препарата с другими лекарственными средствами [16, 23, 25]. Кроме того, в литературе нет указаний на возможность токсического действия больших доз бенфотиамина (до 600 мг) [16, 25, 30]. Бенфотиамин оптимально использовать в комбинации с другим нейротропным фактором – пиридоксином, с которым он действует в синергизме [23, 25]. Одним из наиболее широко применяемых препаратов, содержащих бенфотиамин и пиридоксин в терапевтических дозах (по 100 мг), является Мильгамма® композитум (Вёрваг Фарма, Германия).
Пиридоксин (витамин B6) является кофактором более чем для 100 ферментов. Благодаря способности регулировать метаболизм аминокислот пиридоксин влияет на структурно-функциональное состояние нервной ткани, обеспечивает синаптическую передачу за счет участия в синтезе ключевых нейромедиаторов [19, 25]. Активируя синтез транспортных белков в осевых цилиндрах нервных волокон, витамин B6 способствует ускорению регенерации периферических нервов, тем самым проявляя нейротропный эффект. Пиридоксин также играет ведущую роль в продукции норадреналина и серотонина – нейромедиаторов, задействованных в антиноцицептивной системе. Кроме того, пиридоксин увеличивает внутриклеточные запасы магния, играющего важную роль в метаболических процессах и в деятельности нервной системы [19]. Установлено, что помимо повышения скорости проведения нервного импульса бенфотиамин и пиридоксин при сочетанном применении оказывают антиноцицептивное действие. Возможной точкой приложения действия этой комбинации являются непосредственно болевые рецепторы [19].
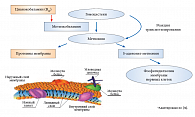
Частично этот эффект может быть опосредован модуляцией метаболизма серотонина и ГАМК. Показано, что дефицит ТДФ и пиридоксина может проявляться симптомами воспаления, способствующими сенсибилизации болевых рецепторов с формированием воспалительной гипералгезии. При лечении ДН используют и анаболические эффекты необходимого для синтеза миелиновой оболочки цианокобаламина (B12), входящего в состав инъекционной формы препарата Мильгамма®, среди которых наиболее значима способность восстанавливать структуру миелиновой оболочки и уменьшать нейрогенные боли [24]. Кроме того, цианокобаламин ускоряет регенерацию нервов, активируя синтез липопротеинов, необходимых для построения клеточных мембран и миелиновой оболочки (рис. 2).
Немаловажной представляется способность витаминов группы В предупреждать активацию ядерного фактора каппа-В в клетках больных СД 2 типа. Наконец, снижение активности альдозоредуктазы, предупреждение накопления сорбитола и глюкозы в клетках сосудистой стенки предупреждает развитие эндотелиальной дисфункции [14, 25, 27]. Результаты клинических исследований показывают, что применение препарата Мильгамма® композитум приводит к ослаблению боли через 2–3 недели после начала лечения, что сопровождается увеличением скорости проведения по нервным волокнам [23]. Этот аспект терапии крайне важен, поскольку регресс боли позволяет ожидать большей приверженности больных СД рекомендованной терапии. Согласно данным двойного слепого плацебоконтролируемого исследования, парентеральное применение препарата у больных ДН приводит к увеличению скорости проведения по малоберцовому нерву и улучшению вибрационной чувствительности; эффект стойко сохраняется на протяжении не менее 9 месяцев [26].
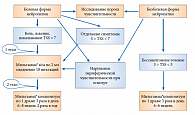
Тактика лечения больных СД зависит от стадии ДН, наличия болевого синдрома. Так, при субклинической стадии целесообразно назначение пероральной формы – Мильгамма® композитум по 1 драже 3 раза в сутки на протяжении 6–8 недель. Повторные курсы лечения можно рекомендовать через 6–9 месяцев. Именно на обратимой стадии ДН применение препарата Мильгамма® композитум наиболее эффективно. При ДН с выраженными функциональными изменениями рекомендуется начать терапию с инъекционной формы препарата Мильгамма® (по 2,0 мл внутримышечно) в течение 10 дней с последующим переходом на пероральный прием Мильгаммы® композитум по 1 драже 3 раза в сутки в течение 6–8 недель. Алгоритм лечения болевой и безболевой форм ДН (критерием оценки ДН служит шкала TSS) представлен на рисунке 3.
Дополнительным доводом в пользу применения препарата при СД являются результаты нескольких исследований, продемонстрировавших при приеме препарата Мильгамма® композитум улучшение состояния не только периферических нервов, но также других тканей, чувствительных к избытку гипергликемии, – в сосудах сетчатки глаз, мезангиальных клетках почек [18, 20, 27]. В силу этого применение препарата Мильгамма® композитум показано больным СД с сочетанием ДН и микрососудистых осложнений (диабетическая ретинопатия и нефропатия). Следует считать обоснованным назначение препаратов, содержащих бенфотиамин (Мильгамма® композитум), больным СД как средства для предотвращения развития поздних осложнений [21, 29, 30].
Возможна комбинация Мильгаммы® композитум и препаратов aльфа-липоевой кислоты, поскольку они обладают синергизмом действия. При резко выраженном болевом синдроме при ДН требуется симптоматическое лечение: общепринято применение антидепрессантов и противосудорожных препаратов. Важно помнить, что оптимальная эффективность патогенетического лечения ДН наблюдается на фоне достижения целевых показателей гликемии.
В заключение хотелось бы отметить, что в реальной клинической практике полноценной терапией диабетической нейропатии является включение препаратов, обрывающих механизмы формирования «гипергликемической» или метаболической памяти. Именно для этого предназначены нейротропные комплексы Мильгамма® композитум, Мильгамма®. Сочетание нейрометаболического и анальгезирующего эффектов инъекционной и пероральной формы препаратов позволяет значительно улучшить показатели периферической чувствительности и качество жизни пациентов с диабетической нейропатией.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.