количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Оптимизация лечения сахарного диабета 2 типа: комбинированная терапия фиксированной дозой амарила® и метформина (Амарил® М)
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №2
- Аннотация
- Статья
- Ссылки
Приводятся новейшие рекомендации экспертов Российской ассоциации эндокринологов.
Представлены данные, свидетельствующие о перспективности комбинированного препарата Амарил® М (глимепирид + метформин в фиксированной дозе) для достижения компенсации СД 2 типа.
Обосновывается преимущество назначения комбинированной терапии препаратами сульфонилмочевины и метформина при патогенетической терапии сахарного диабета 2 типа.
Приводятся новейшие рекомендации экспертов Российской ассоциации эндокринологов.
Представлены данные, свидетельствующие о перспективности комбинированного препарата Амарил® М (глимепирид + метформин в фиксированной дозе) для достижения компенсации СД 2 типа.
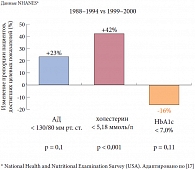
Рис. 1. Гликемический контроль ухудшился по сравнению с другими факторами сосудистого риска

Таблица 1. Влияние пероральных сахароснижающих препаратов на механизмы патогенеза СД 2 типа
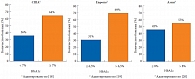
Рис. 2. Большинство больных СД 2 типа в мире не достигают целевых показателей HbA1c
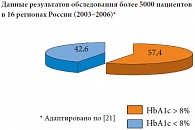
Рис. 3. Большинство больных СД 2 типа в РФ не достигают целевых показателей HbA1c (4
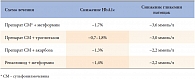
Таблица 2. Сравнительный анализ эффективности комбинированной пероральной сахароснижающей терапии СД 2 типа
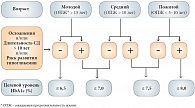
Рис. 4. Индивидуализированный выбор целевого уровня HbA1c в зависимости от возраста (ожидаемой продолжительности жизни), осложнений, длительности СД, риска гипогликемии Достоинством комбинированной терапии является простота подбора и процесса титровани

Рис. 5. Консенсус по инициации и интенсификации лечения СД 2 типа до начала инсулинотерапии при уровне HbA1c от 6,5 до 7,5%
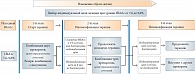
Рис. 6. Консенсус по инициации и интенсификации лечения СД 2 типа до начала инсулинотерапии при уровне HbA1c от 7,6 до 9,0%
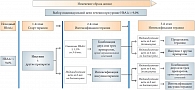
Рис. 7. Консенсус по инициации и интенсификации лечения СД 2 типа до начала инсулинотерапии при уровне HbA1c более 9,0%
Наконец, в феврале 2011 г. опубликован проект РАЭ «Консенсус экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии сахарного диабета 2 типа». Столь бурный интерес после длительного «застоя» к проблеме терапии СД 2 типа обусловлен прогрессирующим течением заболевания и ухудшением контроля гликемии относительно успехов в контроле таких факторов сосудистого риска, как артериальная гипертензия и гиперхолестеринемия (рис. 1). Если к 2000 г. (по сравнению с периодом 1988–1994 гг.) доля лиц, добившихся целевых показателей артериального давления и концентрации холестерина в крови, увеличилась на 23% и 42% соответственно, то число лиц с показателем уровня HbA1c менее 7% уменьшилось на 16%.
Практически две трети пациентов с СД 2 типа как в США и Европе, так и в РФ не достигают целевого уровня HbA1c (рис. 2 и 3). В связи с этим возникает необходимость интенсифицирования сахароснижающей терапии, однако сдерживающим барьером является гипогликемия, особенно опасная в ночное время. Изучение взаимосвязи между уровнем гликемии и смертностью, распределенной по степени выраженности тромболизиса при инфаркте миокарда, показывает: при гликемии менее 4,5 ммоль/л максимальный риск смерти наблюдается через 30 дней [13].
Исходя из этого, терапия сахарного диабета 2 типа должна осуществляться с постоянной оглядкой на предупреждение гипогликемии. Монотерапия одним из пероральных сахароснижающих препаратов (ПССП) имеет положительные результаты лишь непродолжительное время и обычно эффективна первые 5–6 лет заболевания. В дальнейшем возникает необходимость использовать комбинацию двух и более препаратов с различным механизмом действия. Так, результаты исследования UKPDS (UK Prospective Diabetes Study) показали, что через 3 года от начала лечения только у 50% больных на фоне терапии диетой и монотерапии ПССП достигается уровень HbA1c менее 7%, а спустя 9 лет только 25% достигают этой цели [9]. Таким образом, большинство пероральных препаратов не способно воздействовать на оба звена патогенеза развития сахарного диабета 2 типа (табл. 1), а значит, для достижения компенсации СД 2 типа через несколько лет после начала лечения необходимо назначать комбинированную терапию.
В клинической практике применяются комбинации из препаратов разных групп, дополняющих друг друга по механизму действия. Патофизиологический подход к лечению СД 2 типа предполагает воздействие на оба дефекта в патогенезе заболевания, то есть на секреторный дефект β-клетки и периферическую чувствительность тканей, в особенности – печени, к инсулину. Третье звено патогенеза СД 2 (снижение продукции глюкозы печенью) (табл. 1) на самом деле является следствием инсулинорезистентности. Очевидно, для эффективного влияния на оба звена патогенеза сахарного диабета 2 типа необходима комбинированная терапия как минимум двумя препаратами с разными мишенями воздействия. По данным ряда международных исследований, наиболее эффективна комбинация препаратов сульфонилмочевины с метформином (табл. 2).
Механизм действия препаратов сульфонилмочевины (ПСМ) основан на их способности стимулировать образование и секрецию эндогенного инсулина β-клетками поджелудочной железы, особенно в присутствии глюкозы [3, 6, 9]. Известно, что ПСМ характеризуются различной силой стимулирующего влияния на секрецию инсулина, что обусловлено особенностями связывания с рецепторами β-клеток (АТФ-зависимыми калиевыми каналами) за счет разной химической структуры молекулы. При едином механизме действия каждый из препаратов сульфонилмочевины имеет особенности фармококинетики и фармакодинамики и ряд дополнительных фармакологических свойств, которые необходимо учитывать, проводя лечение больных с СД 2 типа [5, 9]. Так, глимепирид (Амарил) причисляется экспертами к сульфонилмочевине третьей генерации.
Отличительными особенностями фармакодинамики глимепирида является его связывание с субъединицей SU-рецептора, молекулярная масса которого 65 кДа, тогда как другие производные сульфонилмочевины связываются в основном с субъединицей массой 140 кДа, что предопределяет особенности его действия, а именно – бережное воздействие на инсулиносекрецию. Амарил в 2,5–3 раза быстрее связывается с SU-рецепторами β-клеток и в 8–9 раз быстрее отщепляется от них, чем глибенкламид. Это приводит к более быстрому началу и к меньшей продолжительности действия глимепирида. Периферическое действие ПСМ имеет вторичную природу. Это действие обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает улучшение утилизации глюкозы тканями и угнетение продукции глюкозы печенью. ПСМ связываются со специфическими белками-рецепторами на клеточной мембране β-клеток и стимулируют секрецию инсулина путем закрытия калиевых каналов и, как следствие, открытия кальциевых каналов. В дальнейшем значительно увеличивается приток кальция внутрь β-клеток, в которых его накопление запускает секрецию инсулина.
Наиболее выраженным и значительным дефектом при сахарном диабете 2 типа является резкое снижение, а то и выпадение ранней (первой) фазы секреции инсулина. При выработке терапевтической тактики постоянно следует об этом помнить и правильно подбирать лекарственные средства. Исследования свидетельствуют о достоверном улучшении I фазы секреции инсулина под влиянием Амарила, а также показывают положительное влияние препарата и на II фазу секреции. Тем самым у больных эффективно контролируется постпрандиальная гликемия и снижается риск поздних гипогликемических состояний [7, 11].
Хотя положительные эффекты Амарила широко известны практикующим врачам, следует еще раз отметить его экспериментально и клинически доказанный кардиопротективный эффект.
С одной стороны, кардиопротективный эффект глимепирида обусловлен его избирательным влиянием на АТФ-зависимые калиевые каналы, с другой стороны – влиянием на сосудистый эндотелий и стимуляцией высвобождения оксида азота, являющегося мощным вазодилататором [8]. В отличие от глибенкламида, при применении глимепирида в дозе от 0,5 мг до 4 мг наряду с улучшением гликемического профиля наблюдается статистически достоверное (p < 0,001) снижение веса на 3 кг и индекса массы тела (ИМТ) на 0,71 ± 1,38 кг/м2 [12, 16].
Учитывая сложные патофизиологические механизмы развития СД 2 типа, эффективного, долгосрочного контроля гликемии можно достигнуть с помощью препаратов, которые воздействуют на фундаментальные патофизиологические нарушения, присущие этому заболеванию [3, 13]. В этой связи важнейшим этапом на пути совершенствования стратегии фармакотерапии СД 2 типа стало создание фиксированных комбинаций сахароснижающих препаратов, значительно улучшающих приверженность пациентов терапии.
В целом комбинированная сахароснижающая терапия имеет ряд неоспоримых преимуществ. Во-первых, спектр действия комбинированных лекарств охватывает различные патофизиологические механизмы СД 2 типа, и происходит взаимное потенцирование эффектов составляющих препаратов. Во-вторых, использование каждого компонента препарата в более низких суточных дозах в сравнении с монотерапией приводит к уменьшению частоты нежелательных эффектов и закономерному улучшению переносимости лечения пациентом. Еще одним достоинством комбинированной терапии является простота назначения и процесса титрования дозы для пациента и врача, что также повышает приверженность пациентов к фармакотерапии.
Несоблюдение пациентом рекомендаций врача – одна из основных причин неуспешного лечения любого хронического заболевания, в том числе и СД 2 типа. Действительно, одновременный прием нескольких лекарственных препаратов все шире признается препятствием эффективного лечения [4]. Результаты многочисленных исследований показывают: только около трети больных СД 2 типа в достаточной степени соблюдают рекомендованную терапию [13]. Следовательно, упрощение схемы фармакотерапии СД является одной из эффективных стратегий лечения заболевания. Итак, целесообразность комбинации сульфонилмочевины не подлежит сомнению, поскольку важнейшим патогенетическим звеном СД 2 типа является секреторный дефект β-клетки. В то же время и инсулинорезистентность (ИР) – постоянный признак СД 2 типа, а значит, необходимо применение метформина.
Метформин – единственный ПССП, который, как показано в исследовании UKPDS, снижает риск развития неблагоприятных сердечно-сосудистых осложнений [15]. Кроме того, метформин рекомендован Международной федерацией диабета (IDF) как препарат первого выбора при лечении больных СД 2 типа. Антигипергликемические эффекты метформина – это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой тканей [1, 10]. Хотя преобладающим является влияние метформина на продукцию глюкозы печенью, именно комбинация его эффектов на уровне всех трех тканей, по-видимому, обусловливает благоприятный фармакологический профиль препарата. В ряде плацебоконтролируемых исследований продемонстрировано, что инсулинозависимое поглощение глюкозы под влиянием метформина повышается на 20–30%. Кроме того, метформин способствует увеличению утилизации глюкозы слизистой кишечника, приводя к снижению концентрации глюкозы в системе портальной вены.
Исследования in vivo и in vitro показали: этот механизм действия метформина связан с подавлением процессов глюконеогенеза и в меньшей степени гликогенолиза, что приводит к снижению на 25–30% уровня гликемии натощак [10]. Благодаря метформину происходит подавление глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол, и некоторых аминокислот. Метформин также препятствует глюконеогенетическому действию глюкагона. Наряду с этим, возрастает утилизация глюкозы скелетными мышцами и жировой тканью, как следствие повышается чувствительность тканей к инсулину на 18–50%. Подавляющее большинство больных СД 2 типа имеют избыточную массу тела, поэтому первоочередной задачей лечения является снижение и поддержание нормальной массы тела. После лечения метформином у тучных пациентов с СД 2 типа часто наблюдается уменьшение веса тела или отсутствует его увеличение.
Лечение метформином сопровождается снижением концентрации триглицеридов на 10–20% и как следствие – снижением печеночного синтеза и повышением клиренса ЛПОНП. Уменьшение поступления свободных жирных кислот (СЖК) к печени, синтеза триглицеридов и повышение чувствительности к инсулину влечет уменьшение отложения жира в этом органе. Кроме того, уменьшение концентрации и окисления СЖК способствует улучшению профиля действия эндогенного инсулина, что имеет место на фоне терапии метформином больных СД 2 типа. Снижая уровень СЖК, метформин улучшает не только чувствительность тканей к инсулину, но и секрецию инсулина, а также демонстрирует протективные эффекты в отношении липо- и глюкозотоксичности. Кроме того, метформин способствует увеличению концентрации ЛПВП, уменьшает концентрацию хиломикронов и их остатков в постпрандиальный период.
Наряду с хорошо известным антигипергликемическим действием, метформин обладает целым рядом кардиопротективных эффектов. Так, метформин положительно влияет на систему гемостаза и реологию крови, способен не только тормозить агрегацию тромбоцитов, но и снижать риск образования тромбов [9]. Кроме того, метформин характеризуется антиоксидантной активностью, обусловленной торможением клеточных окислительных реакций, в том числе и окислительного гликозилирования белков [10]. По мнению исследователей [2], комбинированная терапия метформином и препаратами сульфонилмочевины так же эффективна, как комбинированная терапия инсулином и препаратами сульфонилмочевины или монотерапия инсулином у пациентов с плохим эффектом от предшествовавшей терапии. Это хорошо видно из анализа результатов перекрестного исследования 50 больных СД 2 типа со вторичной резистентностью к препаратам сульфонилмочевины [14], которые были разделены на 2 группы.
Практически две трети пациентов с СД 2 типа как в США и Европе, так и в РФ не достигают целевого уровня HbA1c (рис. 2 и 3). В связи с этим возникает необходимость интенсифицирования сахароснижающей терапии, однако сдерживающим барьером является гипогликемия, особенно опасная в ночное время. Изучение взаимосвязи между уровнем гликемии и смертностью, распределенной по степени выраженности тромболизиса при инфаркте миокарда, показывает: при гликемии менее 4,5 ммоль/л максимальный риск смерти наблюдается через 30 дней [13].
Исходя из этого, терапия сахарного диабета 2 типа должна осуществляться с постоянной оглядкой на предупреждение гипогликемии. Монотерапия одним из пероральных сахароснижающих препаратов (ПССП) имеет положительные результаты лишь непродолжительное время и обычно эффективна первые 5–6 лет заболевания. В дальнейшем возникает необходимость использовать комбинацию двух и более препаратов с различным механизмом действия. Так, результаты исследования UKPDS (UK Prospective Diabetes Study) показали, что через 3 года от начала лечения только у 50% больных на фоне терапии диетой и монотерапии ПССП достигается уровень HbA1c менее 7%, а спустя 9 лет только 25% достигают этой цели [9]. Таким образом, большинство пероральных препаратов не способно воздействовать на оба звена патогенеза развития сахарного диабета 2 типа (табл. 1), а значит, для достижения компенсации СД 2 типа через несколько лет после начала лечения необходимо назначать комбинированную терапию.
В клинической практике применяются комбинации из препаратов разных групп, дополняющих друг друга по механизму действия. Патофизиологический подход к лечению СД 2 типа предполагает воздействие на оба дефекта в патогенезе заболевания, то есть на секреторный дефект β-клетки и периферическую чувствительность тканей, в особенности – печени, к инсулину. Третье звено патогенеза СД 2 (снижение продукции глюкозы печенью) (табл. 1) на самом деле является следствием инсулинорезистентности. Очевидно, для эффективного влияния на оба звена патогенеза сахарного диабета 2 типа необходима комбинированная терапия как минимум двумя препаратами с разными мишенями воздействия. По данным ряда международных исследований, наиболее эффективна комбинация препаратов сульфонилмочевины с метформином (табл. 2).
Механизм действия препаратов сульфонилмочевины (ПСМ) основан на их способности стимулировать образование и секрецию эндогенного инсулина β-клетками поджелудочной железы, особенно в присутствии глюкозы [3, 6, 9]. Известно, что ПСМ характеризуются различной силой стимулирующего влияния на секрецию инсулина, что обусловлено особенностями связывания с рецепторами β-клеток (АТФ-зависимыми калиевыми каналами) за счет разной химической структуры молекулы. При едином механизме действия каждый из препаратов сульфонилмочевины имеет особенности фармококинетики и фармакодинамики и ряд дополнительных фармакологических свойств, которые необходимо учитывать, проводя лечение больных с СД 2 типа [5, 9]. Так, глимепирид (Амарил) причисляется экспертами к сульфонилмочевине третьей генерации.
Отличительными особенностями фармакодинамики глимепирида является его связывание с субъединицей SU-рецептора, молекулярная масса которого 65 кДа, тогда как другие производные сульфонилмочевины связываются в основном с субъединицей массой 140 кДа, что предопределяет особенности его действия, а именно – бережное воздействие на инсулиносекрецию. Амарил в 2,5–3 раза быстрее связывается с SU-рецепторами β-клеток и в 8–9 раз быстрее отщепляется от них, чем глибенкламид. Это приводит к более быстрому началу и к меньшей продолжительности действия глимепирида. Периферическое действие ПСМ имеет вторичную природу. Это действие обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает улучшение утилизации глюкозы тканями и угнетение продукции глюкозы печенью. ПСМ связываются со специфическими белками-рецепторами на клеточной мембране β-клеток и стимулируют секрецию инсулина путем закрытия калиевых каналов и, как следствие, открытия кальциевых каналов. В дальнейшем значительно увеличивается приток кальция внутрь β-клеток, в которых его накопление запускает секрецию инсулина.
Наиболее выраженным и значительным дефектом при сахарном диабете 2 типа является резкое снижение, а то и выпадение ранней (первой) фазы секреции инсулина. При выработке терапевтической тактики постоянно следует об этом помнить и правильно подбирать лекарственные средства. Исследования свидетельствуют о достоверном улучшении I фазы секреции инсулина под влиянием Амарила, а также показывают положительное влияние препарата и на II фазу секреции. Тем самым у больных эффективно контролируется постпрандиальная гликемия и снижается риск поздних гипогликемических состояний [7, 11].
Хотя положительные эффекты Амарила широко известны практикующим врачам, следует еще раз отметить его экспериментально и клинически доказанный кардиопротективный эффект.
С одной стороны, кардиопротективный эффект глимепирида обусловлен его избирательным влиянием на АТФ-зависимые калиевые каналы, с другой стороны – влиянием на сосудистый эндотелий и стимуляцией высвобождения оксида азота, являющегося мощным вазодилататором [8]. В отличие от глибенкламида, при применении глимепирида в дозе от 0,5 мг до 4 мг наряду с улучшением гликемического профиля наблюдается статистически достоверное (p < 0,001) снижение веса на 3 кг и индекса массы тела (ИМТ) на 0,71 ± 1,38 кг/м2 [12, 16].
Учитывая сложные патофизиологические механизмы развития СД 2 типа, эффективного, долгосрочного контроля гликемии можно достигнуть с помощью препаратов, которые воздействуют на фундаментальные патофизиологические нарушения, присущие этому заболеванию [3, 13]. В этой связи важнейшим этапом на пути совершенствования стратегии фармакотерапии СД 2 типа стало создание фиксированных комбинаций сахароснижающих препаратов, значительно улучшающих приверженность пациентов терапии.
В целом комбинированная сахароснижающая терапия имеет ряд неоспоримых преимуществ. Во-первых, спектр действия комбинированных лекарств охватывает различные патофизиологические механизмы СД 2 типа, и происходит взаимное потенцирование эффектов составляющих препаратов. Во-вторых, использование каждого компонента препарата в более низких суточных дозах в сравнении с монотерапией приводит к уменьшению частоты нежелательных эффектов и закономерному улучшению переносимости лечения пациентом. Еще одним достоинством комбинированной терапии является простота назначения и процесса титрования дозы для пациента и врача, что также повышает приверженность пациентов к фармакотерапии.
Несоблюдение пациентом рекомендаций врача – одна из основных причин неуспешного лечения любого хронического заболевания, в том числе и СД 2 типа. Действительно, одновременный прием нескольких лекарственных препаратов все шире признается препятствием эффективного лечения [4]. Результаты многочисленных исследований показывают: только около трети больных СД 2 типа в достаточной степени соблюдают рекомендованную терапию [13]. Следовательно, упрощение схемы фармакотерапии СД является одной из эффективных стратегий лечения заболевания. Итак, целесообразность комбинации сульфонилмочевины не подлежит сомнению, поскольку важнейшим патогенетическим звеном СД 2 типа является секреторный дефект β-клетки. В то же время и инсулинорезистентность (ИР) – постоянный признак СД 2 типа, а значит, необходимо применение метформина.
Метформин – единственный ПССП, который, как показано в исследовании UKPDS, снижает риск развития неблагоприятных сердечно-сосудистых осложнений [15]. Кроме того, метформин рекомендован Международной федерацией диабета (IDF) как препарат первого выбора при лечении больных СД 2 типа. Антигипергликемические эффекты метформина – это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой тканей [1, 10]. Хотя преобладающим является влияние метформина на продукцию глюкозы печенью, именно комбинация его эффектов на уровне всех трех тканей, по-видимому, обусловливает благоприятный фармакологический профиль препарата. В ряде плацебоконтролируемых исследований продемонстрировано, что инсулинозависимое поглощение глюкозы под влиянием метформина повышается на 20–30%. Кроме того, метформин способствует увеличению утилизации глюкозы слизистой кишечника, приводя к снижению концентрации глюкозы в системе портальной вены.
Исследования in vivo и in vitro показали: этот механизм действия метформина связан с подавлением процессов глюконеогенеза и в меньшей степени гликогенолиза, что приводит к снижению на 25–30% уровня гликемии натощак [10]. Благодаря метформину происходит подавление глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол, и некоторых аминокислот. Метформин также препятствует глюконеогенетическому действию глюкагона. Наряду с этим, возрастает утилизация глюкозы скелетными мышцами и жировой тканью, как следствие повышается чувствительность тканей к инсулину на 18–50%. Подавляющее большинство больных СД 2 типа имеют избыточную массу тела, поэтому первоочередной задачей лечения является снижение и поддержание нормальной массы тела. После лечения метформином у тучных пациентов с СД 2 типа часто наблюдается уменьшение веса тела или отсутствует его увеличение.
Лечение метформином сопровождается снижением концентрации триглицеридов на 10–20% и как следствие – снижением печеночного синтеза и повышением клиренса ЛПОНП. Уменьшение поступления свободных жирных кислот (СЖК) к печени, синтеза триглицеридов и повышение чувствительности к инсулину влечет уменьшение отложения жира в этом органе. Кроме того, уменьшение концентрации и окисления СЖК способствует улучшению профиля действия эндогенного инсулина, что имеет место на фоне терапии метформином больных СД 2 типа. Снижая уровень СЖК, метформин улучшает не только чувствительность тканей к инсулину, но и секрецию инсулина, а также демонстрирует протективные эффекты в отношении липо- и глюкозотоксичности. Кроме того, метформин способствует увеличению концентрации ЛПВП, уменьшает концентрацию хиломикронов и их остатков в постпрандиальный период.
Наряду с хорошо известным антигипергликемическим действием, метформин обладает целым рядом кардиопротективных эффектов. Так, метформин положительно влияет на систему гемостаза и реологию крови, способен не только тормозить агрегацию тромбоцитов, но и снижать риск образования тромбов [9]. Кроме того, метформин характеризуется антиоксидантной активностью, обусловленной торможением клеточных окислительных реакций, в том числе и окислительного гликозилирования белков [10]. По мнению исследователей [2], комбинированная терапия метформином и препаратами сульфонилмочевины так же эффективна, как комбинированная терапия инсулином и препаратами сульфонилмочевины или монотерапия инсулином у пациентов с плохим эффектом от предшествовавшей терапии. Это хорошо видно из анализа результатов перекрестного исследования 50 больных СД 2 типа со вторичной резистентностью к препаратам сульфонилмочевины [14], которые были разделены на 2 группы.
Пациентам первой группы дополнительно был назначен метформин три раза в день, а больным второй группы – вечернее введение инсулина NPH. При проведении сравнительной оценки эффективности и переносимости терапии констатировано одинаковое улучшение показателей гликемии при обоих вариантах комбинации. Подтверждение того, что комбинированная терапия сульфонилмочевиной и метформином имеет существенные преимущества перед монотерапией, способствовало созданию официальной формы препарата, содержащего оба компонента. Таким комбинированным препаратом является Амарил М, обеспечивающий патогенетический подход к лечению сахарного диабета 2 типа. Амарил М представляет собой сбалансированную комбинацию метформина 500 мг и глимепирида 2 мг в одной таблетке.
При назначении сахароснижающей терапии в первую очередь надо осуществить необходимый выбор целевого уровня HbA1с. Согласно проекту алгоритма сахароснижающей терапии сахарного диабета 2 типа, предложенному Российской ассоциацией эндокринологов в октябре 2010 г., при определении целевого уровня HbA1c необходимо учитывать ожидаемую продолжительность жизни, наличие осложнений или длительность заболевания. При этом подходе целевой индивидуальный показатель HbA1с может варьировать от 6,5% до 7,5% (рис. 4). В основе данного алгоритма стартовой терапии лежит уровень HbA1с и, как видно из рисунков 5 и 6, комбинация двух пероральных препаратов показана на ранних этапах лечения СД 2 типа. При уровне HbA1c от 6,5% до 7,5% стартовую терапию рекомендуют начинать с монотерапии и, если индивидуальный целевой показатель не достигается на первом этапе, приступают к комбинации двух препаратов.
При назначении сахароснижающей терапии в первую очередь надо осуществить необходимый выбор целевого уровня HbA1с. Согласно проекту алгоритма сахароснижающей терапии сахарного диабета 2 типа, предложенному Российской ассоциацией эндокринологов в октябре 2010 г., при определении целевого уровня HbA1c необходимо учитывать ожидаемую продолжительность жизни, наличие осложнений или длительность заболевания. При этом подходе целевой индивидуальный показатель HbA1с может варьировать от 6,5% до 7,5% (рис. 4). В основе данного алгоритма стартовой терапии лежит уровень HbA1с и, как видно из рисунков 5 и 6, комбинация двух пероральных препаратов показана на ранних этапах лечения СД 2 типа. При уровне HbA1c от 6,5% до 7,5% стартовую терапию рекомендуют начинать с монотерапии и, если индивидуальный целевой показатель не достигается на первом этапе, приступают к комбинации двух препаратов.
Примечательно, что при показателе гликированного гемоглобина на старте терапии в пределах 7,6–9% следует начинать лечение сразу с комбинации сахароснижающих препаратов. Основываясь на рекомендациях экспертов РАЭ, можно говорить о том, что комбинация Амарила с метформином в фиксированной дозе открывает хорошие перспективы достижения компенсации сахарного диабета 2 типа. На рис. 7 представлен алгоритм стартовой терапии СД 2 типа при уровне HbA1c более 9%. В подобных случаях рекомендуется начинать терапию с инсулина с возможной комбинацией другими пероральными препаратами. Данный алгоритм не исключает временный характер инсулинотерапии, и после успешного снятия глюкозотоксичности можно начинать лечение пероральными препаратами, целесообразно в виде их комбинации.
1. Bailey C.J., Turner R.C. Metformin // N. Engl. J. Med. Vol. 334. 1996. № 9. P. 574–579.
2. Clark C.M. Jr. Oral therapy in type 2 diabetes: pharmacological properties and clinical use of currently available agents // Diabetes spectrum. Vol. 11. 1998. № 4. P. 211–221.
3. DeFronzo R.A. Pharmacologic therapy for type 2 diabetes mellitus // Ann. Intern. Med. Vol. 131. 1999. № 4. P. 281–303.
4. Donnan P.T., MacDonald T.M., Morris A.D. Adherence to prescribed oral hypoglycaemic medication in a population of patients with type 2 diabetes: a retrospective cohort study // Diabetic Med. Vol. 19. 2002. № 4. P. 279–284.
5. Drouin P., the Diamicron®MR Study Group. Diamicron®MR once daily is effective and well tolerated in type 2 diabetes: a double-blind, randomized, multinational study // J. Diabetes Complications. Vol. 14. 2000. № 4. P. 185–191.
6. Gregorio F., Ambrosi F., Manfrini S., Velussi M., Carle F., Testa R., Merante D., Filipponi P. Poorly controlled elderly type 2 diabetic patients: the sulphonylurea dosages or adding metformin // Diabetic Med. Vol. 16. 1999. № 12. P. 1016–1024.
7. Gregorio F., Ambrosi F., Cristallini S., Filipponi P., Santeusanio F. Effects of glimepiride on insulin and glucagon release from isolated rat pancreas at different glucose concentrations //Acta Diabetol. Vol. 33. 1996. № 1. P. 25–29.
8. Jojima T., Suzuki K., Hirama N., Uchida K., Hattori Y. Glimepiride upregulates eNOS activity and inhibits cytokine-induced NF-κB activation through a phosphoinoside 3-kinase –Akt-dependent pathway // Diabetes Obes. Metab. Vol. 11. 2009. № 2. P. 143–149.
9. Kimmel B., Inzucchi S.M. Oral agents for type 2 diabetes: an update //Clin. Diabetes. Vol. 23. 2005. № 2. P. 64–76.
10. Klip A., Leiter L.A. Cellular mechanism of action of metformin // Diabetes Care. Vol. 13. 1990. № 6. P. 696–704.
11. Korytkowski M., Thomas A., Reid L., Tedesco M.B., Gooding W.E., Gerich J. Glimepiride improves both first and second phases of insulin secretion in type 2 diabetes // Diabetes Care. Vol. 25. 2002. № 9. P. 1607–1611.
12. Martin S., Kolb H., Beuth J., van Leendert R., Schneider B., Scherbaum W.A. Change in patients' body weight after 12 months of treatment with glimepiride or glibenclamide in type 2 diabetes: a multicentre retrospective cohort study // Diabetologia. Vol. 46. 2003. № 12. P. 1611–1617.
13. Reasner C.A., Göke B. Overcoming the barriers to effective glycaemic control for type 2 diabetes // Br. J. Diabetes Vasc. Dis. Vol. 2. 2002. № 4. P. 290–295.
14. Trischitta V., Italia S., Raimondo M., Guardabasso V., Licciardello C., Runello F., Mazzarino S., Sangiorgi L., Anello M., Vigneri R. Efficacy of combined treatments in NIDDM patients with secondary failure to sulphonylureas. Is it predictable? // J. Endocrinol. Invest. Vol. 21. 1998. № 11. P. 744–747.
15. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complication in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. Vol. 352. 1998. № 9131. P. 854–865.
16. Weitgasser R., Lechleitner M., Luger A., Klingler A. Effects of glimepiride on HbA1c and body weight in type 2 diabetes: results of a 1.5-year follow-up study // Diabetes Res. Clin. Pract. Vol. 61. 2003. № 1.P. 13–19.
17. Saydah S.H., Fradkin J., Cowie C.C. Poor control of risk factors for vascular disease among adults with previously diagnosed diabetes // JAMA. Vol. 291. 2004. № 3. P. 335–342.
18. Koro C.E., Bowlin S.J., Bourgeois N., Fedder D.O. Glycemic control from 1988 to 2000 among U.S. adults diagnosed with type 2 diabetes: a preliminary report // Diabetes Care. Vol. 27. 2004. № 1. P. 17–20.
19. Liebl A., Mata M., Eschwège E.; ODE-2 Advisory Board. Evaluation of risk factors for development of complications in type II diabetes in Europe // Diabetologia. Vol. 45. 2002. № 7. P. S23–S28.
20. Diabetic Medicine by Blackwell Pub., 2002
21. Сунцов Ю.И., Дедов И.И., 2006
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.