Исторические вехи и современные направления развития инсулинотерапии. 90-летие открытия инсулина
- Аннотация
- Статья
- Ссылки
На заре инсулинотерапии основной задачей лечения СД было выживание больных. Результаты современных исследований представили неопровержимые доказательства того, что тяжесть и прогрессирование осложнений СД имеют прямую зависимость от степени компенсации заболевания. Сегодня совершенствование терапии СД направлено на достижение стабильной компенсации заболевания, обеспечивающей увеличение продолжительности и улучшение качества жизни пациентов.
Первыми появились препараты инсулина короткого действия (рис. 1). Они содержали лишь одну единицу инсулина в 1 мл раствора (позже их концентрация была увеличена), при их применении возникали определенные неудобства, поскольку эффект препаратов был слишком кратковременным. В 1924 г. Э.П. Джослин, по праву считающийся родоначальником клинической инсулинотерапии, предложил схему изменения мест инъекций инсулина и даже указал при этом на отличия в фармакокинетике всасывания препарата из различных зон тела. Вместе со Штольпе он стал основателем интенсивной инсулинотерапии, разработав схему начала инсулинотерапии, которая заключалась во введении небольших доз инсулина короткого действия перед тремя основными приемами пищи.
Однако в первые годы применения инсулина приходилось сталкиваться с многочисленными трудностями. Так, например, особой проблемой были получение и стандартизация препаратов инсулина. Долгое время (вплоть до 70-х гг. XX века) гормон выделяли из поджелудочной железы животных путем экстракции с последующей многостадийной очисткой и называли соответственно свиной, бычий, свиной/бычий инсулин. Среди нерешенных вопросов оставались точность дозирования, изменение дозы инсулина в зависимости от приема пищи, техника инъекций (инъекции производились стеклянными шприцами с длиной иглы до 2,5 см), серьезные осложнения в местах инъекций (липодистрофии), а также систематический контроль фармакологического действия препарата.
Первые синтезированные инсулины характеризовались недостаточной стабильностью и содержали большое количество примесей. Кроме того, растворы инсулинов имели кислую реакцию, что, с одной стороны, защищало их от воздействия содержащихся в растворе панкреатических ферментов, а с другой – приводило к замедлению скорости всасывания гормона и болезненным ощущениям в местах инъекций. Дальнейшие усилия были направлены на получение инсулинов с нейтральной реакцией (рН 7,0–7,6) для быстрого всасывания из подкожно-жировой клетчатки.
В начале 40-х гг. прошлого века из-за появления препаратов инсулина продленного действия инсулинотерапия существенно изменилась. В результате добавления белка протамина к кристаллическому цинк-инсулину были получены препараты средней длительности действия: протамин-цинк-инсулин и инсулин-цинк-суспензия; первым из них был NPH (Neutral Protamin Hagedorn). Основной целью введения таких препаратов инсулина было уменьшение числа ежедневных инъекций. Одноразовое введение пролонгированных препаратов инсулина получило широкое распространение. Однако вскоре выяснилось, что данная тактика инсулинотерапии не только не позволяет нормализовать гликемию, но и чревата развитием тяжелых гипогликемических состояний, особенно при увеличении дозы для обеспечения компенсации СД.
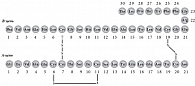
Белковая природа инсулина была определена еще в 1928 г., однако его первичная структура была расшифрована лишь в 1951 г. в лаборатории Ф. Сангера. Молекула инсулина представляет гетеродимерный полипептид, состоящий из цепочек А и В, ковалентно соединенных между собой двумя дисульфидными связями (рис. 2). Рентгеноструктурный анализ продемонстрировал, что кристаллический цинк-инсулин состоит из трех димеров. В растворе молекула инсулина легко переходит в агрегированное состояние, которое зависит от концентрации белка, температуры, рН и содержания цинка.
В 1960-е гг. были выполнены первые исследования по фармакокинетике инсулина, описана внутрииндивидуальная вариабельность абсорбции препарата из-под кожи. Спустя четыре года П. Катсояни разработал технологию химического синтеза инсулина. В клинической практике необходимо учитывать физиологические суточные колебания секреции инсулина, поскольку главной задачей инсулинотерапии является максимальная имитация секреции инсулина у здорового человека. Как известно, существует два компонента секреции гормона: базальный (фоновый), происходящий непрерывно, и стимулированный приемом пищи (пиковый). В идеале необходимо максимально имитировать эндогенную секрецию с помощью препаратов инсулина различной продолжительности действия.
Важным событием стало завершение исследований DCCT и UKPDS, которые продемонстрировали возможность профилактики развития и прогрессирования диабетических осложнений при жестком контроле гликемии. Одновременно стали очевидными недостатки стандартных препаратов инсулина, которые не обеспечивали необходимую гибкость терапии и нередко вызывали гипогликемию при попытке нормализации уровня НbА1с. Быстрое совершенствование технологии привело к появлению высокоочищенных инсулинов животного происхождения, инсулинов длительного действия, и, наконец, появился рекомбинантный инсулин, синтезированный в E. coli. Сегодня современные генно-инженерные технологии позволяют вносить изменения в структуру молекул рекомбинантных белков и получать модифицированные инсулины (аналоги).
Спектр применяемых препаратов инсулина становится все шире, включая как традиционные препараты, так и аналоги инсулина, обладающие заданными фармакокинетическими и/или фармакодинамическими свойствами. На практике доступность препаратов инсулина с разной скоростью, временным профилем и длительностью действия обеспечивает возможность лучшего метаболического контроля с меньшим риском гипогликемических состояний.
С появлением аналогов инсулина стала возможной более точная имитация эндогенной секреции. Поскольку современные препараты инсулина короткого действия (ИКД) выпускаются в виде концентрированных растворов, молекулы гормона в них самопроизвольно агрегируют и образуют гексамеры. С одной стороны, гексамеры стабилизируют молекулу инсулина, но с другой – в кровь всасываются с некоторой задержкой, только после диссоциации на хорошо абсорбируемые димеры и мономеры, что отражает время начала действия инсулина. Эта особенность и определяет фармакокинетический профиль ИКД. Медленное всасывание ИКД требует, чтобы инъекция была сделана за 30–45 минут до приема пищи, очевидно, что это неудобно для пациентов, и, как показывает практика, мало кто фактически выдерживает эту паузу.
Преодолеть задержку всасывания инсулина в кровь удалось путем создания ультракоротких аналогов инсулина, которые были получены в результате снижения стабильности гексамеров инсулина. Фармакокинетика ультракоротких инсулиновых аналогов отличается тем, что после инъекции происходят быстрая диссоциация на мономеры и поступление их в циркулирующую кровь. Именно этим объясняется разница в скорости начала действия ИКД и аналогов инсулина ультракороткого действия. Применение ультракоротких аналогов инсулина позволяет достигать целевого уровня гликемии при минимальном риске развития гипогликемии. Кроме того, индивидуальные различия во времени достижения максимальной концентрации значительно менее выражены при использовании ультракоротких аналогов инсулина, чем при введении ИКД.
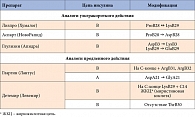
Первым инсулиновым аналогом, ставшим доступным для клинического применения и наиболее изученным, является аналог ультракороткого действия – инсулин лизпро (Хумалог) (табл. 1). Другой удачный пример модификации аминокислотной последовательности молекулы инсулина человека – инсулин аспарт (НовоРапид). В последние годы стал доступен еще один аналог инсулина ультракороткого действия – инсулин глулизин (Апидра). Ультракороткие аналоги инсулина обладают явными фармакокинетическими преимуществами перед ИКД – более ранним началом действия (через 5–15 минут после инъекции), быстрым достижением пика концентрации (примерно через 60 минут), меньшей продолжительностью действия (3–4 часа), что обеспечивает удобство применения для пациентов с СД.
Базальная секреция инсулина у здорового человека составляет 0,5–1,0 МЕ/час и поддерживает концентрацию в сыворотке крови от 5 до 15 мкед/мл, обеспечивая примерно половину ежедневной потребности в инсулине с предсказуемым профилем секреции. поэтому идеальный базальный инсулин должен соответствовать следующим физиологическим характеристикам: это ровный профиль, беспиковое суточное действие, постоянно предсказуемый эффект и, кроме того, эффективный контроль гликемии с меньшей частотой гипогликемий. Инсулиновые аналоги продленного действия разработаны на основе двух разных принципов. Одной из возможностей пролонгировать действие инсулина стало изменение изоэлектрической точки его молекулы в направлении нейтрального рН, что снижает растворимость молекулы в месте подкожной инъекции и обеспечивает медленное всасывание препарата из этого участка. Так появился первый аналог человеческого инсулина продленного действия – инсулин гларгин (Лантус).
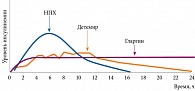
При введении в подкожную жировую клетчатку (рН = 7,4) слабокислый раствор Лантуса (рН = 4) вступает в реакцию нейтрализации с образованием микропреципитатов инсулина. В дальнейшем из этих структур происходит высвобождение гексамеров гларгина, их диссоциация на димеры и мономеры. При этом в крови в течение 24 ч поддерживаются постоянные уровни инсулина при отсутствии пиков концентрации, что позволяет вводить гларгин один раз в сутки (рис. 3). Иным способом пролонгирования действия инсулина стала модификация структуры для его связывания с альбумином сыворотки. Инсулин детемир (Левемир) – ацилированный аналог инсулина длительного действия. Ацетилирование молекулы инсулина жирной кислотой не только обеспечивает связывание с альбумином, но и усиливает самоассоциацию гексамеров инсулина. В целом межиндивидуальная вариабельность у аналогов инсулина длительного действия ниже, чем у NPH-инсулина.
Среди препаратов инсулина сегодня доступны и готовые смеси инсулина, профиль активности которых определяется сочетанием фармакологических параметров его составляющих. В настоящее время разработаны готовые аналоговые смеси инсулина, их болюсный компонент представлен аналогом инсулина ультракороткого действия. Смешанные инсулины наиболее удобны для пациентов с СД 2 типа со стабильным режимом дня и питания, лиц старшей возрастной группы, что позволяет при общем сокращении количества ежедневных инъекций контролировать как постпрандиальную, так и базальную гликемию.
Для преодоления неудобств, связанных с введением инсулина, были созданы современные оригинальные инъекционные системы (шприц-ручки различных модификаций), позволяющие объединить несколько этапов инъекций. Они не только удобны в применении, но и гарантируют точность дозы и безопасность, а также позволяют произвести инъекцию в любых условиях. Перспективы инсулинотерапии связывают с разработкой различных методов введения инсулина (например, пероральный, ингаляционный). Однако пока ни один из новых способов, к сожалению, не оказался совершенным.
