Севеламер: многовекторность действия и доказанные эффекты
- Аннотация
- Статья
- Ссылки
- English
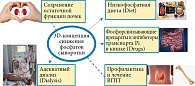
Гиперфосфатемия (уровень фосфора сыворотки > 1,49 ммоль/л), по некоторым данным, регистрируется у 5% пациентов с хронической болезнью почек (ХБП) уже на второй стадии, достигает 15–20% к четвертой стадии и 50–75% у пациентов на пятой стадии заболевания [1, 2]. Согласно фосфат-центрической парадигме, именно снижение экскреции фосфатов при потере части действующей паренхимы является одним из ключевых патогенетических факторов развития cиндрома минеральных и костных нарушений при ХБП (МКН-ХБП) [3–5]. Гиперфосфатемия – это независимый фактор повышения общей и сердечно-сосудистой смертности на всех стадиях ХБП и в посттрансплантационном периоде [6, 7]. Повышение уровня фосфора нивелирует нефропротективный эффект ингибиторов ангиотензинпревращающего фермента у пациентов со второй – четвертой стадиями ХБП, как было показано в рандомизированном контролируемом исследовании (РКИ) M. Zoccali и соавт. (2011). Причем разница в скорости прогрессии ХБП между плацебо и интервенционной группой исчезала уже при уровне фосфора более 1,3 ммоль/л, что не превышает референсного интервала, а только соответствует его верхнему квартилю [8]. Показано, что неконтролируемая гиперфосфатемия ≥ 1,77 ммоль/л ведет к достоверному увеличению риска быстрой потери (в течение первого года) артериовенозной фистулы у пациентов на программном гемодиализе (ПГД) [9]. С этим исследованием перекликается недавняя работа японских авторов, которые показали на опыте наблюдения за 3505 пациентами на ПГД в течение 10 лет, что уровень фосфата сыворотки более 1,8 ммоль/л повышает риск тяжелого атеросклероза периферических артерий (требующего оперативного лечения) на 81% [10]. Избыток фосфатов оказывает прямой токсический эффект на эндотелий сосудов [11], приводит к кальцификации и повышению жесткости сосудистой стенки уже на ранних стадиях ХБП [12] и кальцификации клапанов на додиализных стадиях ХБП [13]. Несмотря на то что на паращитовидных железах (ПЩЖ) не было найдено специфических рецепторов для фосфора, аналогичных рецепторам к витамину D, и кальций-сенсорных рецепторов (СаSR), было показано, что гиперфосфатемия оказывает прямое, независимое от кальция и кальцитриола действие на ПЩЖ, увеличивая секрецию паратиреоидного гормона (ПТГ) [14]. Это далеко не полный список негативных эффектов, которые напрямую связаны с гиперфосфатемией или высоко-нормальным уровнем фосфора и доказаны многочисленными исследованиями у пациентов на разных стадиях ХБП. Справедливо будет назвать избыточный фосфат сыворотки универсальным уремическим токсином, ускоряющим старение организма во всех его проявлениях [15], и рассчитывать на улучшение клинических исходов при снижении и особенно нормализации его уровня [16]. К сожалению, достижение этой цели представляет собой трудную задачу. Не случайно терапевтическая стратегия, направленная на борьбу с гиперфосфатемией, является многофакторной, так называемой 3D-стратегией, которая представляет собой сочетание гипофосфатной диеты (Diet), адекватного диализа (Dialysis) и назначения фосфорсвязывающих препаратов (ФСП) (Drugs). C недавних пор к последним добавлены ингибиторы транспорта фосфора в кишке (например, никотинамид) [17]. Важными дополнительными направлениями можно считать максимально пролонгированное сохранение остаточной функции почек (в том числе и на этапе заместительной почечной терапии) и профилактические и лечебные мероприятия, призванные восстановить нормальный обмен кости (так как эндогенный фосфор, поступающий из кости при повышенной ее резорбции и из мышечной ткани при катаболизме, может в большей степени влиять на уровень фосфатов крови, чем экзогенный, поступающий с пищей). Комплекс терапевтических 3D-мероприятий отображен на рисунке. Каким бы ни был набор терапевтических средств, лечение гиперфосфатемии невозможно без использования ФСП.
При обычной вестернизированной диете (которая привычна для жителей Европы) в организм поступает примерно 20 мг/кг фосфата в сутки, две трети которого всасывается в проксимальной кишке. Это обеспечивает поступление в кровь примерно 1000 мг фосфата в сутки [18], что уже выше рекомендуемых для взрослого человека 700 мг/сут [19]. Ситуация ухудшается, если потребляемая пища прошла промышленную переработку и богата фосфорсодержащими пищевыми добавками (ортофосфорной кислотой и фосфатными солями), что повышает поступление фосфатов до 1500–2200 мг/сут [20]. В то же время возможности выведения фосфатов на гемодиализе не превышают 600–1200 мг за процедуру [21, 22]. Даже жестко выверенная гипофосфатная диета (приверженность к которой, как правило, невелика) и вполне адекватная заместительная почечная терапия не справляются с такой нагрузкой без ФСП, которые обеспечивают, в зависимости от дозы, дополнительное удаление 250–350 мг/сут фосфора.
Когда начинать терапию ФСП? Все эксперты согласны с тем, что повышение уровня фосфора сыворотки выше 1,45 ммоль/л (верхней границы референсного интервала) является показанием к назначению ФСП вкупе с гипофосфатной диетой и, если речь о пациентах на диализе, возможной интенсификацией процедур. Но с учетом механизма развития вторичного гиперпаратиреоза (ВГПТ), стимуляции секреции фактора роста фибробластов 23 (FGF23) не будет ли целесообразным более раннее назначение ФСП на додиализных стадиях ХБП даже при отсутствии явной гиперфосфатемии? Однозначного ответа на этот вопрос пока нет. Например, T. Isakova и соавт. (2009) продемонстрировали, что начало лечения ФСП на додиализном этапе при уровне Р > 1,2 ммоль/л улучшает отдаленные результаты выживаемости на диализе по сравнению с началом приема ФСП только после старта диализной терапии [23]. В то же время G.A. Block и соавт. (2012) в РКИ сравнивали влияние ФСП и плацебо на показатели фосфорно-кальциевого обмена и степень кальцификации сосудов у пациентов с ХБП додиализных стадий (в среднем уровень фосфора 1,35 ммоль/л) в течение среднего периода в 249 дней. Было отмечено, что в группе ФСП достоверно снизились уровень и экскреция фосфора, уровень ПТГ оставался неизменным, а в группе плацебо уровень фосфора не изменился, а ПТГ постепенно нарастал. Дополнительно в группе ФСП возросла минеральная плотность кости. Но кальцификация коронарных артерий и брюшной аорты к концу исследования была достоверно выше в группе ФСП, чем в группе плацебо [24]. Объяснить результат было довольно сложно, так как уровень FGF23 не изменялся в обеих группах и не различался по группам. Кроме того, у пациентов без кальцификации в начале исследования кальцификация не была выявлена и в конце исследования, а ее возрастание наблюдалось только у тех пациентов, которые исходно имели ее признаки и в аорте, и в коронарных сосудах. К тому же в группе ФСП треть пациентов получали ацетат кальция, расчеты же проводились суммарно по группе, а не по отдельным видам ФСП. Возможно, кальцификация была связана именно с применением кальцийсодержащих ФСП, тем более что в другом исследовании влияния на динамику развития ВГПТ терапии бескальциевым ФСП лантана карбонатом также у пациентов с додиализной ХБП и уровнем фосфора сыворотки < 1,45 ммоль/л было выявлено снижение экскреции фосфатов (снижение нагрузки фосфатами) и уровня FGF23 при неизменном уровне фосфора и ПТГ [25]. Тем не менее именно исследование G.A. Block и соавт. рассматривается как предостережение против назначения ФСП при нормальном уровне фосфатов на додиализном этапе.
В целом в настоящее время нет сомнений, что применение ФСП обеспечивает лучшую выживаемость по сравнению с плацебо. Это подтверждено исследованием COSMOS (6797 пациентов из 227 диализных центров 20 европейских стран), продемонстрировавшим снижение общей смертности на 29% и сердечно-сосудистой смертности на 22% при приеме ФСП в сравнении с плацебо [26]. Также нет сомнений в преимуществах бескальциевых ФСП во влиянии на клинические исходы по сравнению с кальцийсодержащими. Независимый метаанализ 18 РКИ показал снижение смертности на 22% у пациентов, получавших бескальциевые ФСП, по сравнению с кальцийсодержащими ФСП [27]. Следует отметить, что в 15 исследованиях бескальциевым ФСП был севеламер, в одном исследовании – севеламер в сочетании с лантана карбонатом и только в двух – лантана карбонат. Иными словами, работа, заложившая основу повсеместно распространившихся рекомендаций значительного сокращения использования кальциевых ФСП, одновременно может считаться весомым доказательством преимущества именно севеламера над кальциевыми ФСП во влиянии на выживаемость пациентов с ХБП и гиперфосфатемией. Следующий метаанализ РКИ, в котором сравнивали севеламер с кальциевыми ФСП, был опубликован в 2016 г. [28]. В него вошли 17 из 19 РКИ Кокрановского обзора 2011 г. и восемь РКИ, отвечающих требованиям Кокрановской методики отбора, опубликованных с 2009 по 2015 г. (25 РКИ: 22 – с участием пациентов с ХБП стадии 5Д и три – с ХБП третьей – пятой стадий; общее число пациентов – 4770). Метаанализ показал достоверное снижение общей смертности на 46% в группе севеламера по сравнению с кальциевыми ФСП. В 2018 г. был обновлен Кокрановский систематический обзор и метаанализ 2011 г., в который были включены дополнительно 67 исследований, опубликованных за период с 2011 до июля 2018 г. Общее число исследований достигло 104, а популяция пациентов – 13 744. 82 исследования касались пациентов на диализе, 22 – на додиализных стадиях ХБП (второй – пятой стадий). Доля РКИ с севеламером превышала все остальные, вместе взятые. Заключение было неопределенным: авторы затруднились однозначно ответить на вопрос, есть ли достоверное влияние какого-либо ФСП на сердечно-сосудистые исходы. Впрочем, была сделана оговорка, что севеламер снижает риск смерти по сравнению с кальциевыми ФСП, но связано ли это с достоверно более низким уровнем кальция на фоне приема севеламера или с какими-то другими механизмами его воздействия, остается неизвестным [29]. Наконец, опубликованный летом 2021 г. глобальный метаанализ всего накопленного к настоящему времени репрезентативного материала РКИ всех бескальциевых препаратов, направленных на противодействие адсорбции фосфатов в кишечнике, заслуживает отдельного внимания. В него вошли 127 РКИ из баз Medline, Scopus и Cochrane Library, опубликованных до 01.06.2020. Общее число пациентов составило 20 215, 77% – с ХБП стадии 5Д. Проанализированы работы, касающиеся влияния на различные клинические исходы практически всего спектра существующих бескальциевых ФСП: севеламер, лантана карбонат, железосодержащие (в том числе железа III гидроксид сахарозный комплекс), магнийсодержащие, ниацин, тенапанор, биксаломер. Сравнивали влияние на исходы препаратов заявленных групп с плацебо с кальцийсодержащими ФСП с другими бескальциевыми ФСП. В результате статистической обработки данных было показано, что общую смертность достоверно снижают только севеламер (отношение рисков (ОР) 0,61) и лантана карбонат (ОР 0,47). Не было ФСП, которые бы снижали сердечно-сосудистую смертность в общем, однако показано снижение частоты сердечно-сосудистых событий (в частности, внезапной смерти) при терапии севеламером в отдельных группах: у диализных пациентов с длительностью приема препарата более года, а также в сравнении с принимающими кальциевые ФСП. Частота госпитализаций достоверно снижалась только в группе севеламера (ОР 0,53). Преимуществ в отношении степени снижения уровня фосфора у севеламера не было по сравнению с другими кальциевыми и бескальциевыми ФСП. В этом метаанализе севеламер достоверно дополнительно снижал уровни липопротеидов низкой плотности (ЛПНП), общего холестерина (ОХ), триглицеридов (ТГ), FGF23 и С-реактивного белка (СРБ) [30].
Эндотелиальная дисфункция и ускоренная сосудистая кальцификация являются основными причинами преждевременной по сравнению с общей популяцией смертности пациентов с ХБП. Наиболее показательным было снижение кальцификации коронарных артерий на фоне терапии севеламером (1600 мг/сут) в сравнении с карбонатом кальция (2000 мг/сут) в исследовании INDEPENDENT-CKD у пациентов c третьей-четвертой стадиями ХБП [31]. В анализ были включены 212 пациентов (107 в группе севеламера и 105 в группе карбоната кальция), время наблюдения составило 36 месяцев. Стартовые условия были несколько хуже в группе севеламера: исходно сердечно-сосудистую кальцификацию имели 54% пациентов этой группы против 45% в группе карбоната кальция. Тем не менее к концу исследования кальцификация регрессировала на 22% при терапии севеламером и только на 2% – при терапии карбонатом кальция. Процент кальцификации de novo составил в группе севеламера 13, а в группе карбоната кальция – 81. A. Rastogi проанализировал, помимо этого, еще четыре работы, посвященные возможности улучшения сосудистой и эндотелиальной функций (оценивавшихся по скорости пульсовой волны, поток-опосредованной вазодилатации, уровню фетуина А), и пришел к выводу, что севеламер обладает фосфат- и кальций-независимым воздействием, способствующим снижению повреждения эндотелия и улучшению качества сосудистой стенки у пациентов с ХБП [32]. В дополнение к этим работам в 2021 г. опубликованы результаты исследования влияния севеламера на уровень кальций-протеиновых частиц первого и второго типов (содержащих аморфный карбонат кальция и гидроксиапатит соответственно), которые играют важную роль в процессах сердечно-сосудистой кальцификации. Также в исследовании стабильных пациентов (n = 31), рандомизированных в группы севеламера и карбоната кальция на 24 недели, оценивали плейотропные противовоспалительные эффекты. В результате было выявлено снижение кальций-протеиновых частиц первого типа, скорости пульсовой волны и интерлейкинов (ИЛ) 6 и 8 в группе севеламера. Уровень СРБ не различался по группам. Эти результаты еще раз подтверждают наличие противовоспалительного воздействия севеламера и улучшение состояния сосудистой стенки на фоне его приема [33].
Севеламер используется в клинической практике уже более 30 лет. За это время накопилось значительное количество исследований, подтверждающих его многочисленные плейотропные эффекты. Пожалуй, наиболее давно и прочно закрепилось мнение о севеламере как о препарате, эффективно улучшающем липидный профиль пациентов с ХБП. Первое исследование (интервенционное проспективное), сообщившее о снижении уровня ЛПНП одновременно с уровнем фосфатов при терапии севеламером, было опубликовано в 1998 г. [34]. В нем приведены данные о снижении ОХ на 23%, ЛПНП – на 35,9%, а индекса атерогенности – на 35,2%. В дальнейшем многочисленные РКИ стабильно подтверждали это свойство севеламера [35, 36]. Что касается уровня липопротеидов высокой плотности (ЛПВП), то здесь результаты исследований были противоречивы. В одних отмечалось повышение ЛПВП [37], в других этот эффект отсутствовал. Опубликованный систематический обзор и метаанализ исследований, касающихся плейотропных эффектов севеламера, подтвердил достоверное повышение ЛПВП наряду со снижением ЛПНП и ОХ, но не ТГ [38].
Большое количество исследований посвящено применению севеламера у пациентов с сахарным диабетом (СД) и ХБП. В этих исследованиях, часть из которых являлись рандомизированными контролируемыми, севеламер назначали как ФСП, но одновременно изучали его плейотропные эффекты в отношении широкого спектра маркеров воспаления и показателей углеводного обмена (концентрации гликированного гемоглобина, тощаковой глюкозы, конечных продуктов гликозилирования) [39, 40]. Способность севеламера улучшать гликемический контроль у пациентов с СД даже без ХБП была подтверждена в другой работе той же команды исследователей [41]. Достоверность снижения уровня гликированного гемоглобина была отмечена в уже упоминавшемся метаанализе [30]. Конечные продукты гликозилирования (КПГ) – макромолекулы, образующиеся при соединении свободных аминогрупп белков, липидов и нуклеиновых кислот с карбонильными группами восстанавливающих сахаров (глюкозы, сахарозы, мальтозы, лактозы). КПГ могут образовываться эндогенно при нарушении толерантности к глюкозе (СД), оксидативном стрессе, в процессе курения табака и/или поступать в организм из экзогенных источников (с пищей, приготовленной при высокой температуре, богатой углеводами). Измененные подобным образом белки, липиды и нуклеиновые кислоты перестают нормально функционировать в процессах метаболизма тканей. В частности, коллаген и эластин сосудистой стенки так же неферментативно гликозилируются и становятся жесткими, невосприимчивыми к медленной гидролитической деградации, что приводит к потере эластичности сосудов и прогрессии артериальной гипертензии, гипертрофии миокарда левого желудочка. КПГ выводятся почками, поэтому накапливаются по мере нарастания тяжести ХБП. У пациентов с СД и ХБП третьей – пятой стадий уровень КПГ повышен в большей степени, чем при СД и ХБП по отдельности. Поэтому способность севеламера достоверно снижать уровень КПГ, во-первых, за счет их связывания в кишечнике, а во-вторых, опосредованно, за счет снижения гликемии, представляется важным дополнением к его прямой фосфорсвязывающей функции. КПГ находятся в тесных взаимозависимых отношениях с провоспалительными цитокинами и свободными радикалами: с одной стороны, КПГ провоцируют и поддерживают хроническое воспаление и оксидативный стресс, с другой стороны, в условиях повышенной оксидации и воспалительных реакций их синтез ускоряется. Поэтому неудивительно, что работы, показывающие влияние севеламера на уровень КПГ, параллельно демонстрируют снижение маркеров воспаления [42, 43], эндотелиальной дисфункции [44] и кальцификации коронарных артерий [45].
Доказанные эффекты севеламера в отношении углеводного обмена (снижение уровня глюкозы и КПГ), его антиоксидантные и противовоспалительные свойства послужили отправной точкой для организации контролируемого исследования севеламера как секвестранта жирных кислот, способного снизить оксидацию нуклеиновых кислот и маркеры воспаления у пациентов с СД второго типа (n = 30) без ХБП в сравнении со здоровыми добровольцами (n = 20). Севеламер назначали в дозе 1600 мг три раза в день в течение недели. Степень окисления ДНК и РНК контролировали по уровню экскреции 8-оксо-7,8-дигидрогуаназина и 8-оксо-7,8-дигидро-2-деоксигуаназина; маркеры воспаления (фактор некроза опухоли α (ФНО-α), ИЛ 1, 6, 8 и 10) контролировали до и после терапии севеламером. Были обнаружены достоверные признаки снижения оксидативного стресса и некоторых маркеров воспаления (ИЛ-2 и ИЛ-6), что является обнадеживающим обстоятельством с учетом малой продолжительности терапии [46]. Еще одна довольно неожиданная идея использования севеламера как секвестранта жирных кислот, обладающего противовоспалительным действием, в лечении неалкогольного стеатогепатита была осуществлена пока только в экспериментальной работе [47]. Неалкогольный стеатогепатит является частым осложнением СД и метаболического синдрома, приводит к фиброзу печени и плохо поддается медикаментозному воздействию. Получены обнадеживающие результаты тормозящего влияния севеламера на развитие стеатоза, инфильтрацию макрофагами и перицеллюлярный фиброз печени. Кроме того, на фоне приема севеламера улучшался состав микробиоты. Эти результаты открывают определенные перспективы для дальнейших клинических изысканий. В отношении влияния севеламера на внушительный список маркеров оксидативного стресса, хронического воспаления и антиоксидантов (ЛПНП, оксида азота, 8-изопростанов, продуктов оксидации ДНК, ИЛ-6, ФНО-α, супероксиддисмутазы, общей антиоксидантной активности сыворотки) у пациентов на гемодиализе было проведено исследование E.N. Díaz-De la Cruz и соавт. (2021). Лечение продолжалось шесть месяцев, к концу которых было отмечено достоверное снижение прооксидантов и провоспалительных цитокинов и, напротив, повышение уровней антиоксидантных ферментов. Таким образом, еще раз подтверждено антивоспалительное действие севеламера, независимое от гипофосфатемического эффекта [48]. Интересные результаты были получены в сравнительном исследовании влияния севеламера и никотинамида на уровень эндотоксинов у пациентов на ПГД, получающих эти препараты с целью снижения гиперфосфатемии (исследование NICOREN). Севеламер превосходил никотинамид в гипофосфатемической эффективности, но вторичный анализ касался влияния на уровень липополисахаридов (отражающих образование микробиотой в условиях уремии р-крезил-сульфата, индоксил-сульфата, кинуренина, фенилацетилглютамина и других токсических агентов), мочевины, мочевой кислоты, СРБ, ПТГ, FGF23. Только в группе севеламера было отмечено достоверное снижение всех анализируемых показателей, за исключением СРБ и ПТГ. Авторы сделали вывод, что, несмотря на отсутствие динамики СРБ, севеламер может играть роль антивоспалительного агента для пациентов на ПГД [49]. Перечисленные эффекты севеламера отражены в таблице.
Основные нарекания к севеламеру заключаются в большой таблетированной нагрузке (до 6–9 таб/сут) и обязательном приеме два-три раза в день, что не способствует приверженности пациента лечению [50]. С целью улучшения комплаентности пациентов терапии при неизменной ее эффективности была разработана порошковая форма севеламера с расфасовкой в саше по 2400 мг, пригодная для однократного приема. Сравнительное РКИ севеламера в порошке для однократного приема и таблетированной формы для трехкратного приема продемонстрировало приемлемую эффективность однократного приема [51]. В другом исследовании, где также сравнивали различные режимы приема севеламера, было показано, что частота нежелательных явлений не различается при таблетированной трехразовой схеме и порошковой одноразовой [52].
Заключение
Севеламер – известный и хорошо изученный в клинической практике фосфорсвязывающий препарат. Его эффективность и безопасность в лечении гиперфосфатемии доказаны многочисленными РКИ и метаанализами. Севеламер превосходит кальцийсодержащие препараты по влиянию на конечные точки (смертность, сердечно-сосудистую кальцификацию). На сегодняшний день севеламер является единственным ФСП с подтвержденным в обширных метаанализах влиянием на снижение общей смертности и частоты госпитализаций пациентов с ХБП. Кроме того, севеламер обладает важными плейотропными эффектами антиоксидантной и антивоспалительной направленности, коррекционным действием на липидный профиль пациентов, способностью улучшать гликемический статус пациентов с СД. С учетом перечисленных преимуществ севеламер способен эффективно воздействовать одновременно на целый ряд патогенетических цепочек, ответственных за осложнения уремии, включая МКН-ХБП.
N.A. Mikhailova, PhD
Russian Medical Academy of Continuous Professional Education
Contact person: Natalia A. Mikhailova, natmikhailova@mail.ru
The presented review analyzes numerous data on the traditional and pleiotropic effects of sevelamer – one of the first phosphorus-binding drugs that do not contain calcium or other metals. Shown the beneficial effect of sevelamer on the vascular condition of patients with uremia. Summarized the facts of the phosphorus-independent effect of sevelamer on the lipid profile, markers of chronic inflammation and oxidative stress, its ability to improve glycemic control in patients with diabetes mellitus.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.