Сочетание предменструального синдрома и дисменореи у молодых женщин: особенности ведения
- Аннотация
- Статья
- Ссылки
- English
Введение
Сегодня многие молодые женщины реагируют на предменструальный период и саму менструацию негативно из-за ассоциаций с неприятными симптомами синдрома предменструального напряжения и/или первичной дисменореи. Синдром предменструального напряжения, или предменструальный синдром (ПМС), и первичная дисменорея – социально значимые гинекологические проблемы. Они негативно сказываются на качестве жизни и работоспособности молодых женщин, поскольку снижают производительность труда и повышают число случаев невыхода на работу/учебу и обращения за медицинской помощью. Все это приводит к значительным экономическим потерям [1].
Сведения о распространенности ПМС и первичной дисменореи весьма ограниченны и недооценены, многие случаи остаются незарегистрированными. Как правило, это связано с тем, что женщины считают предменструальные симптомы и менструальную боль нормальной частью менструального цикла и «тяжелой женской ношей», а не патологическим состоянием, даже если имеющиеся симптомы существенно отражаются на качестве их жизни. По данным одних источников, распространенность ПМС и первичной дисменореи колеблется от 10 до 90% [2], а по данным других – от 45 до 95% [3].
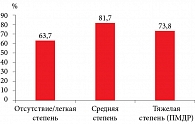
Нужно отметить, что между ПМС и дисменореей есть определенная взаимосвязь. M. Katimura и соавт. установили, что чем тяжелее были проявления первичной дисменореи, тем выше распространенность симптомов ПМС и предменструального дисфорического расстройства (ПМДР), причем их тяжесть напрямую коррелировала с тяжестью первичной дисменореи [4]. Аналогичные данные были получены M. Steiner и соавт., которые зарегистрировали высокую частоту первичной дисменореи у девушек-подростков с ПМС (рис. 1) [5].
Причины, по которым дисменорея и ПМС часто сопутствуют друг другу, точно неизвестны. Однако можно предложить, что их объединяют общие этиологические механизмы, включая возможную роль простагландинов. Кроме того, не следует пренебрегать влиянием психосоциальных факторов. Боль, которая ощущается при дисменорее, провоцирует появление негативных мыслей, которые еще больше усиливают выраженность предменструальных симптомов.
Предменструальный синдром
ПМС – сложный циклический симптомокомплекс психоэмоциональных, вегетососудистых и обменно-эндокринных нарушений, который возникает у некоторых женщин во время поздней лютеиновой фазы менструального цикла и исчезает после начала менструации [6]. Тяжелая форма ПМС классифицируется как ПМДР.
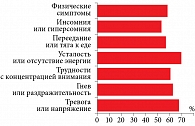
К физическим симптомам ПМС относятся головные боли, болезненность груди, вздутие живота, периферические отеки и общая слабость. Психологические или поведенческие расстройства при ПМС включают раздражительность, перепады настроения, плаксивость, тягу к еде, расстройства сна, беспокойство и депрессивное настроение. По данным исследования, у большинства девушек наблюдаются как психоэмоциональные, так и физические симптомы (рис. 2). Предменструальные симптомы снижают эффективность или продуктивность работы (52,9%), ухудшают социальную жизнь (24,5%) и отношения с коллегами или семьей (23,1%) [4].
Этиология и патогенез ПМС до сих пор остаются неизвестными. Однако есть предположения о возможных причинах возникновения предменструальных симптомов, в числе которых называются гормональные изменения, нарушение баланса нейротрансмиттеров, диеты, стресс и образ жизни [7, 8].
Согласно популярному сегодня мнению, в развитии ПМС и ПМДР значимую роль играет повышенная чувствительность к циклическим колебаниям уровней половых гормонов, что может обусловливать изменение настроения, поведенческие и соматические симптомы. При этом уровни половых гормонов у женщин, отмечающих данные симптомы, как правило, соответствуют референсным значениям [9].
Особое место в патогенезе ПМС и ПМДР отводится влиянию серотонина – центрального нейромедиатора, участвующего в регуляции настроения и поведения. Согласно научным исследованиям, для женщин с ПМС/ПМДР в отличие от здоровых женщин без симптомов характерны атипичная серотонинергическая передача и более низкая плотность рецепторов транспортера серотонина. Прием ингибиторов обратного захвата серотонина и другие методы лечения, повышающие уровень серотонина, например применение средств, действующих как высвобождающие серотонин агенты, облегчают предменструальные симптомы [10–13]. Кроме того, предполагается, что, оказывая влияние на серотонинергическую передачу, половые стероиды, в первую очередь прогестерон, могут опосредованно воздействовать на поведение.
Первичная дисменорея
Дисменорея, или менструальная боль, – наиболее распространенный менструальный симптом среди девочек-подростков и молодых женщин. У большинства женщин репродуктивного периода, страдающих дисменореей, наблюдается первичная дисменорея, определяемая как болезненные менструации при нормальной анатомии таза и отсутствии органических причин. Первичная дисменорея, как правило, начинается в подростковом возрасте с наступлением менархе или вскоре после него (через 6–12 месяцев), когда появляются овуляторные циклы [14]. При первичной дисменорее боль обычно имеет весьма предсказуемые временные рамки – она возникает непосредственно перед менструацией или в ее начале и длится от 8 до 72 часов, достигая максимальной интенсивности в течение первого или второго дня менструации [15]. Боль преимущественно локализуется в нижней части живота, но также может распространяться на спину и бедра. Кроме того, боль часто сопровождается такими системными симптомами, как тошнота, рвота, диарея, усталость и бессонница [3].
Наиболее распространенное объяснение первичной дисменореи – простагландиновая теория, согласно которой возникновение этого состояния связывают с чрезмерной продукцией простагландинов эндометрием матки. Во время десквамации функционального слоя эндометрия матки происходит активный выброс простагландинов из распадающихся эндометриальных клеток. Простагландины в свою очередь усиливают сократимость миометрия, приводя к его ишемии и в конечном итоге к боли. Простагландины, как известно, оказывают широкий спектр биологического влияния на разнообразные физиологические и патологические процессы, включая боль, воспаление, температуру тела и регуляцию сна. Однако синтез простагландинов ограничен доступностью арахидоновой кислоты и ее предшественников. Арахидоновая кислота образуется из фосфолипидов с помощью лизосомального фермента фосфолипазы А2.
Стабильность лизосомальной активности регулируется несколькими факторами, одним из которых является уровень прогестерона. Так, при высоких уровнях прогестерона наблюдается стабилизация активности лизосом, а при низких уровнях – дестабилизация активности лизосом. Регрессия желтого тела в поздней лютеиновой фазе менструального цикла сопровождается уменьшением уровня прогестерона. В результате устраняется стабилизирующий эффект гормона в отношении лизосом эндометрия, происходят высвобождение фосфолипазы А2 и гидролиз фосфолипидов клеточной мембраны, таким образом обеспечивается синтез арахидоновой кислоты. Наличие свободной арахидоновой кислоты вместе с внутриклеточным разрушением и травмой ткани во время менструации способствуют выработке простагландинов [3]. О повышении уровня простагландинов в лютеиновой фазе у женщин с дисменореей свидетельствуют результаты многочисленных исследований [16]. Кроме того, между выраженностью первичной дисменореи и количеством высвобождаемых простагландинов имеется положительная корреляция. Еще одним подтверждением простагландиновой теории первичной дисменореи может служить тот факт, что подавление синтеза простагландинов приводит к эффективному облегчению боли [17–19].
Распространено мнение, что первичная дисменорея возникает только при овуляторных менструальных циклах, когда в лютеиновой фазе прогестерон воздействует на эндометрий. Однако в одном исследовании были получены данные об отсутствии различий в выраженности менструальных симптомов, включая боль, между овуляторным и ановуляторным менструальными циклами у женщин с первичной дисменореей [20]. В этой связи можно предположить, что в патогенезе дисменореи играет роль не столько уровень прогестерона, сколько возможные изменения чувствительности организма к нему на рецепторном уровне.
Повторяющаяся из раза в раз менструальная боль может способствовать формированию повышенной болевой чувствительности центрального генеза. Центральная сенсибилизация определяется как ненормальное усиление боли механизмами центральной нервной системы и, следовательно, представляет собой состояние, при котором реакция на нормальные периферические раздражители значительно усиливается. Все это приводит к фиксированным структурным и функциональным изменениям путей проведения афферентных сигналов неблагополучия организма и формированию патологических локусов головного мозга, усиливающих эмоциональную составляющую боли при отсутствии повреждения тканей, воспаления или поражения нервной системы [21, 22].
Предменструальный синдром и первичная дисменорея: взаимосвязь и методы коррекции
Лечение при ПМС и первичной дисменорее должно быть направлено на оба состояния, и в этом случае методом выбора может стать гормональная терапия. Так, комбинированные оральные контрацептивы (КОК) подавляют овуляцию и соответственно лютеиновую фазу менструального цикла, тем самым стабилизируя уровень гормонов, уменьшая толщину эндометрия и секрецию простагландинов.
При предменструальных симптомах следует обратить внимание на КОК, содержащие дроспиренон. Дроспиренон, будучи дериватом спиронолактона, блокирует минералкортикоидные рецепторы и предупреждает гормонозависимую задержку жидкости, уменьшая тем самым вероятность появления периферических отеков [23]. В то же время уникальность вещества заключается в его способности активировать прогестероновые рецепторы и обеспечивать выраженное гестагенное действие, но без разнообразных иных, в том числе побочных, эффектов нативного прогестерона. Многочисленные исследования свидетельствуют о положительном опыте назначения при ПМС КОК, содержащего этинилэстрадиол 20 мкг и дроспиренон 3 мг, в режиме 24/4, который за счет укороченного безгормонального интервала может выраженнее уменьшать колебание гормонов.
В четырех рандомизированных плацебоконтролируемых исследованиях у пациенток, принимавших КОК с этинилэстрадиолом 20 мкг и дроспиреноном 3 мг в режиме 24/4, уменьшалась выраженность симптомов ПМДР [24–27]. Кроме того, согласно результатам, полученным T. Takeda и соавт., прием комбинированного препарата (этинилэстрадиол 20 мкг + дроспиренон 3 мг) с целью контрацепции и облегчения ПМС также положительно влиял на симптомы первичной дисменореи [8]. G. Uysal и соавт. констатировали, что комбинация «этинилэстрадиол 20 мкг + дроспиренон 3 мг» существенно улучшала состояние пациенток с тяжелой дисменореей [28]. По данным R. Machado и соавт., использование КОК, содержащих 20 мкг этинилэстрадиола и 3 мг дроспиренона, продемонстрировало высокую эффективность в отношении клинических симптомов ПМС и дисменореи, в том числе первично обнаруженной в раннем репродуктивном возрасте [29].
Сегодня на российском фармацевтическом рынке доступен препарат Джес® Плюс, который содержит этинилэстрадиол 20 мкг, дроспиренон 3 мг, левомефолат кальция (Метафолин®) 451 мкг. Левомефолат кальция представляет собой биологически активную форму фолата. Его кислотная форма по структуре идентична естественному L-5-метилтетрагидрофолату – основной фолатной форме, содержащейся в пище [30]. 5-метилтетрагидрофолат – источник метильных групп для превращения гомоцистеина в метионин. Так происходит утилизация гомоцистеина, который в количествах, превышающих физиологические нормы, становится токсичным [31].
Согласно некоторым данным, накопление избыточного уровня гомоцистеина и недостаток метионина вследствие дефицита фолатов могут быть одной из причин депрессивного настроения. Дефицит фолатов ассоциируется с психоэмоциональными нарушениями, в том числе депрессивным настроением, апатией, усталостью, инсомнией, раздражительностью, трудностями с концентрацией внимания и др. [32, 33]. Указанные симптомы характерны и для ПМС, в том числе ПМДР. В этой связи можно предположить, что помимо прочих факторов они могут быть обусловлены низким уровнем фолатов, который в той или иной мере наблюдается у 90% женщин репродуктивного возраста [10–12, 34].
Левомефолат кальция не только используется в преконцепционной подготовке с целью профилактики дефекта нервной трубки плода, но и обладает другими полезными свойствами. В частности, он положительно влияет на менструальную функцию молодых женщин, опосредованно воздействуя на ряд биохимических реакций. Фолаты тесно связаны с синтезом в центральной нервной системе нейротрансмиттеров (серотонина, мелатонина, норэпинефрина и дофамина [34]), которые играют немаловажную роль в регуляции психического и физического состояния женщины, в том числе регуляции менструального цикла. Фолаты также являются коэнзимами для триптофан- и тирозингидроксилаз. Следовательно, одной из точек приложения левомефолата кальция будет реакция превращения триптофана в 5-гидрокситриптофан в цепочке биосинтеза нейромедиатора серотонина и мелатонина [31, 34].
Заключение
Несмотря на многочисленные исследования, значительную распространенность и социальную значимость ПМС и первичной дисменореи, сохраняются трудности в своевременном выявлении этих состояний и ранней патогенетически обоснованной терапии, поскольку зачастую и женщины, и врачи не придают особого значения имеющимся симптомам. Указанные заболевания могут прогрессировать, в дальнейшем приводя к репродуктивным и аффективным нарушениям. На основании данных литературы можно сделать вывод о том, что КОК, содержащие дроспиренон и левомефолат кальция, могут быть рекомендованы женщинам, нуждающимся в контрацепции и страдающим не только от ПМС, но и от первичной дисменореи. По результатам современных исследований, клинический эффект отмечается при воздействии на звенья патогенеза формирования симптомов ПМС и первичной дисменореи, устранении колебания уровней половых гормонов и влиянии на обмен нейромедиаторов (серотонина и дофамина), а также определенных аминокислот (гомоцистеина и метионина).
Статья опубликована при поддержке компании «Байер».
Ye.V. Uvarova, MD, PhD, Prof., Ye.P. Khashchenko, PhD, V.R. Yusubova
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Yelena V. Uvarova, elena-uvarova@yandex.ru
The article reflects the current pathogenetic aspects of premenstrual syndrome and primary dysmenorrhea. The described pathogenetic mechanisms are mainly represented by the influence of sex hormones on various physiological processes and body systems, including the neurohormonal, renin-angiotensin-aldosterone systems, and prostaglandin synthesis. Changes in the reactivity of these systems in response to sex hormones’ fluctuations during the menstrual cycle, as well as increased sensitivity can contribute to the symptoms onset. Thus, impaired homeostasis and inadequate adaptation may be key mechanisms underlying premenstrual syndrome and primary dysmenorrhea. The rationale for the use of microdosed combined oral contraceptives containing ethinylestradiol 20 mcg, drospirenone 3 mg and calcium levomefolate (Metafolin®) 451 mcg is also presented. According to modern literature, the use of this combination can reduce the severity of premenstrual syndrome symptoms and primary dysmenorrhea due to the effect on the level of neurotransmitters and normalization of the hormonal background.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.