Современная инсулинотерапия сахарного диабета детей и подростков
- Аннотация
- Статья
- Ссылки



В настоящее время доказано, что гипергликемия – главный этиологический фактор в развитии осложнений СД. При решении вопросов вторичной профилактики, направленной на уменьшение частоты, отсрочку или замедление процессов прогрессирования этих разрушительных осложнений, определяющее значение имеет совершенствование методов инсулинотерапии для достижения максимальной компенсации углеводного обмена.
Непосредственной целью инсулинотерапии является как можно более близкая имитация физиологического профиля инсулиновой секреции и достижение, таким образом, близких к норме показателей углеводного обмена. Попытки достижения физиологического профиля действия инсулина должны сочетаться с соображениями безопасности и переносимости лечения с учетом качества жизни больных диабетом.
Улучшение гликемического контроля у взрослых приводит к снижению частоты развития микрососудистых осложнений. Данные по контролю и анализу клинических исходов СД у детей немногочисленны. В исследовании DCCT 13% больных были в возрасте от 13 до 18 лет, которые по мере продолжения исследования перешли в категорию молодых взрослых. В исследование не вошли дети допубертатного возраста. В подростковой когорте была продемонстрирована такая же взаимосвязь между улучшением показателей углеводного обмена и снижением частоты развития осложнений, что и у взрослых пациентов. Однако в течение всего исследования у подростков показатели углеводного обмена были хуже, чем у взрослых, более часто развивались кетоацидоз и гипогликемии. Таким образом, данные DCCT продемонстрировали, что поддержание гликемического контроля в детском возрасте является наиболее сложным процессом. В то же время формирование специфических осложнений нередко начинается уже в детском возрасте. Недостаточная компенсация СД в первые годы заболевания может приводить к развитию тяжелых, малообратимых сосудистых осложнений в будущем (1).
Подходы к оценке компенсации СД
Современные стандарты терапии СД у детей и подростков отражают необходимость поддержания контроля гликемии как можно более близкого к нормальным показателям. Согласно последним рекомендациям ISPAD (2), уровень препрандиальной гликемии у больных СД должен находиться в пределах 4,4-6,7 ммоль/л, постпрандиальной – 5-10 ммоль/л, гликированного гемоглобина A1c < 7,5% (таблица 1). Однако в детском возрасте существует высокий риск развития гипогликемических реакций, в большинстве случаев препятствующих оптимальной компенсации углеводного обмена. Близкие к норме показатели гликемии в детском возрасте в большинстве случаев достижимы только в начале заболевания, особенно в период ремиссии. При стабильном течении заболевания возможно поддержание углеводного обмена на достаточно близком к нормогликемии уровне, однако такие больные составляют лишь небольшую часть детей и подростков с СД.
Целевые значения предназначены для ориентации в возникающих ситуациях. Однако каждому ребенку следует установить индивидуальные целевые показатели, которые были бы как можно ближе к нормальным значениям, но не приводили бы ни к тяжелым гипогликемиям, ни к частым эпизодам легкой или умеренной гипогликемии. Представленные целевые параметры, выведенные на основании исследования определенных популяций, должны быть скорректированы с учетом индивидуальных особенностей каждого пациента.
Для разных групп пациентов должны быть разные целевые параметры, например, для маленьких детей, для больных с асимптоматическими или частыми тяжелыми гипогликемиями. В связи с этим АДА были предложены новые, индивидуализированные по возрасту цели контроля гликемии для детей и подростков (таблица 2) (3).
Усилия по оптимизации контроля гликемии по-прежнему остаются сложной задачей в управлении СД у детей и подростков. По итогам скрининга больных СД в различных регионах РФ, средний уровень HbA1c среди детей и подростков составляет 9,8% (4). При этом лишь 18,4% имели оптимальную компенсацию углеводного обмена (ср. уровень HbA1c < 7,6%).
Одна из причин недостаточной эффективности терапии СД типа 1 – несоответствие фармакокинетики экзогенно вводимых человеческих инсулинов физиологическому профилю инсулинемии в здоровом организме: замедленная скорость всасывания и выведения коротких инсулинов заметно отличается от посталиментарной физиологической инсулинемии, а наличие пиков действия пролонгированных NPH-инсулинов не позволяет обеспечить ровную базальную инсулинемию даже в случае многократного трех- или даже четырехразового введения.
Гипогликемия является одним из основных ограничивающих факторов в стремлении достичь оптимального контроля углеводного обмена у больных, получающих инсулин.
И, наконец, проблемой в достижении компенсации сахарного диабета является вариабельность ежедневных профилей действия инсулина, которая до последнего времени недостаточно учитывалась при оценке качества используемых инсулинов. Инсулины короткого действия имеют 20-30% различия в пиковых концентрациях, а пролонгированные – вдвое большие различия.
Таким образом, несовершенство фармакокинетических свойств человеческих инсулинов, вводимых подкожно, стимулирует активный поиск новых фармакологических форм современных инсулинов.
Аналоги человеческого инсулина
Получение инсулиновых аналогов человеческих инсулинов с помощью современных высокотехнологичных генно-инженерных методов ознаменовало новую эру в совершенствовании инсулинотерапии.
Их особенностью является профиль действия, наиболее приближенный к физиологичному в здоровом организме. Различают ультракороткие инсулиновые аналоги, действующие подобно тому, как в здоровом организме секретируется инсулин в ответ на прием пищи, и аналоги пролонгированного, беспикового действия, имитирующие собственную достаточно ровную базальную секрецию инсулина. К первой группе аналогов относятся инсулин аспарт (НовоРапид®), лизпро (Хумалог®) и глулизин (Апидра®). Ко второй группе – детемир (Левемир®) и гларгин (Лантус®). Большие международные и наши собственные исследования аналогов, проведенные на детях, показали, что с их помощью удается улучшить показатели углеводного обмена с одновременным снижением риска гипогликемий, что чрезвычайно важно для детей и подростков, а также улучшить качество их жизни, уменьшить ограничения в питании, создать более гибкий режим жизни, успешнее заниматься спортом, получить профессию и адаптироваться к жизни.
Быстродействующие аналоги инсулина
В прошлом десятилетии начато новое направление в совершенствовании возможностей инсулинотерапии – получение аналогов инсулина с новыми фармакокинетическими характеристиками путем замены аминокислот в определенных положениях. К настоящему времени получены три препарата – лизпро, аспарт и глулизин (коммерческие названия – Хумалог®, НовоРапид® и Апидра®), которые имеют более высокую скорость всасывания и более короткую продолжительность действия, чем обычный человеческий инсулин короткого действия.
Простой человеческий инсулин (инсулин короткого действия) существует главным образом в виде комплекса из шести молекул инсулина (гексамеров) благодаря процессам самоассоциации. Меньшая часть его существует в виде одиночных (мономеры) или удвоенных (димеры) молекул. При внутривенном введении простой человеческий инсулин быстро диссоциирует до мономера. Однако после подкожного введения процесс диссоциации молекул из гексамеров происходит намного медленнее. Поскольку инсулин из подкожного депо в кровь может всасываться только в виде мономера, эта медленная диссоциация задерживает поступление инсулина в кровь. Начало действия подкожно введенного простого человеческого инсулина составляет приблизительно 15-30 минут после введения, пик действия отмечается приблизительно через 120 минут, а продолжительность действия в клинически используемых дозах составляет 6-8 ч. Эти данные касаются подкожного введения инсулина в область живота, которая является привилегированным участком введения. Всасывание из области живота является наиболее быстрым, далее по убывающей следует область плеча и бедра.
Инсулин аспарт (НовоРапид®) был получен путем замены в В-цепи аспарагиновой аминокислоты на пролин в 28-м положении. Это снизило способность к самоассоциации молекул инсулина после введения его в подкожно-жировую клетчатку. В результате инсулин сохраняется там в виде мономеров или димеров. Благодаря этому всасывание аспарта происходит со скоростью вдвое большей, чем простого человеческого инсулина. Пиковые уровни инсулинов приблизительно вдвое выше для аспарта по сравнению с простым человеческим инсулином и приходятся на 52-ю и 109-ю минуту соответственно. Продолжительность действия составляет 3-4 ч. Клинически значимым отличием аспарта от простого инсулина является меньшее влияние на скорость всасывания анатомической локализации инъекции. Кроме того, время пика и общая продолжительность действия не зависят от дозы инсулина, как это наблюдается при введении простого человеческого инсулина (2, 5).
Еще одним важным свойством ультракоротких инсулиновых аналогов явилось снижение частоты ночных гипогликемий. Одной из частых причин гипогликемий в ночное время является шлейф действия короткого инсулина, введенного перед ужином. При замене обычного короткого инсулина быстродействующим аналогом за счет его более короткого действия возникающая в ранние ночные часы гипергликемия предотвращает развитие гипогликемии, обусловленной пиком действия пролонгированного ночного инсулина. Результаты клинических исследований показали, что перевод на быстродействующие аналоги человеческого инсулина снижает риск развития ночных гипогликемий.
Проведены большие клинические испытания, в которых сравнивали инсулин аспарт с простым человеческим инсулином. В ряде исследований доказана достоверно менее выраженная степень постпрандиальной гипергликемии и снижение такого показателя компенсации углеводного обмена, как гликированный НbА1, у больных, получающих аспарт. Однако при индивидуальном анализе уровень гликированного гемоглобина снижается не у всех больных, несмотря на улучшение показателей гликемии. Этому могут быть два объяснения. Во-первых, частота легких гипогликемий у больных, получающих инсулин аспарт, ниже, чем у получающих простой инсулин, когда они используются в дозах, достаточных, чтобы получить сопоставимые уровни постпрандиальной гликемии. Также было доказано, что при использовании инсулина аспарт уменьшается частота тяжелых гипогликемий. Во-вторых, использование коротких аналогов инсулина в максимальной степени демонстрирует фармакокинетические особенности используемых пролонгированных человеческих инсулинов, в связи с чем они не способны создать устойчивую базисную концентрацию инсулина в крови. Являющиеся результатом этого эпизоды повышения препрандиальной гликемии также могут приводить к более высоким показателям уровня гликированного гемоглобина, чем это можно было бы ожидать, исходя из более низкого уровня постпрандиальной гликемии. При использовании в качества базисной терапии одного из пролонгированных аналогов наблюдается более заметное снижение гликированного гемоглобина у больных, получающих быстродействующие аналоги инсулина.
Инсулиновые аналоги короткого действия, воссоздавая физиологический профиль инсулинемии, позволяют получить целый ряд преимуществ в терапии СД типа 1 у детей и подростков. Особенно ценна возможность постпрандиального назначения: подбор дозы у детей с СД типа 1 при препрандиальном введении инсулина затруднен в связи с непредсказуемым пищевым поведением. В мультицентровом, открытом, перекрестном, 12-недельном исследовании, вовлекшем 26 детей в возрасте от 2,3 до 6,9 лет, сравнивалась эффективность и безопасность препрандиального введения человеческого инсулина короткого действия и постпрандиального введения инсулина аспарт. Уровень HbA1c 7,7% сохранялся на протяжении всего исследования в обеих группах инсулинотерапии. Гликемический контроль при постпрандиальном введении инсулина аспарт был аналогичным таковому при препрандиальном введении человеческого инсулина (ЧИ). Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов. Большинство родителей отдали предпочтение терапии инсулином аспарт и хотели бы продолжить терапию и дальше (р = 0,045 в сравнении с терапией с ЧИ) (6). С марта 2005 г. НовоРапид® разрешен к применению у детей в возрасте с двух лет.
При решении вопроса о пре- или постпрандиальном введении инсулиновых аналогов короткого действия можно учитывать пищевые привычки и предпочтения пациентов, прием пищи в общественных местах или дома. В ходе открытого, перекрестного 6-недельного исследования у 76 детей (в возрасте от 6 до 17 лет) в 9 Европейских центрах гликемический контроль при постпрандиальном введении инсулина аспарт был аналогичным таковому при препрандиальных инъекциях. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов (7).
В детском отделении ЭНЦ РАМН накоплен большой опыт по переводу на инсулины ультракороткого действия. В 3-месячном исследовании оценивалась динамика показателей гликемии натощак, постпрандиальной гликемии и HbA1c на фоне терапии инсулином НовоРапид® у 36 детей в возрастных группах до и старше 12 лет. В качестве базального компонента инсулинотерапии использовался инсулин НПХ. Результаты исследования показали, что применение инсулина НовоРапид® у детей приводит к существенному улучшению компенсации углеводного обмена, которое не сопровождалось увеличением дозы инсулина НовоРапид®, но требовалась коррекция дозы пролонгированного инсулина (8).
У большинства пациентов доза инсулина короткого действия при переходе с простого человеческого инсулина на аспарт сопоставима, хотя в некоторых случаях требуется незначительная ее коррекция. В зависимости от уровня препрандиальной гликемии инсулин аспарт вводится либо непосредственно перед едой, либо не более чем за 15 минут до еды. При низких показателях гликемии, гипогликемии, а также у маленьких детей, которые много времени тратят на прием пищи, инсулин НовоРапид® вводится после еды.
В последние годы значительно возросло использование инсулиновых помп в терапии СД у детей и подростков (9). Этот рост в первую очередь связан с использованием в них аналогов инсулина ультракороткого действия. В отличие от подкожного введения, при внутривенных вливаниях не отмечено никакого преимущества мономерных аналогов по сравнению с простым человеческим инсулином короткого действия. При подкожном введении в настоящее время в помпах используется инсулин только ультракороткого действия. При этом было доказано, что инсулин аспарт хорошо переносится при введении с помощью помпы, хорошо с ней совместим, имеет меньшую частоту кристаллизации, чем растворимый человеческий буферный инсулин.
Применение инсулиновых помп позволяет улучшить контроль гликемии, особенно у детей с плохим контролем в анамнезе, с одновременным снижением риска тяжелых гипогликемий (9). Последние исследования свидетельствуют не только об улучшении метаболического контроля, подтвержденного данными CGMS, но и об улучшении качества жизни пациентов на терапии помпой (10). В краткосрочном исследовании у детей и подростков терапия инсулиновым аналогом НовоРапид® в инсулиновой помпе обеспечила лучший контроль HbA1c и меньший прирост гликемии в сравнении с базис-болюсной терапией инсулиновыми аналогами (11).
В институте детской эндокринологии ЭНЦ накоплен 5-летний опыт клинического использования инсулиновых помп. Инсулин аспарт использовался у 83 пациентов в возрасте от 1,5 до 22 лет. Исходный уровень HbA1c в среднем составляя 9,1 ± 1,9%, через 3 месяца применения помповой терапии он снизился до 8,7 ± 1,2%, а через 6 месяцев – до 8,5 ± 1,2%.
Преимущества инсулиновых аналогов ультракороткого действия в интенсивной инсулинотерапии могут быть реализованы в полной степени при условии оптимизации базальной инсулинотерапии. Физиологическое воспроизведение базального уровня инсулинемии в инсулинотерапии во многом определяет возможность улучшения целевых показателей контроля, что особенно сложно достижимо на традиционных человеческих инсулинах с точки зрения высокого риска ночных гипогликемий у детей и подростков. Выраженный пик действия, вариабельность абсорбции, значительные интра- и межиндивидуальные различия фармакодинамического эффекта инсулина НПХ не позволяют достичь низкого, постоянного уровня инсулина плазмы.
Инсулиновый аналог пролонгированного действия Левемир®
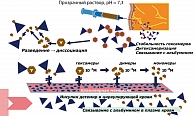
Левемир® – инсулин детемир, аналог инсулина длительного действия, с уникальным механизмом пролонгированного действия (12). Молекулярная структура инсулина детемир отличается от структуры человеческого инсулина отсутствием аминокислоты треонин в положении B30 и присоединением к лизину в положении B29 жирнокислотного остатка из 14 атомов углерода (С14) – миристиновой кислоты. Таким образом, к каждому мономеру инсулина детемир присоединена боковая цепочка миристиновой кислоты, которая может связываться с альбумином в депо (подкожно-жировой клетчатке), в циркуляции (кровяном русле) или в интерстиции (в органах-мишенях) (13). Ацилирование молекулы инсулина жирной кислотой не только обеспечивает связывание с альбумином, но также усиливает самоассоциацию гексамеров инсулина (12). В основном механизм пролонгированного действия инсулина обусловлен более длительным всасыванием из подкожного депо; обратимое связывание с альбумином в плазме также играет роль в некоторой дальнейшей пролонгации действия, но не такую существенную, как замедленное всасывание (14). Причем инсулин Левемир® остается в растворенном состоянии после инъекции. Так был устранен один из основных источников вариабельности действия препарата.
После инъекции инсулин детемир образует жидкостное депо в подкожно-жировой клетчатке (рисунок 2). Молекулы инсулина в растворе соединены в гексамеры. Как только введенный инсулин детемир попадает в интерстициальную жидкость, разведение раствора приводит к обратимой агрегации некоторых гексамеров, которые формируют ди-гексамеры. Такая агрегация происходит в результате контакта между цепями жирных кислот молекул инсулина. В дальнейшем происходит распад гексамеров на димеры и мономеры. Гексамеры и димеры проходят через капиллярную стенку очень медленно, а свободные мономеры инсулина детемир быстро проникают в циркуляцию. Большинство мономеров быстро связывается с молекулами альбумина сыворотки крови. Свободные мономеры инсулина детемир выходят из циркуляции и достигают тканей-мишеней (15).
В ткани-мишени инсулин детемир связывается с инсулиновым рецептором на мембране клеток-мишеней. Эффект инсулина детемир на подавление эндогенной продукции глюкозы и стимуляцию утилизации глюкозы не отличался от человеческого инсулина как на уровне мышечной, так и на уровне жировой ткани (16).
В течение многих лет проблема вариабельности инсулинов признавалась, но ее клиническая значимость не вызывала широкого интереса. Вариабельность действия инсулина приводит к непредсказуемым колебаниям уровня глюкозы в крови, повышает риск гипогликемий, ограничивает возможность достижения целевых показателей гликемии и в целом может приводить к снижению мотивации у пациентов (16).
Инсулин детемир обладает меньшей вариабельностью действия по сравнению с другими базальными инсулинами. Есть две возможных причины снижения вариабельности действия препарата: так как это растворимый инсулин, не требуется ресуспензирование препарата, а также в месте инъекции не образуются преципитаты (17). Кроме того, связывание с сывороточным альбумином обеспечивает очень важный буферный эффект, при котором любые изменения скорости всасывания в депо не приводят к немедленному изменению фармакодинамического ответа.
Фармакодинамические исследования показали, что инсулин детемир обладает более предсказуемым сахароснижающим эффектом, чем другие базальные инсулины (18). Предсказуемость действия препаратов инсулина во многом определяет успех аналоговой инсулинотерапии. Инсулин детемир обладает дозозависимой длительностью действия (19). При дозе инсулина детемир 0,4 Ед/кг длительность действия инсулина составляла 20 ч, при дозе более 0,4 Ед/кг длительность действия составляла 22-24 ч.
Безопасность применения инсулиновых аналогов
Вопросы безопасности новых лекарственных препаратов должны рассматриваться в процессе их разработки, до начала клинического применения. Согласно современным представлениям, инсулин аспарт считается безопасным препаратом. Аффинность к рецепторам инсулина близка к человеческому инсулину и составляет около 90%. Связь аспарта с рецептором ИФР-1 такая же, как у человеческого инсулина, а митогенная активность почти вдвое ниже, чем у человеческого инсулина. Замена аминокислоты в молекуле инсулина не сопровождалась изменением иммуногенных свойств аналогов. Концентрации антител к инсулину в группах больных, получавших простой человеческий инсулин и аспарт либо лизпро, не различались.
Инсулин детемир хорошо переносится пациентами, общий профиль побочных эффектов аналогичен таковому для инсулина НПХ. В открытом годичном исследовании, вовлекшем 308 пациентов с СД типа 1, серьезные побочные эффекты отмечались у 5,6% и 7,1% пациентов в группах терапии инсулином детемир и НПХ, соответственно (20).
Тесты in vitro, проведенные на человеческих клеточных линиях по оценке связывания с рецепторами к инсулину и инсулиноподобному фактору роста-1 (ИФР-1), показали, что детемир обладает более низким сродством к этим двум рецепторам и, соответственно, меньшим влиянием на рост клеток и митогенность, по сравнению с таковыми у человеческого инсулина (21).
Базис-болюсная аналоговая терапия: результаты клинических исследований
Многочисленные исследования продемонстрировали клинически значимые преимущества базис-болюсной аналоговой терапии в сравнении с интенсифицированной инсулинотерапией традиционными препаратами инсулина у взрослых, а затем подтверждены и у детей.
В 26-недельном, мультинациональном, открытом, рандомизированном, параллельном исследовании сравнивалась эффективность инсулина детемир и НПХ у 347 детей и подростков с СД типа 1. Инъекции инсулина детемир или НПХ делались 1 или 2 раза в день (в соответствии с режимом терапии до исследования); перед основными приемами пищи вводился инсулиновый аналог короткого действия аспарт. В исследовании приняли участие 140 пациентов препубертатного возраста и 207 – в период пубертата, с исходными показателями HbA1c 8,8 ± 1,2% (значение ± СО), в возрасте 11,9 ± 2,8 года, с ИМТ 19,2 ± 2,8кг/м2, стаж диабета 5 лет (от 1 до 15 лет).
Показатели HbA1c снизились на 0,8% и достигли 8,0% у всех пациентов, при этом средняя групповая разница составила (детемир / НПХ) 0,09 (95% ДИ: –0,12, 0,29). Уровень глюкозы в плазме натощак (ГПН) был достоверно ниже на фоне терапии инсулином детемир – 8,44 ммоль/л, в сравнении с инсулином НПХ – 9,58 ммоль/л, р = 0,022. Интраиндивидуальная вариабельность глюкозы плазмы натощак также была значимо ниже в группе терапии инсулином детемир (СО = 3,32 ммоль/л в сравнении с 4,29 ммоль/л соответственно, р < 0,001). Профили глюкозы плазмы (8 точек измерений) и значения глюкозы плазмы ночью были схожими в обеих группах терапии (р = 0,302 и р = 0,194, соответственно). Общий риск гипогликемий был одинаковым для инсулина детемир и НПХ (р = 0,351), в то время как риск ночных гипогликемий (22:00-07:00) был значимо (на 36%) ниже в группе базальной терапии инсулином детемир, чем на НПХ (р = 0,011) (22). В конце исследования ИМТ был меньше на инсулине детемир (19,3кг/м2 в сравнении с 19,8 кг/м2 на НПХ, р = 0,001). Общая безопасность терапии инсулином детемир была такая же, как у НПХ.
Таким образом, исследование у детей и подростков с СД типа 1 показало, что сочетание инсулина детемир и инсулина аспарт в базис-болюсной терапии позволяет реализовать преимущества каждого препарата и получить более выраженный клинический эффект в сравнении с инсулином НПХ в качестве базальной терапии: достоверно лучшие показатели гликемии натощак, значительно меньшую интраиндивидуальную вариабельность глюкозы натощак, снижение риска ночных гипогликемий и отсутствие увеличения массы тела (22).
Важным аспектом гибкости терапии у детей и подростков является возможность однократного или двукратного дозирования инсулина детемир в зависимости от индивидуальных потребностей пациента. Результаты исследований показывают, что потребность в базальном инсулине в течение суток может варьировать у разных возрастных групп в значительной степени. В частности, у молодых пациентов в возрасте до 20 лет потребность в базальном инсулине относительно выше в ночные часы, снижается в поздние утренние часы и постепенно повышается во второй половине дня (23). В связи с этим возможность индивидуального дозирования инсулина Левемир® позволяет подбирать базальную терапию в зависимости от потребности данного конкретного пациента в базальном инсулине.
Несомненную значимость представляет подтверждение результатов мультицентровых рандомизированных клинических испытаний в условиях повседневной клинической практики. С этой точки зрения актуальность представляют результаты PREDICTIVE™ – многоцентрового, наблюдательного исследования в повседневной клинической практике. Основная предпосылка исследования PREDICTIVE™ у детей и подростков с СД – возможность достижения целевого контроля без повышения риска гипогликемий.
С мая 2006 г. в России также стартовало исследование PREDICTIVE™. Цель российской части многоцентрового наблюдательного, открытого, 12-недельного исследования – оценка эффективности и безопасности применения инсулина Левемир® в детской практике, в когорте 400 детей с СД типа 1 в возрасте от 6 до 18 лет. Исследование завершено в конце 2006 г. В рамках 32-го ежегодного конгресса Международного общества по диабету у детей и подростков (ISPAD) впервые были представлены данные немецкой когорты детей и подростков, включенных в исследование PREDICTIVE™ (24). Проведен анализ терапии 113 детей и подростков с СД типа 1 (11% – в возрасте 0-11 лет; 89% – в возрасте 12-18 лет; средний возраст – 15,6 лет) со средней длительностью СД 5,6 лет. Исходный уровень HbA1c в целом по группе составил 8,5%; ИМТ – 22,5 кг/м2. Оценка безопасности и эффективности терапии проводилась через 14,5 недель после перевода на инсулин Левемир® в качестве базального компонента инсулинотерапии. В ходе исследования не было зарегистрировано серьезных побочных явлений. Частота гипогликемий достоверно снизилась с 35,7 пациенто-лет (за 4 недели до включения в исследование) до 10,5 к концу периода наблюдения (–25,2; p < 0,001). Снижение риска гипогликемий касалось в значительной мере и ночных эпизодов (с 7,8 до 1,4 пациенто-лет, p < 0,001). Контроль гликемии достоверно улучшился: HbA1c снизился на 0,6% (p < 0,001); уровень гликемии натощак – на 1,8 ммоль/л (p < 0,001); интраиндивидуальная вариабельность гликемии снизилась 0,6 ммоль/л (p < 0,01). Масса тела достоверно не изменилась (+ 0,23 кг в нед.); общая суточная доза инсулина также оставалась стабильной (+ 0,07 Ед/кг).
Таким образом, результаты наблюдательного исследования подтвердили данные клинических испытаний у детей и подростков: базис-болюсная терапия с инсулином детемир в качестве базального компонента обеспечивает улучшение контроля с меньшим риском гипогликемий и нейтральным эффектом на массу тела.
Еще одно значительное международное рандомизированное исследование, в котором принимали участие и российские исследователи, подтвердило эффективность и безопасность применения инсулина детемир у 82 маленьких пациентов в возрасте 2-5 лет (25). В первую очередь это касалось снижения частоты гипогликемий в течение суток, причем тяжелых гипогликемий при использовании инсулина детемир не было зафиксировано.
В Институте детской эндокринологии ЭНЦ проведено небольшое исследование эффективности инсулина Левемир® в реальной клинической практике. Проанализированы результаты перевода 76 детей и подростков в возрасте от 2 до 18 лет (средний возраст 10,3 ± 3,6). Из них 13% составляли дети в возрасте до 5 лет, 38% – 6-10 лет, 49% – старше 10 лет. Перевод осуществлялся с традиционных человеческих пролонгированных инсулинов (NPH) в той же дозе, при необходимости с последующей коррекцией дозы. Так же, как инсулин НПХ, Левемир® вводился дважды в сутки – перед завтраком и на ночь либо перед ужином. Показаниями для перевода являлись невозможность достичь целевых уровней гликемии натощак и гликированного гемоглобина (HbA1c), частые гипогликемии, нестабильность течения диабета. После перевода на инсулин Левемир® уровень гликемии натощак снизился в среднем с 11,8 до 8,6 ммоль/л, HbA1c – c 10,1 до 9,5%. Полученные данные по возрастным группам представлены в таблице 3.
Из представленных данных видно, что уровень гликемии натощак является наибольшей проблемой для детей старше 10 лет, и эта проблема с успехом решается, средний показатель гликемии натощак значительно снижается и приближается к целевому уровню. Содержание HbA1c хотя и снижается через 3 месяца, однако остается на достаточно высоком уровне. Однако, принимая во внимание тот факт, что у больных СД, особенно в подростковом возрасте, имеющих выраженную, длительную декомпенсацию углеводного обмена, рекомендуется постепенное достижение состояния компенсации во избежание провокации развития сосудистых осложнений (в первую очередь ретинопатии), полученные результаты в отношении динамики HbA1c считать оптимальными. У детей первых лет жизни применение инсулина Левемир® приводит к стабилизации течения заболевания, уменьшению колебаний показателей гликемического профиля. Соотношение дозы инсулина Левемир®, вводимого утром и вечером, составило в возрастной группе 0-5 лет – 1,5 : 1; 6-10 лет – 1 : 1; 10-18 лет – 1 : 1,5.
Эти данные подтверждают известный клиницистам факт, что потребность в базисном инсулине у детей первых лет жизни повышается в сторону дневного, а у подростков – в сторону ночного инсулина. В связи с этим двукратный режим введения инсулина Левемир®, позволяющий дозировать его ночной и дневной фон, является преимуществом данного вида инсулина у ряда больных.
Инсулиновые аналоги ультракороткого действия и беспиковые базальные инсулиновые аналоги в настоящее время признаны всем мировым медицинским сообществом как лучшие инсулиновые препараты, том числе и для применения в педиатрическое практике. Они рекомендованы к применению Американской диабетической ассоциацией в 2005 г.: «Комбинация быстродействующего инсулинового аналога и длительно действующего инсулина с отсутствием пика действия является отличным выбором для базисно-болюсной инсулинотерапии у детей и подростков» (ADA ststement, Diabetes Care, 2005; V 28, №1). Применение инсулиновых аналогов ультракороткого действия и беспиковых пролонгированных аналогов в детской практике также рекомендуется ISPAD Clinical Practice Consensus Guidelines 2006-2007 (Pediatriс Diabetes, 2007; V 8: 88-102).
В нашей стране все дети и подростки получают в настоящее время только самые современные, наиболее качественные инсулины – человеческие инсулины и их короткодействующие и пролонгированные аналоги. Около 90% детей и подростков с СД в РФ получают аналоги. В результате оптимизации инсулинотерапии происходит постепенное снижение основного показателя компенсации СД – уровня гликированного гемоглобина – в целом в популяциях детей и подростков. Широкое внедрение инсулиновых аналогов в практическое здравоохранение позволяет предотвращать либо значительно замедлять сроки развития тяжелых сосудистых осложнений, снизить инвалидизацию и значительно продлевать жизнь пациентов с СД.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.