Современные аспекты лечения ДГПЖ у сексуально активных пациентов
- Аннотация
- Статья
- Ссылки



По данным аутопсийных исследований первые признаки ДГПЖ обнаружены у 8% мужчин в возрасте от 31 до 40 лет (11). У мужчин старше 61 года частота этого заболевания достигает 70%, а после 80 лет – 90% (10). Практически у всех мужчин в течение жизни развивается микроскопическая ДГПЖ, у 50% – макроскопическая. В индустриально развитых странах объем хирургических вмешательств по поводу ДГПЖ занимает второе место среди объема всех хирургических операций, уступая лишь оперативному удалению катаракты.
Совокупность методов лечения ДГПЖ может быть представлена следующей классификацией:
- Оперативное лечение: открытая аденомэктомия, эндоскопические методы;
- Балонная дилатация простатической уретры, установка простатических стентов;
- Малоинвазивные термальные методы;
- Медикаментозная терапия ДГПЖ.
Многообразие методов свидетельствует о том, что ни один из них не является идеальным и требует определения своего места в структуре лечения ДГПЖ. Единым для всех способов лечения относительным показанием является наличие клинически проявляющейся ДГПЖ.
Если еще 15-20 лет назад реальной альтернативы оперативному лечению ДГПЖ практически не было, то в настоящее время существует много разнообразных консервативных методов. Медикаментозная терапия ДГПЖ – одна из наиболее динамично развивающихся областей урологии. Вместе с тем, механизмы действия некоторых препаратов изучены недостаточно, отсутствуют четкие показания к применению большинства лекарственных средств. Основные группы препаратов: уходящие в прошлое гормональные средства; ингибиторы 5-a-редуктазы; фитопрепараты; конечно же, ставшие «золотым стандартом» лечения, α-адреноблокаторы и прочие. В последнее время нередко используется сочетание лекарственных препаратов, относящихся к разным группам.
Гормональные препараты (а именно эстрогены) были по сути первыми и до недавнего времени основными лекарственными средствами, применявшимися при лечении ДГПЖ. Для этой цели, помимо эстрогенов и андрогенов, использовали аналоги ЛГРГ, гестагены, препараты с антиандрогенным и антиэстрогенным действием, а также ингибиторы ароматазы. Исследования, действительно, свидетельствовали о положительной динамике субъективных и объективных показателей (уродинамические показатели, объем простаты и др.). Вместе с тем, у большинства пациентов, получавших гормональные препараты, развились какие-либо побочные реакции. При применении препаратов «центрального» действия (эстрогенов, антиандрогенов, аналогов ЛГРГ), по данным А.В. Сивкова, были отмечены эректильная дисфункция, снижение либидо, приливы, гинекомастия, ухудшение сердечной деятельности. Нестероидные антиандрогены, помимо гинекомастии, вызывают желудочно-кишечные расстройства и нарушения половой функции (в основном либидо и эрекции). В настоящее время наиболее перспективными гормональными препаратами являются антиэстрогены и ингибиторы ароматазы, однако и они не могут быть использованы в монотерапии ДГПЖ.
В настоящее время одним из основных факторов развития ДГПЖ признается дисбаланс между тестостероном и его более активным производным – дигидротестостероном (ДГТ), в виде которого он и действует после завершения дифференцировки структур мужского мочеполового тракта. Андрогены играют основную роль в возрастной пролиферации стромального и эпителиального компонентов простаты и других процессах, приводящих к увеличению ПЖ. ДГТ, обладающий вдвое большей андрогенной активностью по сравнению с тестостероном (в клетках ПЖ – в 5 и более раз), имеет и большее сродство к глобулину, связывающему половые гормоны. Концентрация ДГТ в крови здоровых мужчин достаточно низка, так как этот гормон образуется из тестостерона непосредственно в чувствительных клетках. У больных ДГПЖ, напротив, выявлено значительное повышение ДГТ в сыворотке на фоне пониженного уровня тестостерона. У данных пациентов также повышена внутриклеточная активность фермента 5-a-редуктазы, восстанавливающего тестостерон в ДГТ. Это позволило получить выраженный клинический эффект при применении препаратов, подавляющих активность 5-a-редуктазы. К ним относятся финастерид, дутастерид, туростерид, эпистерид и другие препараты, в том числе растительного происхождения. Применение финастерида приводит к атрофии стромальной (после 3 мес.) и железистой (после 6 мес. приема препарата) ткани, причем объем последней в простате уменьшается примерно на 50%. Также снижается эпителиально-стромальное соотношение, преимущественно в транзиторной зоне, и происходит замедление роста и снижение плотности сосудов микроциркуляторного русла. Эти изменения в органе приводят к уменьшению объема ПЖ, механического компонента инфравезикальной обструкции и, соответственно, ее степени. Наиболее выраженные и стабильные результаты наблюдаются у пациентов с преобладанием эпителиальной ткани в ПЖ и объемом последней более 50 см3. К недостаткам препарата относят необходимость приема в течение длительного времени (эффект проявляется не ранее, чем через 6 мес. после начала лечения). Несмотря на отсутствие выраженных побочных эффектов, характерных для гормональных препаратов, финастерид также вызывает нарушения сексуальной функции (ухудшение качества спонтанных и адекватных эрекций и снижение либидо). По данным разных авторов, преходящая эректильная дисфункция развивается у 3-58% пациентов. Другие побочные эффекты – уменьшение объема эякулята, гинекомастия и чувство тяжести в грудных железах, а также снижение уровня PSA сыворотки крови, что может затруднять раннюю диагностику рака ПЖ.
Препараты растительного происхождения представлены в основном экстрактами липидостероловой природы американской саговой пальмы (Serenoa repens) и дикой камерунской сливы (Pygeum africanum). Механизм действия их изучен недостаточно. Предположительно, лечебный эффект при применении этих лекарственных средств обусловлен противовоспалительным действием вследствие угнетения синтеза простагландинов, цитотоксическим действием на клетки гиперплазии, а также влиянием на тканевые факторы роста. Действие полиенового макролида мепартрицина основано на связывании в кишечнике стеролов, входящих в состав содержимого ацинусов ПЖ, а также снижении уровня эстрогенов сыворотки крови. Экстракты ПЖ крупного рогатого скота оказывают противовоспалительное действие, а также ингибируют пролиферацию эпителия парауретральных желез и повышают тонус детрузора.
Блокаторы a1-адренорецепторов (α1-АР) стали стандартными препаратами в терапии ДГПЖ. Исследованиями последних лет доказана ведущая роль a1-АР в патогенезе заболевания. Стимуляция их повышает тонус гладкомышечных элементов шейки мочевого пузыря, простатического отдела уретры и простаты, поддерживая в значительной степени внутриуретральное давление. Сократительная функция простаты также находится под контролем a1-АР, которые локализуются преимущественно в стромальных элементах железы, занимающих до 60% объема органа. Эти эффекты активации a1-АР, а также увеличение их количества и плотности в ткани простаты при ДГПЖ, по данным S. Yamada et al., приводят к развитию динамического компонента инфравезикальной обструкции. Кроме того, по мере прогрессирования ДГПЖ развиваются функциональные и морфологические изменения детрузора, сопровождающиеся гипоксией гладкомышечных элементов и приводящие к нарушениям биохимических процессов (в т.ч. энергетического баланса) в клетках детрузора (5).
Исходя из этого, блокаторы a-АР должны не только уменьшать уретральное сопротивление за счет снижения тонуса гладкой мускулатуры простаты и уретры, но и устранять вторичные изменения детрузора в результате улучшения кровоснабжения мочевого пузыря, влияя таким образом на устранение динамического компонента ИВО. В настоящее время наибольшее распространение при лечении ДГПЖ получили так называемые селективные a-блокаторы, действующие на подтип 1 a-АР: альфузозин, теразозин, доксазозин. Эффективность их в устранении обструктивной и особенно ирритативной симптоматики примерно одинакова (на 30-45% по данным В. Djavan, M. Marberger), тогда как выраженность побочных эффектов вследствие снижения артериального давления (ортостатической гипотензии, сонливости, головокружения, сердцебиения и тахикардии) различна (12). При этом частота возникновения нежелательных явлений зависит от суточной дозы препарата и продолжительности курса лечения. Это заставляет врача, постепенно титруя, подбирать эффективную и безопасную дозу. Менее всего влияет на артериальное давление тамсулозин, селективный антагонист a-АР, действующий на подтип 1А. Эта разновидность, составляющая 70% всех a1-АР, локализуется преимущественно в простате. Возможно, именно эти рецепторы играют наибольшую роль в развитии динамического компонента ИВО. Клинические данные свидетельствуют о высокой эффективности препарата: уменьшение симптомов на 20,1%, увеличение Qmax на 12,6% и снижение давления детрузора на 13,2% при минимальном количестве побочных реакций (2,9%) (8). Быстрое наступление клинического эффекта позволяет использовать блокаторы a1-АР и при острой задержке мочеиспускания на фоне дренирования мочевого пузыря уретральным катетером. В настоящее время a1-адреноблокаторы все чаще используются вместе с ингибиторами 5-a-редуктазы для воздействия как на динамический, так и на механический компоненты обструкции.
Для многих мужчин, страдающих ДГПЖ, важно сохранение половой функции в процессе лечения основного заболевания. Среди опрошенных 350 пациентов в возрасте старше 60 лет 87% желали бы улучшить качество сексуальных отношений, среди них 79% имели неизмененное стабильное сексуальное влечение (2). Согласно данным О.К. Аромире и соавт. (2001), проведено исследование состояния копулятивной функции у 550 состоявших в браке мужчин пожилого возраста, страдающих ДГПЖ. У 32,72% пациентов отмечалась жалоба на неудовлетворительное качество адекватных эрекций. У 69,9% в связи с этим отмечалось в определенной степени депрессивное состояние. При детальном их расспросе выявлено, что причиной этому были и мысли об имеющейся или ожидаемой половой неполноценности.
Несмотря на большое количество современных препаратов разных групп, применяемых для лечения ДГПЖ, влияние их на эректильную функцию до настоящего времени остается неоднозначным (примерами являются упомянутые выше нестероидные антиандрогены и ингибиторы 5-a-редуктазы). Вместе с тем, в настоящее время вопрос об изменении или улучшении отдельного составляющего копулятивной функции при медикаментозном лечении ДГПЖ пока открыт, так как слишком неоднозначны его результаты. Мы поставили перед собой задачу дальше изучать эту проблему, назначая пациентам препараты из группы a-блокаторов. Это вызвано тем, что с точки зрения биохимии и фармакодинамики длительный прием a-блокаторов может вызывать как ожидаемое улучшение качества мочеиспускания и эректильной функции, так и гиперпролактинемию, последняя же может привести к нарушению либидо и эрекции. В НИИ урологии Росмедтехнологий проведено клиническое исследование действия препарата Сетегис (теразозин) (EGIS, Венгрия) на эректильную функцию пациентов, получающих консервативную терапию по поводу ДГПЖ.
Цель исследования: дать оценку действия препарата Сетегис (теразозин) (EGIS, Венгрия) на эректильную функцию пациентов, страдающих ДГПЖ.
Материалы и методы исследования
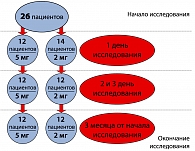
В НИИ урологии Росмедтехнологий было обследовано 26 сексуально активных пациентов в возрасте от 52 до 68 лет (средний возраст 58,4 года) с диагнозом ДГПЖ, актуальной задачей для которых являлось сохранение или улучшение половой функции. Дизайн исследования представлен на рисунке 1.
Для оценки оптимальной суточной дозировки препарата все пациенты были разделены на две группы: 1 группа (14 человек) получала препарат в дозировке 5 мг/сут, 2 группа (12 человек) – 2 мг/сут. Длительность наблюдения составила 3 мес. В 1-й группе 2 пациента были исключены из исследования на 2-й и 3-й день вследствие ортостатической гипотензии, сопровождающейся общим недомоганием и чувством тошноты. Данные симптомы купировались самопроизвольно после прекращения приема препарата и не потребовали какой-либо дополнительной медицинской помощи.
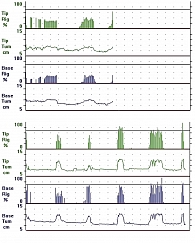
Терапевтическая эффективность Cетегиса определялась на основании улучшения основных диагностических критериев и параметров, таких, как положительная динамика характеристик эрекции при улучшении качества самостоятельного мочеиспускания. Оценку качества мочеиспускания производили, анализируя анкеты IPSS, а также данные урофлоуметрии с определением объема остаточной мочи. Для оценки качества эректильной функции все пациенты заполняли анкеты IIEF (Международная шкала оценки половой функции) и МКФ (шкала количественной оценки мужской копулятивной функции) (5). Дважды (до и после курса терапии) каждому пациенту производилась регистрация ночных пенильных тумесценций с помощью аппарата «RigiScan». Критериями положительной динамики являлось повышение частоты возникающих ночных тумесценций, их интенсивности и продолжительности.
Результаты исследования
Все пациенты были обследованы согласно протоколу настоящего исследования. Основные результаты представлены в таблице 1 и на рисунках 2, 3.
Приведенные данные демонстрируют дозозависимый эффект препарата на положительную динамику не только субъективных параметров мочеиспускания (снижение симптоматики по шкале IPSS, QoL), но и объективных данных (объем остаточной мочи). При этом показатели, полученные при анкетировании (шкалы IIEF, МКФ), демонстрировали достоверное улучшение эректильной функции в обеих группах, однако положительная динамика была более выражена у пациентов, принимавших препарат в дозировке 5 мг. Позитивные изменения параметров мочеиспускания и эректильной функции коррелировали с результатами RigiScan-мониторинга ночных пенильных тумесценций (рисунок 4).
Таким образом, улучшение качества самостоятельного мочеиспускания в 1-й группе пациентов отмечено в 12 случаях (100%), улучшение ЭФ – у 8 больных (66,7%), во 2-й группе мочеиспускание улучшилось у 10 человек (83,3%), а лучшее качество эрекции отметили 5 пациентов (41,7%).
Обсуждение результатов
Блокируя a1-адренорецепторы гладких мышц треугольника и шейки мочевого пузыря, проксимальной части уретры и ПЖ, Сетегис уменьшает уретральное сопротивление и нормализует мочеиспускание у больных ДГПЖ. Препарат вызывает расширение артериол и венул. Уменьшает общее периферическое сопротивление сосудов и венозный возврат к сердцу, снижает пред- и постнагрузку на сердце и АД. Длительное лечение Сетегисом обычно не вызывает развития рефлекторной тахикардии. Сетегис незначительно влияет на сердечный выброс, перфузию почек и скорость клубочковой фильтрации. Выраженный терапевтический эффект развивается через 3 ч после приема препарата. После приема разовой дозы гипотензивный эффект сохраняется в течение 24 ч.
Расширение сосудов артериального русла происходит не только в вышеперечисленных органах (например, пузырных артерий), но и в анатомических структурах полового члена. Это способствует большему его кровенаполнению во время эрекции и улучшению ее качества.
Заключение
Данные проведенного исследования свидетельствуют об эффективности и удобстве применения блокаторов a1-АР в консервативном лечении больных ДГПЖ, заинтересованных в сохранении или улучшении эректильной функции. Для таких пациентов эти препараты могут стать препаратами выбора.
Сетегис, используемый в консервативной терапии аденомы простаты, оказывает положительное влияние на пенильную гемодинамику, что является, с нашей точки зрения, важным «побочным» эффектом у пациентов пожилого возраста.
Данные проведенного исследования свидетельствуют об эффективности препарата Сетегис в консервативном лечении пациентов, страдающих ДГПЖ, которые заинтересованы в сохранении или улучшении эректильной функции.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.