Современные подходы к диагностике и терапии ALK-позитивного немелкоклеточного рака легкого. Конференция «Лучшее по материалам международных конференций и симпозиумов – 2015: Запад». Сателлитный симпозиум компании Pfizer
- Аннотация
- Статья
- Ссылки
На симпозиуме (г. Сочи, 4 июля 2015 г.), организованном при поддержке компании Pfizer, ведущие российские специалисты в области онкологии, молекулярно-генетических исследований, химиотерапии обсудили вопросы диагностики и лечения ALK-позитивного НМРЛ в нашей стране.
На симпозиуме (г. Сочи, 4 июля 2015 г.), организованном при поддержке компании Pfizer, ведущие российские специалисты в области онкологии, молекулярно-генетических исследований, химиотерапии обсудили вопросы диагностики и лечения ALK-позитивного НМРЛ в нашей стране.


Современные методы диагностики ALK-позитивного немелкоклеточного рака легкого
О роли транслокаций в онкогенезе и современных методах, используемых для обнаружения реаранжировки гена ALK (Anaplastic Lymphoma Kinase – киназа анапластической лимфомы), рассказала заведующая молекулярно-биологической лабораторией Московской городской онкологической больницы № 62 Департамента здравоохранения г. Москвы, к.м.н. Ирина Анатольевна ДЕМИДОВА.
Долгое время транслокации считались характерными в большей степени для мезенхимальных и гематологических опухолей, чем для новообразований эпителиоидной природы. Вероятно, это было связано с ограниченными возможностями цитогенетических методик. Сегодня известно свыше 280 генов, участвующих в реаранжировках при злокачественных опухолях.
Однако реаранжировки, активирующие тирозинкиназы, являющиеся своеобразными двигателями онкогенеза, достаточно редки.
ALK является рецепторной тирозинкиназой семейства инсулинзависимых рецепторов. Основная функция этого рецептора состоит в передаче сигнала, полученного от химического вещества-стимулятора, или лиганда (плейотропина и мидкина), в клетку. В нормальной клетке рецептор ALK активно экспрессируется в нервной ткани в эмбриональном периоде развития. Во взрослом возрасте экспрессия крайне низка и привязана к определенным типам тканей (головной мозг, кишечник, простата). Рецептор ALK участвует в активации путей PI3K, RAS/MAPK, JAK/STAT, PLCy, индуцируя пролиферацию клеток1.
Транслокации с участием гена ALK – наиболее яркий пример, описанный для ряда опухолей. Впервые транслокация с участием гена ALK при немелкоклеточном раке легких (НМРЛ) была описана M. Soda и соавт. в 2007 г. Наиболее частый механизм образования (95%) – парацентрическая инверсия 2р и образование химерного онкогена EML4/ALK, обычно с частичной делецией 5´ последовательностей ALK. Межхромосомные перестройки с участием других генов-партнеров ALK – KIF5B, TGF, KLC1 встречаются значительно реже2.
Известно как минимум 13 типов химерного транскрипта EML4/ALK. Во всех случаях в транслокации участвует тирозинкиназный домен ALK. Как правило, в формировании транскрипта химерного гена задействован 20-й (редко 19-й) экзон ALK. Химерные протеины экспрессируются с различной интенсивностью, отличаются конформационными особенностями и скоростью распада3.
Основным методом выявления перестроек гена ALK является метод флуоресцентной in situ гибридизации (fluorescence in situ hybridization – FISH). Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) рекомендует метод с использованием пробы LSI ALK Break Apart Rearrangement Probe (США). Существуют пробы Dako, Metasystems, Abnova, а также Kreatech, ZytoVision для определения слитного сигнала EML4/ALK.
Преимущество метода FISH заключается в возможности распознавать практически все виды перестроек гена ALK независимо от второго партнера транслокации, пригодности для исследования архивных блоков, цитологических препаратов, отпечатков и др.
К недостаткам метода относятся его существенная дороговизна и достаточно высокие требования к качеству образца и количеству опухолевых клеток (минимум 50) в нем, наличие у исполнителя соответствующей квалификации.
FDA рекомендует обязательное применение метода FISH для подтверждения реаранжировки ALK после любого скринингового метода. При подсчете необходимо учитывать следующее. Должно быть не менее 50 ядер в четырех различных зонах опухоли, критерием разрыва является расстояние между сигналами в два красных сигнала, а пороговый уровень составляет не менее 15% ядер с перестройкой. При обнаружении более 20%, но менее 50% ядер с перестроенным сигналом необходимо подсчитать образец с помощью второго специалиста.
При тестировании транслокаций ALK методом FISH встречаются сложные случаи: небольшое количество клеток в препарате, дефекты преаналитической фазы, трудности в проведении анализа и интерпретации результатов исследования. Сложности преаналитической фазы при проведении FISH-теста связаны прежде всего с длительностью периода до начала фиксации и фиксации препарата. Если фиксация длится более 72 или менее шести часов, препарат становится непригодным для анализа.
При проведении FISH-теста могут возникать сложности с интерпретацией результатов исследования. Внутрихромосомные перестройки нередко приводят к минимальному разделению сигналов, что при неправильной интерпретации может дать ложноотрицательные результаты. По данным докладчика, при типичной инверсии расстояние между двумя сигналами составляет всего 12,5 Мб. Применение рекомендованного порогового уровня разрыва в размере двух сигналов чревато ошибкой. Иногда при длительной обработке пепсином возникает подобный артефакт – сигналы лежат раздельно, не образуя слитный желтый сигнал.
При увеличении копийности неперестроенного гена может наблюдаться ложнопозитивная картина из-за механического разделения сигналов во время нарезки образца.
Зачастую трудности возникают при анализе цитологических препаратов и плеврального выпота. И.А. Демидова подчеркнула, что образцы у пациента должны быть взяты специалистом-цитологом при соблюдении всех норм по окрашиванию и подготовке биоптата. FISH-методом можно проводить исследования окрашенных препаратов.
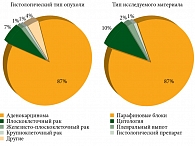
В рамках проекта «Совершенствование системы молекулярно-генетической диагностики онкологических заболеваний в Российской Федерации» (2013–2014 гг.) было протестировано 2334 пациента на предмет перестройки гена ALK при НМРЛ без мутаций EGFR. Мутация ALK выявлена в 7% случаев, в 78% она отсутствовала, в 15% наличие мутации не определено из-за низкого качества препаратов4. Материал и методы тестирования показаны на рис. 1. При анализе гистологических типов опухоли установлено, что в большинстве случаев (87%) преобладала аденокарцинома.
И.А. Демидова продемонстрировала результаты исследования, проведенного на базе Московской городской онкологической больницы № 62 в 2014 г. В исследовании тестировали 48 пациентов одновременно с помощью двух методов – иммуногистохимического (ИГХ) и FISH. Выявлено три позитивных случая (6,25%). Конкордантность двух методов составила 100%. Не удалось выполнить тестирование двумя методами у трех пациентов, методом ИГХ – у одного (2%), методом FISH – у пяти (10,4%) больных. Основной причиной неудачного тестирования стало низкое качество образцов. Далее 175 пациентов протестировали первоначально методом ИГХ, позитивные и сомнительные случаи – методом FISH. Не удалось выполнить тестирование методом ИГХ в 12 (6,8%) случаях из-за отсутствия опухолевой ткани в образце. Из всех протестированных методом ИГХ на FISH-анализ отправлено 14 (8%) образцов.
Несмотря на широкое распространение метода, при применении ИГХ могут встречаться артефакты. Ложнопозитивное окрашивание может быть обусловлено неспецифическим связыванием антител со структурами гликокаликса и неизвестными протеинами в цитоплазме альвеолярных макрофагов. Ложнонегативная реакция отмечается при нарушениях фиксации, слабой экспрессии протеина и невидимой для антитела конформационной структуре при редком партнере ALK по транслокации.
ИГХ считается эффективным методом, позволяющим выявить высокую экспрессию химерного протеина в цитоплазме опухолевых клеток. Однако следует помнить, что при выявлении сомнительных или положительных результатов тестирования необходимо проводить FISH-анализ образцов.
Конкордантность данных двух методов составила 85,70%.
Таким образом, два метода показали хорошую конкордантность в исследовании. Процент неудач в тестировании оказался значительным, что обусловлено отсутствием опухолевой ткани в образце или его низким качеством. Отметим, что все позитивные, а также сомнительные случаи, определенные методом ИГХ, требуют использования FISH-анализа.
Ксалкори – стандарт терапии метастатического ALK-позитивного НМРЛ. Описание клинических случаев
Руководитель радиологического центра Главного военного клинического госпиталя им. Н.Н. Бурденко, к.м.н. Алексей Владимирович СМОЛИН на основании собственного клинического опыта продемонстрировал результаты лечения больных ALK-позитивным НМРЛ препаратом Ксалкори (кризотиниб). Он представил успешные результаты клинических исследований у пациентов с ALK-позитивным НМРЛ, подтвердившие высокую эффективность препарата Ксалкори и послужившие основой для разработки новой тактики терапии таких пациентов.
Еще совсем недавно в нашей стране отсутствовала эффективная терапия ALK-позитивного НМРЛ. ALK-позитивные опухоли легкого демонстрируют высокую степень злокачественности и резистентность к традиционной химиотерапии.
Развитие нового метода лечения – молекулярно-направленной терапии и появление Ксалкори (кризотиниб) позволили совершить революцию в терапии ALK-позитивного НМРЛ, значительно улучшив показатели выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ).
Результаты первых клинических исследований (PROFILE 1001 и PROFILE 1005) продемонстрировали высокую частоту ВБП и объективного ответа у пациентов с ALK-позитивным НМРЛ на фоне применения кризотиниба. На основании результатов исследований Ксалкори был одобрен для клинического применения и зарегистрирован во всем мире.
PROFILE 1014 – первое проспективное рандомизированное исследование III фазы, в котором сравнивали таргетную терапию препаратом Ксалкори (кризотиниб) со стандартной химиотерапией первой линии при распространенном или метастатическом ALK-позитивном НМРЛ.
343 пациента с распространенным и метастатическим ALK-позитивным несквамозным НМРЛ, которые не получали предшествующего системного лечения, были случайным образом распределены в две группы: открытого лечения кризотинибом (172 пациента) в дозе 250 мг два раза в сутки и химиотерапии (171 пациент) – внутривенно пеметрексед 500 мг/м2 + цисплатин 75 мг/м2 или карбоплатин, целевая AUC 5–6 мг/мл/мин каждые три недели до шести циклов.
Пациентам в группе химиотерапии был разрешен переход на лечение кризотинибом после прогрессирования заболевания.
Первичной конечной точкой исследования служила ВБП по данным независимой радиологической экспертизы, вторичными – общая выживаемость, профиль безопасности, частичный и общий ответ5.
Частота объективного ответа в группе кризотиниба составила 75% (95%-ный доверительный интервал (ДИ) 67–81), а в группе химиотерапии – 45% (95% ДИ 37–53).
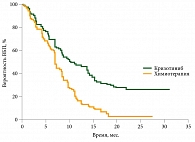
Данные исследования PROFILE 1014 подтвердили, что применение препарата Ксалкори в первой линии терапии у пациентов с ALK-позитивным распространенным НМРЛ значительно увеличивает ВБП (рис. 2). Медиана ВБП в группе кризотиниба составила 10,9 месяца, в группе химиотерапии – 7 месяцев (относительный риск (ОР) 0,45; 95% ДИ 0,35−0,60), то есть увеличилась почти на четыре месяца.
Поскольку на момент окончания сбора данных было зарегистрировано только 26% летальных исходов от всех причин, через 17 месяцев наблюдения ни в одной группе не была достигнута медиана общей выживаемости. Кроме того, анализ не учитывал потенциальные искажающие эффекты перехода между группами (70% пациентов из группы химиотерапии получили кризотиниб после прогрессирования).
Нежелательные явления терапии в группе кризотиниба наблюдались реже, чем в группе химиотерапии, и соответствовали известному профилю безопасности препарата Ксалкори.
Таким образом, результаты исследования PROFILE 1014 продемонстрировали достоверную эффективность кризотиниба в сравнении с химиотерапией по показателю ВБП у пациентов с метастатическим ALK-позитивным НМРЛ. Применение кризотиниба в качестве первой линии терапии достоверно увеличило ВБП и ассоциировалось с более высокой частотой ответа, улучшением оцениваемых пациентами параметров физического функционирования, симптомов НМРЛ (кашля, одышки, боли в грудной клетке и утомляемости) и общего качества жизни (по сравнению с химиотерапией).
По данным исследования, начало первой линии терапии кризотинибом у пациентов с НМРЛ с подтвержденным маркером эффективности терапии – транслокацией гена ALK обеспечивает максимальную вероятность получения клинической пользы.
А.В. Смолин привел пример из собственной клинической практики.
Больной Ц., 35 лет. Стаж курения около 15 лет (20 сигарет в сутки). Зимой 2014 г. впервые отметил болезненность в левой половине грудной клетки. Рентгенологически выявлена инфильтрация верхней доли левого легкого, что было расценено как внебольничная пневмония. Больному был проведен курс антибактериальной терапии с положительной динамикой. Осенью того же года пациент вновь отметил боли в левой половине грудной клетки. При компьютерной томографии (КТ) с контрастированием выявлены большой левосторонний гидроторакс, патологическое образование верхней доли легкого до 1,8 см, множественные мелкие очаги до 0,6 см, лимфаденопатия средостения (увеличение узлов до 1,5 см), тромбоз S1 сегментарной вены, деструкция 8-го и 9-го ребер слева с наличием небольшого мягкотканного компонента. Пациенту выполнили пункцию левой плевральной полости – эвакуировано 2300 мл жидкости. При цитологическом исследовании обнаружены клетки аденокарциномы. В ходе видеоторакоскопии диагностировано обширное метастатическое поражение плевры. При гистологическом исследовании биоптата плевры обнаружена морфологическая картина метастаза первичной аденокарциномы легкого. Магнитно-резонансная томография (МРТ) показала наличие солитарного метастаза (8 мм) правой теменной доли головного мозга с зоной перифокального отека.
На основании проведенных исследований пациенту поставлен диагноз: периферический рак (аденокарцинома) верхней доли левого легкого с метастазами в плевре слева, лимфатических узлах средостения, головном мозге, костях скелета, T2N2MIb, стадия IV.
У пациента развился болевой синдром 8–9 баллов по шкале ВОЗ, потребовавший использования наркотических анальгетиков.
При FISH-анализе в образце ткани опухоли выявлена перестройка в гене ALK, предполагающая высокую чувствительность опухоли к терапии препаратом Ксалкори (кризотиниб). Через месяц терапии препаратом отмечен полный регресс болевого синдрома. Данные КТ (март 2015 г.) продемонстрировали частичный регресс экстракраниального опухолевого поражения, уменьшение метастазов в головном мозге. Больной отметил значительное повышение качества жизни, восстановление работоспособности. По результатам контрольной КТ (май 2015 г.) наблюдалась дальнейшая положительная динамика.
Сравнению кризотиниба и стандартной химиотерапии второй линии у пациентов с ALK-позитивным НМРЛ, ранее получавших лечение на основе платиносодержащих режимов, посвящено исследование PROFILE 1007.
В этом исследовании пациенты были рандомизированы на две группы. 173 пациента первой группы получали Ксалкори в дозе 250 мг два раза в сутки, 174 пациента второй – пеметрексед 500 мг/м2 или доцетаксел в дозе 75 мг/м2 внутривенно в первый день. Цикл – 21 день. Дизайном исследования допускалось наличие метастазов в головном мозге.
Основной конечной точкой исследования была частота ВБП, вторичными точками – частота объективных ответов, общая выживаемость, безопасность, оценка качества жизни пациентом6.
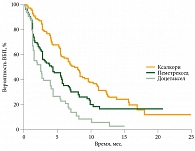
Результаты исследования PROFILE 1007 продемонстрировали, что показатели ВБП у пациентов с ALK-позитивным распространенным НМРЛ, ранее получавших лечение, значительно улучшились на фоне приема препарата Ксалкори по сравнению с однокомпонентной химиотерапией. Медиана ВБП в группе Ксалкори составила 7,7 месяца, в группе пеметрекседа – 4,2 (ОР 0,59; 95% ДИ 0,43−0,80), в группе доцетаксела – 2,6 месяца (ОР 0,30; 95% ДИ 0,21−0,43) (рис. 3).
Частота объективных ответов в группе кризотиниба составила 65% (95% ДИ 58−72), в группе химиотерапии – 20% (95% ДИ 14−26).
Таким образом, Ксалкори зарекомендовал себя как препарат выбора первой и второй линий терапии у пациентов с ALK-позитивным распространенным НМРЛ.
Докладчик привел данные еще одного клинического наблюдения.
Больная К., 35 лет. С ноября 2013 г. беспокоили боль в межлопаточной области при движениях и редкий сухой кашель. Основные жалобы пациентки при поступлении в стационар – нарастающая одышка при физической нагрузке, выраженная общая слабость. Рентгенологически были выявлены полиморфные очаговые тени по всем легочным полям и усиление легочного рисунка. После обследования был исключен туберкулез. Выполнена трансторакальная игловая биопсия 3-го сегмента правого легкого. По результатам ИГХ-исследования сделано заключение, что морфологическое строение и иммунофенотип соответствуют папиллярной аденокарциноме легкого. Проведена пункция перикарда. Эвакуировано 700 мл геморрагического выпота. Цитологическое исследование показало картину аденокарциномы. У больной диагностирован центральный рак (низкодифференцированная аденокарцинома) верхней доли правого легкого T4N0M1 с массивным метастазированием обоих легких, правосторонний гидроторакс, гидроперикард.
Пациентке назначили два курса химиотерапии по следующей схеме: карбоплатин 600 мг внутривенно в первый день, паклитаксел 300 мг внутривенно в первый день на фоне стандартной премедикации и антиэметиков. На фоне лечения состояние ухудшилось – отмечались нарастание опухолевой интоксикации, дыхательная недостаточность, кровохарканье, фебрильная лихорадка, рецидивирование плеврита, перикардит с угрозой тампонады, требующий еженедельных пункций перикарда. Это свидетельствовало о рефрактерности опухоли к платиносодержащей химиотерапии и прогрессировании опухолевого процесса.
При FISH-анализе в образце ткани опухоли выявлена перестройка в гене ALK. Больной назначили таргетную терапию препаратом Ксалкори 250 мг два раза в сутки. На фоне терапии исчезли одышка, кровохарканье, нормализовалась температура тела. Данные КТ продемонстрировали частичный регресс опухоли. Пациентка отметила улучшение качества жизни, вышла на работу.
Несмотря на преимущества терапии кризотинибом, при ALK-позитивном раке легкого со временем заболевание прогрессирует из-за плохого проникновения препарата в центральную нервную систему или развития клеточной резистентности к нему. Одним из первых обнаруженных механизмов возникновения резистентности стали мутации в домене ALK-киназы.
Как известно, в большинстве случаев у пациентов с ALK-позитивным раком легкого злокачественный процесс распространяется в головной мозг.
Так, в июне 2015 г. больная К., получавшая терапию Ксалкори, предъявила жалобы на головные боли, снижение памяти. При МРТ выявлено множественное метастатическое поражение головного мозга.
В настоящее время при изолированном прогрессировании в головном мозге без прогрессирования в основном очаге рекомендуется продолжать таргетную терапию кризотинибом, использовать хирургические и лучевые методы лечения. При множественных поражениях головного мозга, как в рассмотренном клиническом случае, показано тотальное облучение головного мозга.
По данным последних исследований, для предотвращения возникновения и роста метастазов в головном мозге больных раком легкого, у которых заболевание прогрессировало после лечения кризотинибом, можно применять препарат алектиниб. Это высокоселективный ингибитор ALK с потенциальной активностью при большинстве вторичных ALK-резистентных мутаций. Концентрация алектиниба в головном мозге сопоставима с таковой в плазме. Установлено, что алектиниб уменьшает объем опухоли у пациентов, у которых заболевание распространилось на центральную нервную систему7, 8.
По мнению докладчика, у больных распространенным НМРЛ с метастазами в головном мозге после терапии кризотинибом можно продолжать лечение алектинибом. Эта схема лечения способна продлить выживаемость до 20 месяцев, что является хорошим результатом у больных указанной группы.
Данные исследований подчеркивают важность использования в лечении онкологических заболеваний новых методов таргетной терапии, а также разработки оптимального режима для каждого пациента.
В заключение А.В. Смолин отметил, что применение препарата Ксалкори признано стандартом лечения метастатического ALK-позитивного НМРЛ в первой и последующих линиях терапии.
Заключение
Ксалкори демонстрирует выраженную противоопухолевую эффективность у пациентов с ALK-позитивным НМРЛ, значительно увеличивая медиану выживаемости без прогрессирования по сравнению со стандартной химиотерапией первой или второй линии.
Ксалкори отличают высокий уровень безопасности, допустимое проявление нежелательных побочных эффектов, а также значительное улучшение качества жизни больных метастатическим НМРЛ.
Ксалкори – первый и единственный таргетный препарат для лечения пациентов с метастатическим ALK-позитивным НМРЛ, зарегистрированный в России.
Препарат Ксалкори признан стандартом лечения пациентов с ALK-позитивным НМРЛ в первой и последующих линиях терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.