Современные подходы к лечению рака шейки матки
- Аннотация
- Статья
- Ссылки


В развивающихся странах заболеваемость РШМ занимает первое место среди новообразований гениталий, в экономически развитых странах – третье после рака тела матки и яичников. В Африке, Центральной и Южной Америке и Азии (за исключением Японии) на долю РШМ приходится 20–30% всей онкологической патологии у женщин, в Северной Америке, Австралии, Северной и Западной Европе – 4-6%.
В России РШМ занимает пятое место в структуре заболеваемости злокачественными новообразованиями (5,2% всех злокачественных новообразований) и второе место (после рака тела матки) в структуре заболеваемости злокачественными опухолями гениталий. Заболеваемость РШМ в 2002 году составила 11,60/0000, смертность – 5,10/0000. Несмотря на визуальную локализацию, РШМ III–IV стадий выявлен у 39,8% больных. Высокой остается летальность в течение первого года с момента установления диагноза (20,3%), что свидетельствует о поздней диагностике и не всегда адекватном лечении.
Особенности клинического течения
У 70–80% больных инвазивным РШМ диагностируют плоскоклеточный рак, у 10–20% – аденокарциному и у 10% – низкодифференцированный рак. Частота других злокачественных опухолей шейки матки (ШМ) составляет не более 1%.
РШМ метастазирует лимфогенно и гематогенно. Переход опухоли от местноинфильтративного роста к лимфогенному распространению прогностически неблагоприятно. К сожалению, значительная часть больных РШМ при первичном обращении уже имеют лимфогенные метастазы.
Ведущим фактором, определяющим лимфогенное метастазирование, является глубина инвазии опухоли. При глубине инвазии опухоли до 1 мм метастазов в регионарных лимфатических узлах не бывает. При инвазии опухоли до 3 мм (IА1 стадия) лимфогенные метастазы обнаруживают у 1% больных, при глубине инвазии 3–5 мм (IА2 стадия) – уже у 5–8%. Дальнейший рост опухоли приводит к проявлению раковых эмболов в лимфатических сосудах, что резко увеличивает частоту лимфогенных метастазов. По данным разных авторов, частота лимфогенных метастазов при РШМ IВ стадии составляет 15–18%, II стадии – 25–30%, III стадии – 50–60%. Следует отметить, что РШМ в течение длительного времени имеет местное или местно-регионарное распространение.
Местно-регионарное распространение опухоли ведет к гематогенному метастазированию. При РШМ чаще всего поражаются легкие, печень и кости. Гематогенные метастазы РШМ без лимфогенных встречаются крайне редко.
Диагностика
Профилактическое обследование женщины включает визуальный осмотр наружных половых органов, влагалища, влагалищной части ШМ, бимануальное ректовагинальное исследование и цитологическое исследование мазков с экто- и эндоцервикса. При выявлении фоновой патологии ШМ дополнительно проводят кольпоскопию, биопсию всех подозрительных участков ШМ (при необходимости) и выскабливание цервикального канала. Эти мероприятия позволяют своевременно диагностировать дисплазию ШМ, преинвазивный и микроинвазивный РШМ. Если диагноз инвазивного РШМ верифицирован, последующие диагностические мероприятия направлены на уточнение степени распространенности опухоли и определение стадии заболевания. По данным разных авторов, частота ошибок при клиническом стадировании РШМ достигает 36%.
Лечение
Выбор метода лечения РШМ определяется индивидуально и зависит от распространенности процесса и тяжести сопутствующей патологии. Возраст больной имеет меньшее значение. Традиционными методами лечения РШМ являются хирургический, лучевой и их комбинации. В настоящее время активно изучаются возможности лекарственной терапии и химиолучевого лечения (ХЛЛ).
Хирургическое лечение
История хирургического лечения инвазивного РШМ насчитывает более 100 лет. Первые операции были выполнены в Европе и России во второй половине XIX в. Приоритет разработки и внедрения радикальных хирургических вмешательств при РШМ, безусловно, принадлежит австрийскому гинекологу Э. Вертгейму. Впервые он выполнил операцию, которая впоследствии будет названа его именем в 1902 году. В монографии 1911 года «Расширенная абдоминальная операция при раке шейки матки» Э. Вертгейм описал результаты 500 расширенных гистерэктомий. Многие выдающиеся отечественные и зарубежные гинекологи внесли большой вклад в усовершенствование техники расширенных операций и повышение их радикальности. Усилиями А.Т. Губарева, И.Л. Брауде, Л.Л. Окинчица, Н.Н. Никольского, А.И. Сереброва, В.П. Тобилевича, Л.А. Новиковой, Я.В. Бохмана, В.П. Козаченко техника расширенной гистерэктомии при РШМ прочно укоренилась в отечественной онкогинекологии, а ее широкое внедрение позволило излечить десятки тысяч женщин. Весомый вклад в разработку отдельных этапов операции Вертгейма внесли зарубежные исследователи – H. Okabayashi (1921), J. Meigs (1944, 1951) и др.
При тяжелой дисплазии и внутриэпителиальном РШМ, или РШМ in situ, (CIN III) выполняется раздельное диагностическое выскабливание полости матки и цервикального канала и конизация ШМ. Техника этой операции хорошо известна и описана во многих хирургических руководствах. Конизация ШМ может быть выполнена при помощи скальпеля, электроножа или луча лазера. Ножевая конизация позволяет получить наиболее полную и точную морфологическую картину удаленного конуса ШМ и должна применяться при всех спорных морфологических заключениях при дисплазии и микроинвазивном РШМ. При гистологическом подтверждении диагноза CIN III, а также микроинвазивного РШМ данный объем хирургического вмешательства считается адекватным. Если при опухоли с глубиной инвазии в строму ШМ до 3 мм обнаруживаются опухолевые эмболы в кровеносных или лимфатических сосудах, больной следует выполнять модифицированную расширенную экстирпацию матки с придатками (или без придатков). Модифицированная расширенная экстирпация матки также выполняется при глубине инвазии опухоли в строму ШМ 3–5 мм (IA2 стадия).
В настоящее время во всем мире для лечения инвазивного РШМ IB–IIA стадий применяется расширенная экстирпация матки с придатками (или без придатков), известная как операция Вертгейма.
В США хирургические вмешательства, выполняемые при инвазивном РШМ, делят на 5 типов:
- I тип – экстрафасциальная экстирпация матки;
- II тип – модифицированная радикальная экстирпация матки (включает удаление медиальной половины кардинальных и крестцово-маточных связок);
- III тип – радикальная экстирпация матки (предусматривает удаление большей части кардинальных, крестцово-маточных связок, верхней трети влагалища и лимфатических узлов таза); в США при инвазивном РШМ чаще всего выполняется именно эта операция;
- IV тип – расширенная радикальная экстирпация матки (удаляются периуретеральные ткани, резецируется верхняя пузырная артерия и три четверти влагалища);
- V тип – передняя экзентерация малого таза (предусматривает удаление дистальных отделов мочеточников и мочевого пузыря; выполняется при прорастании опухоли в мочевой пузырь).
Пятилетняя выживаемость после хирургического лечения микроинвазивного РШМ составляет 97-98%. Выживаемость больных РШМ IВ стадии без регионарных метастазов при хирургическом, лучевом и комбинированном лечении одинакова и равна 85-90%, а, по данным отдельных авторов, достигает 95%.
Комбинированное лечение
Комбинированное лечение, включающее операцию и лучевую терапию (ЛТ) в разной последовательности, проводят при РШМ IВ-IIА стадий. Отдельные авторы допускают его применение при РШМ IIВ стадии.
Предоперационное облучение имеет ряд преимуществ перед послеоперационным. Снижается диссеминация опухолевых клеток и частота рецидивов заболевания. Предоперационную ЛТ проводят при РШМ IВ2-IIA стадий, а также при РШМ IB1 стадии при наличии эхографических признаков метастазов в лимфатических узлах таза и при РШМ IIB стадии при наличии небольшого пришеечного инфильтрата.
Основная цель послеоперационного облучения – воздействие на опухолевые клетки в зоне первичной опухоли и регионарных лимфатических узлов. Многие авторы считают, что проведение послеоперационного облучения при РШМ целесообразно. Послеоперационное облучение проводят больным, имеющим противопоказания к предоперационной ЛТ (беременность, воспалительный процесс или объемные образования придатков матки), при наличии факторов риска прогрессирования (метастазы в лимфатических узлах таза, глубокая инвазия опухоли, низкая степень дифференцировки, патоморфоз I-III степени, наличие раковых эмболов в лимфатических щелях), а также в тех случаях, когда при исследовании препарата, удаленного во время операции, выявлена более глубокая инвазия, чем предполагалось до операции.
Важнейший фактор прогноза у операбельных больных РШМ IВ-IIА стадий – наличие метастазов в регионарных лимфатических узлах. Пятилетняя выживаемость при поражении лимфатических узлов таза снижается на 50% и не превышает 25% при метастазах в поясничных лимфатических узлах. При двухсторонних множественных метастазах риск регионарного рецидива РШМ в 2 раза выше, чем при поражении 1-3 лимфатических узлах таза с одной стороны. Если первичная опухоль менее 2 см, то 5-летняя выживаемость составляет 90%, 2-4 см – только 40% (Kenneth D., Hatch Yao S. Fu, 1996).
По нашим данным, 5-летняя общая и безрецидивная выживаемость больных РШМ IВ1 стадии после комбинированного лечения составляет 94,8 и 93,6% соответственно, IВ2 стадии – 86,2 и 85,7% соответственно. Пятилетняя выживаемость больных РШМ IB клинической стадии достоверно снижается при выявлении во время операции метастатического поражения регионарных лимфатических узлов таза, опухолевой инфильтрации параметральной клетчатки и глубокой инвазии стромы ШМ. Проведение предоперационной ЛТ достоверно улучшает отдаленные результаты лечения больных РШМ IB клинической стадии с метастазами в регионарных лимфатических узлах таза и больных РШМ IВ2 стадии.
По данным мировой литературы, 5-летняя выживаемость после комбинированного лечения РШМ IB стадии составляет 92-70,2%, II стадии – 80-52,9%. Следует отметить, что ряд авторов не отмечают достоверных различий 5-летней выживаемости больных РШМ IВ-IIА стадий, подвергнутых только хирургическому или комбинированному лечению.
Несмотря на очевидные успехи хирургического, лучевого и комбинированного методов лечения, выживаемость больных местнораспространенным РШМ продолжает оставаться стабильной. Это связано, прежде всего, с ограниченными возможностями хирургического лечения больных РШМ IIВ-IIIА стадий.
Химиотерапия
В последнее десятилетие многие ведущие клиники применяют при местнораспространенном РШМ химиотерапию (ХТ). ХТ местнораспространенного РШМ является сложной клинической задачей, что обусловлено, прежде всего, относительной резистентностью плоскоклеточного гинекологического рака к большинству имеющихся цитостатиков. Широкое практическое внедрение получили лишь некоторые из них. Эффективность цисплатина при РШМ составляет 23%, карбоплатина – 15%, ифосфамида – 22%, циклофосфамида – 15%, блеомицина – 10%, фторурацила – 20%, доксорубицина – 17%, митомицина – 14%, метотрексата – 18%, винкристина – 18% (Манзюк Л.В., 2000).
Наиболее активным цитостатиком при РШМ является ЦИСЛАТИН. Он эффективен в дозе 50 мг/м2 1 раз в 3 недели. Доза 100 мг/м2 дает небольшое, но статистически достоверное увеличение эффекта. Введение ЦИСЛАТИНА в дозе 100 мг/м2 в виде 24-часовой инфузии не улучшает результатов лечения, но менее токсично.
Второй по активности препарат – ИФОСФАМИД (применяется с уропротектором местной). Изучены разные режимы введения ИФОСФАМИДА:
- 1,5 г/м2/сут, 8-часовая инфузия, 3 сут.;
- 1,5 г/м2/сут, 1-часовая инфузия, 5 сут.;
- 5 г/м2/сут, 1-часовая инфузия, 1 сут.
Эффективность ИФОСФАМИДА у нелеченных пациенток составляет 21-50%, после ЛТ или ХТ – 0-11%. Активность доксорубицина при РШМ, по данным GOG, составляет 20%. Из новых цитостатиков заслуживают внимания таксаны (ПАЛИТАСКЕЛ, ДОЦЕТАКСЕЛ), иринотекан, винорельбин, гемцитабин.
В настоящее время монохимиотерапия при распространенном РШМ практически не применяется. Лечение обычно проводят разными лекарственными комбинациями, включающими цисплатин. Чаще используют двухкомпонентные комбинации: цисплатин и ифосфамид, цисплатин и фторурацил. Применяют и другие, более сложные лекарственные комбинации, например: цисплатин, этопозид и митомицин (МЕР), цисплатин, ифосфамид и фторурацил (PIF) и т. д.
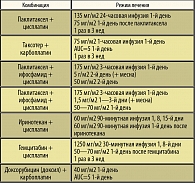
В последние годы производные платины комбинируют с новыми цитостатиками (таблица 1).
В исследовании Zanetta at al., (2000) цисплатин в дозе 50 мг/м2 вводился больным, ранее получавшим ЛТ, а в дозе 75 мг/м2 – больным, которым облучение не проводилось. Эффективность лечения у больных после ЛТ составила 52,1% по сравнению с 75% во второй группе. Десять пациенток с полной клинической регрессией в дальнейшем были прооперированы, причем у 6 из них полная ремиссия подтверждена морфологически.
Перспективным является внедрение в практику лечения больных РШМ ХТ в сочетании с ЛТ и/или хирургическим лечением. Подобный подход имеет ряд теоретических обоснований. Противоопухолевые препараты усиливают лучевое повреждение опухолевых клеток за счет нарушения механизма репарации ДНК, синхронизации вступления опухолевых клеток в фазы клеточного цикла, уменьшения числа опухолевых клеток, находящихся в фазе покоя, и способности девитализировать резистентные к облучению опухолевые клетки, находящиеся в состоянии гипоксии. Кроме того, сами противоопухолевые препараты обладают цитостатическим эффектом не только в отношении первичной опухоли и регионарных метастазов, но и способны воздействовать на отдаленные метастазы. Опухоль может быть более химиочувствительна перед ЛТ или операцией и уменьшение объема опухоли после ХТ может повышать эффективность ЛТ или способствовать выполнению радикальной операции. Использование неоадъювантной ХТ снижает риск интраоперационной диссеминации опухолевых клеток .
Химиотерапия и последующее хирургическое лечение
С конца 80-х годов прошлого столетия несколько групп исследователей из Аргентины, Австралии, Кореи и Италии опубликовали предварительные результаты применения платиносодержащих комбинаций в качестве предоперационной ХТ у пациентов РШМ IB2-IIIB стадий. Терапевтический эффект был отмечен у 66,6-89% больных. При гистологическом исследовании наиболее выраженная регрессия наблюдалась в опухоли, локализующейся на стенке влагалища, менее выраженная – в опухоли, локализующейся на шейке матки, еще менее выраженная – в параметральном опухолевом инфильтрате. Хотя уровень гистологически доказанных полных регрессий был достаточно низок (0-13%), метастазы в лимфатических узлах во время операции у больных, получавших предоперационную ХТ, обнаруживались реже (8-33%), чем у больных, не получавших ее (40-80%). Таким образом, ХТ, по-видимому, влияет не только на первичную опухоль, но и на метастазы в лимфатических узлах. Если это действительно так, то хирургическим путем можно удалять потенциально резистентные очаги и улучшать тем самым безрецидивную выживаемость. Многофакторный анализ, проведенный Benedetti-Panici et al. (1994) показал, что ответ на неоадъювантную ХТ может служить независимым фактором прогноза выживаемости, наряду с клинической стадией, размером опухоли и наличием инфильтратов в параметриях.
К сожалению, в специальной литературе в основном описаны нерандомизированные и пилотные исследования, результаты которых очень трудно интерпретировать из-за небольшого числа наблюдений, короткой прослеженности или отсутствия четких критериев отбора пациентов.
В исследование Namkoong et al. (1995) включено 230 пациенток РШМ IB2, IIA и IIB стадий. Длительность наблюдения составила 4 года. Девяносто двум больным проведено лечение по схеме: предоперационная ХТ (винбластин + блеомицин + цисплатин каждые 3 нед., 2-5 курсов в зависимости от эффекта) + радикальная операция. Группу сравнения составили 138 пациенток, которые были радикально оперированы. Частота метастазов в лимфатических узлах была меньше в группе больных, получивших предоперационную ХТ (17% по сравнению с 34%, p=0,005). То же можно сказать и о частоте рецидивов заболевания (18,5% по сравнению с 35,5%, р=0,004). Отмечено также удлинение безрецидивного периода (р=0,0067).
Наиболее важные результаты рандомизированных исследований представлены в таблице 2.
В исследовании Sardi JE et al. (1997) приведена окончательные данные о лечении пациенток РШМ IB1-B2 стадий. В этом исследовании группа больных, подвергнутых неоадъювантной ХТ с последующими операцией и облучением, сравнивалась с группой больных, прооперированных на первом этапе и получавших затем ЛТ. ХТ проводилась по схеме винкристин, 1 мг/м2 в 1-й день, цисплатин, 50 мг/м2 в 1-й день, блеомицин, 25 мг/м2 6-часовая инфузия в 1-3-й дни. Проводилось 3 курса лечения с интервалом 10 дней. Общая выживаемость при РШМ IB стадии оказалась значительно выше среди больных, подвергнутых неоадъювантной ХТ (81% по сравнению с 66% в контрольной группе после 8 лет наблюдения, p < 0,05). Кроме того, в контрольной группе было значительно выше число рецидивов в малом тазу (17% по сравнению с 7%, p < 0,001), хотя частота отдаленных метастазов достоверно не отличалась (8% по сравнению с 5%). При РШМ IB2 стадии резектабельность была выше у больных, подвергнутых неоадъювантной ХТ (100% по сравнению с 85%, p<0,01). Морфологические факторы риска, такие, как наличие опухолевых эмболов в лимфатических и кровеносных сосудах, инфильтрация параметриев и метастатическое поражение лимфатических узлов, у большинства больных, подвергнутых неоадъювантной ХТ, отсутствовали (p<0,001).
Клинические исследования по использованию индукционной ХТ с последующим хирургическим лечением показали, что уменьшение объема опухоли под воздействием лекарственного лечения позволяет выполнить радикальную операцию у большинства изначально неоперабельных больных. Предоперационная ХТ не увеличивает число интра- и послеоперационных осложнений. Доказано, что неоадъювантная ХТ снижает частоту метастазов в лимфатических узлах при РШМ.
Химиолучевое лечение
Sardi JE et al. (1998) исследовал возможности неоадьювантной ХТ в сочетании с ЛТ при местнораспространенном РШМ. Семидесяти двум больным РШМ IIB стадии на I этапе лечения проведено 3 курса ХТ по схеме PVB: винкристин, 1 мг/м2 в 1-й день, блеомицин, 25 мг/м2 в 1-3-й дни, цисплатин, 50 мг/м2 в 1-й день. Интервал между курсами составлял 10 дней. На 2 этапе проводилась сочетанная ЛТ (дистанционное облучение малого таза до суммарной дозы 50 Гр (разовая доза 1,8-2,0 Гр и затем брахитерапия до суммарной дозы на точку А 35-40 Гр за 1-2 сеанса). Контрольную группу составили 73 пациентки РШМ IIB стадии, которым проводилась сочетанная ЛТ до указанных выше доз. Пятилетняя выживаемость в основной группе составила 54%, в контрольной – 48%. Частота рецидивов была значительно ниже в группе, получавшей ХТ, по сравнению с контрольной группой (25 и 41% соответственно, p<0,04).
В исследовании Keys H.M. et al. (1999) больные РШМ IB2 стадии на первом этапе получали либо ЛТ (186 больных), либо ЛТ совместно с введением цисплатина (183 больных). Суммарная доза на первичную опухоль составляла 75 Гр, на зоны регионарного метастазирования – 55Гр. Цисплатин в дозе 40 мг/м2 вводили еженедельно течение 6 недель на протяжении всего курса ЛТ. Совместное назначение ЛТ и цитостатиков хорошо переносилось и не приводило к увеличению продолжительности лечения. Трехлетняя выживаемость в группе больных, подвергнутых ХЛЛ и ЛТ, составили 85 и 74% соответственно (р=0,008). Сочетанное применение ЛТ и цисплатина снижало риск смерти от РШМ на 46%.
Исследование Rose P.G. et al. (1999) посвящено лечению 526 больных РШМ более поздних стадий (IIB-IVA). Им проводилась ЛТ с одновременным введением гидроксимочевины, 3 г/м2 2 раза в неделю в течение 6 недель (1-я группа), либо цисплатина, 40 мг/м2 еженедельно в течение 6 недель (2-я группа), либо комбинации цисплатина, 50 мг/м2 в 1-й и 29-й дни, фторурацила, 4 г/м2 в/в инфузия в течение 96 часов в 1-й и 29-й дни, и гидроксимочевины, 2 г/м2 внутрь 2 раза в неделю в течение 6 недель (3-я группа). Дистанционная ЛТ проводилась до суммарной дозы 40,8 или 51 Гр с последующим проведением брахитерапии через 3 недели в дозе 40 Гр при IIB стадии и 30 Гр при III–IVA стадиях. Трехлетняя выживаемость была достоверно выше в группах больных, получавших цисплатин (65,5%), по сравнению с группой, получавшей гидроксимочевину (47%). Относительный риск смерти больных, получавших только цисплатин или цисплатин в комбинации с другими препаратами, составил 0,61 и 0,58 соответственно (риск смерти в группе больных, получавших гидроксимочевину, принят за 1). Принимая во внимание меньшую токсичность и простоту введения цисплатина по сравнению с комбинацией цисплатин + фторурацил + гидроксимочевина, авторы отдают предпочтение первой схеме ХЛЛ.
В 1999 году опубликованы результаты рандомизированного исследования, проведенного GOG, в котором показано улучшение выживаемости больных местнораспространенным РШМ (IIB-IVA стадии), получавших ХЛЛ по сравнению с сочетанной ЛТ (Whitney C.W. et al., 1999). Цисплатин вводили в дозе 50 мг/м2 в 1-й и 29-й дни, фторурацил, 1000 мг/м2 в 2-5-й и 30-33-й дни во время дистанционной ЛТ. Дозы ЛТ были одинаковы в обеих группах. Пятилетняя выживаемость в группе больных, которым проведена ХТ, составила 55% по сравнению с 43% в группе больных после сочетанной ЛТ.
Сводные данные рандомизированных исследований эффективности ЛТ и ХЛЛ местнораспространенного РШМ представлены в таблице 3.
Таким образом, представленные данные свидетельствуют о целесообразности совместного проведения ХТ и ЛТ у больных местнораспространенным РШМ. Поскольку данные рандомизированных исследований о преимуществах какой-либо из лекарственных комбинаций отсутствуют, можно применять наименее токсичный режим – еженедельное введение цисплатина в дозе 40-50 мг/м2. Следует продолжать поиск хорошо сочетающихся с ЛТ, эффективных и малотоксичных комбинаций цитостатиков, в том числе с включением таких препаратов, как ифосфамид, блеомицин, таксаны и т. д. Цели ХТ зависят от стадии заболевания. На ранних стадиях она в первую очередь потенцирует местный эффект ЛТ, на более поздних, кроме того, подавляет отдаленное метастазирование.
Материалы и методы
Мы располагаем опытом комплексного лечения 42 первичных больных РШМ T2bN0M0 и T2bN1M0. На I этапе всем больным было проведено ХЛЛ, которое начинали с 2 курсов лекарственной терапии с трехнедельным перерывом (цисплатин, 100 мг/м2 в/в в 1-й день с предварительной гипергидратацией на фоне противорвотных средств, блеомицин, 15 мг в/в в 1, 3, 5, 8-й дни, фторурацил, 450 мг/м2 в/в в 1 и 8-й дни, циклофосфан, 400 мг в/в в 1, 3, 5, 8-й дни). На II этапе (через 3 недели после окончания ХТ) проводили дистанционную ЛТ (суммарная очаговая доза на первичную опухоль и зоны регионарного метастазирования 30-40 Гр). На III этапе (через 2-3 недели после завершения ЛТ) выполняли расширенную экстирпацию матки с придатками. После операции при наличии факторов риска (метастазы в лимфатических узлах таза, глубокая инвазия опухоли, низкая степень дифференцировки, патоморфоз I-III степени, наличие раковых эмболов в лимфатических сосудах) проводили ЛТ до индивидуально запланированных терапевтических доз.
Для сравнения эффективности комплексного лечения нами были изучены результаты комбинированного лечения 50 больных местнораспространенным РШМ T2bN0M0 и T2bN1M0. На I этапе все больные этой группы получили предоперационную дистанционную ЛТ в суммарной очаговой дозе на первичную опухоль и зоны регионарного метастазирования 30-40 Гр. На II этапе выполняли расширенную экстирпацию матки с придатками, на III этапе проводили дистанционную или сочетанную ЛТ до индивидуально запланированных терапевтических доз. В анализ включены только больные, которым после предоперационной ЛТ удалось выполнить хирургическое вмешательство.
При гистологическом исследовании операционных препаратов у всех больных оценена степень лечебного патоморфоза опухоли. Полная регрессия первичной опухоли (патоморфоз IV степени) установлен у 33,3% больных, подвергнутых ХЛЛ, и 10% больных после ЛТ (р<0,05), регрессия опухоли более 50% (патоморфоз III степени) – у 35,7 и 28% больных соответственно, регрессия опухоли менее 50% (патоморфоз I-II степени) – у 28,6 и 38% больных соответственно. И, наконец, первичная опухоль не имела признаков лечебного патоморфоза у 2,4% больных после ХЛЛ и у 24% больных после предоперационной ЛТ (p<0,05). Таким образом, ХЛЛ оказывает более выраженное тумороцидное действие на первичную опухоль по сравнению с ЛТ.
Применение неоадъювантной ХТ в комплексном лечении РШМ не увеличивает частоту и выраженность лучевых и послеоперационных осложнений по сравнению с комбинированным лечением.
Пятилетняя общая, определяемая опухолью (disease-specific) выживаемость больных после комплексного лечения соcтавила 88,3%, после комбинированного лечения – 66,1% (p<0,05). Пятилетняя безрецидивная выживаемость больных, которым проведено комплексное лечение, выше этого показателя у пациенток, подвергнутых комбинированному лечению, – 79,1 и 63,2% соответственно.
В первые 5 лет после лечения признаки местного прогрессирования РШМ выявлены у 24% больных после комбинированного лечения и у 9,5% пациенток после комплексного лечения (p<0,05), отдаленные метастазы – у 14 и 2,4% пациенток соответственно (p<0,05). Если после предоперационной ЛТ или ХЛЛ отмечался лечебный патоморфоз первичной опухоли IV степени, отдаленные метастазы, местное и регионарное прогрессирование не возникали. Нами установлено, что применение ХЛЛ улучшает прогноз больных с метастазами РШМ в регионарные лимфатических узлах таза.
Таким образом, представленные данные свидетельствуют о целесообразности проведения неоадъювантной ХТ при РШМ, что требует дальнейшего многоцентрового исследования этого аспекта с использованием иммуногистохических и современных биологических критериев и пересмотру общепринятых лечебных подходов и методических рекомендаций.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.