Современные возможности химиотерапии больных с местнораспространённым и метастатическим немелкоклеточным раком лёгкого
- Аннотация
- Статья
- Ссылки




Распространённость опухоли и возможность её хирургического удаления являются определяющими условиями успешного лечения больных НМРЛ.
На момент установления диагноза, всех пациентов НМРЛ можно условно разделить на 3 группы, что отражает распространённость заболевания и подходы к лечению.
Первая группа – это операбельные больные с I-й и II-й стадиями. Они имеют наилучший прогноз, зависящий от биологических особенностей опухоли и других факторов. Больные с операбельной опухолью, но имеющие противопоказания к операции, могут быть подвергнуты консервативному лечению.
Вторая группа (10-15%) – включает больных либо с местно-распространённым процессом (T3-4), либо с метастазами в регионарные лимфоузлы (N2-3). Большая часть больных в этой группе обычно получает консервативное лечение (лучевую или химио-лучевую терапию), лишь немногие больные с T3 или N2 могут эффективно лечиться хирургическим методом.
Третья группа больных (примерно 50%) имеет клинически определяемые отдалённые метастазы (M1) при постановке диагноза. Они могут получать химиотерапию или лучевую терапию для облегчения симптомов болезни.
Кроме того, более чем у половины пациентов после радикально выполненных операций возникает либо местный рецидив, либо отдалённые метастазы, а это значит, что 75 % всех больных НМРЛ являются потенциальными кандидатами для проведения на различных этапах лечения.
Системная химиотерапия может вызывать регрессию опухоли и симптоматический эффект у части больных с распространённым НМРЛ. Местное воздействие на первичную опухоль может быть осуществлено при использовании лучевой терапии, однако излечить таким образом можно только отдельных больных.
Определение стадии заболевания чрезвычайно важно для прогноза и выбора лечебной тактики. Стадия устанавливается на основании клинических (осмотр, рентгенологическое и лабораторное обследование) и морфологических (гистология/цитология биоптатов, полученных при бронхоскопии, биопсии лимфоузлов, трансторакальной пункции, торакоскопии, медиастиноскопии) -методов (1).
Анализ стадирования 1400 больных, подвергнутых операции, показал, что клиническая стадия, установленная на основании рентгенологических методов, была правильно оценена по T – у 78% больных и по N – у 47% больных. Ошибки по занижению и завышению стадий были одинаково часты (2). Чувствительность и специфичность компьютерной томографии (КТ) (по данным Radiology Diagnostic Oncology Group) составляет 52% и 69% соответственно (3). Магнитно-резонансная томография (МРТ) не улучшает правильность стадирования. Предварительная оценка позитронно-эмиссионной томографии (ПЭТ) даёт основания предположить, что комбинация КТ и ПЭТ может улучшить объективность стадирования (4).
Помимо метастазов в надпочечники, при НМРЛ часто поражаются печень, кости, головной мозг. Иногда это выявляется при физикальном обследовании. В связи с этим, по нашему мнению, целесообразно при первом обращении больного с НМРЛ проведение полного обследования, включающего скенирование скелета, неврологическое обследование, КТ головного мозга.
В результате применения новых технологий обследования больных (5), в 1997 году Международная Система Стадирования НМРЛ была пересмотрена. Изменения были основаны на накопленном клиническом опыте. Небольшие дополнения относятся к классификации множественных лёгочных лимфоузлов. Пересмотренная система делит I и II стадии на A и B подгруппы. Кроме того, стадия III A была модифицирована, чтобы более адекватно отразить влияние на прогноз анатомической распространённости опухолевого процесса для этой подгруппы. Новая группировка также совмещена с условными лечебными подходами.
Клинические аспекты лечения НМРЛ
III A стадия НМРЛ (T1-2 N2 M0, T3 N1-2 M0)
Больные с клинической стадией III A (N2) имеют 5-летнюю выживаемость от 10 до 15%. Однако, при массивном поражении медиастинальных лимфоузлов этот показатель снижается до 2-5%. В зависимости от клинических обстоятельств, основными методами лечения больных с III A стадией являются лучевая терапия, химиотерапия, хирургия и комбинация этих методов. Хотя большинство больных не достигают полной ремиссии на лучевой терапии, она обеспечивает воспроизводимое долговременное улучшение выживаемости у 5-10% пациентов при использовании стандартных доз, и значительное симптоматическое улучшение.
Поскольку долгосрочный прогноз у больных с III A – стадией в целом плохой, следует включать их в клинические исследования, изучающие режимы с различным фракционированием, эндобронхиальную лазеротерапию, брахитерапию, сочетание этих методов, что может привести к улучшению результатов лечения (6). Например, в одном проспективном рандомизированном исследовании было показано улучшение общей выживаемости при проведении лучевой терапии по 3 фракции в день по сравнению с 1 фракцией (7).
Добавление современных платиносодержащих режимов химиотерапии к лучевой терапии улучшает выживаемость больных (8). Метаанализ 11 клинических исследований продемонстрировал снижение риска смерти на 10% у больных, получавших цисплатин-содержащие режимы + лучевую терапию, по сравнению с применением одной лучевой терапии (9). Оптимальная последовательность методов, фракционирование лучевой терапии и химиотерапевтические режимы продолжают изучаться.
Эффективным является проведение неоадъювантной химиотерапии. В двух исследованиях медиана выживаемости больных, получавших химиотерапию, оказалась в 3 раза больше, чем у больных после одной операции (10). В работе Vansteenkiste (11) проведение неоадъювантной химиотерапии позволило улучшить 2-летнюю выживаемость на 20% и 5-летнюю – на 6%.
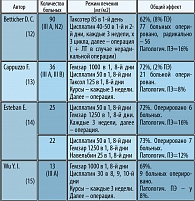
В таблице 1 представлены современные режимы комбинированной неоадъювантной химиотерапии, опубликованные в материалах ASCO-2002.
Современные режимы комбинированной неоадъювантной химиотерапии показали хорошие результаты и удовлетворительную переносимость.
Ещё один лечебный подход, активно изучаемый в настоящее время – это неоадъювантная химио-лучевая терапия с использованием современных цитостатиков (16), которые по предварительной оценке оказались высокоэффективными и хорошо переносимыми.
Большинство ретроспективных исследований подтверждают, что послеоперационная лучевая терапия уменьшает частоту местных рецидивов, однако, остаётся спорным – улучшает ли это общую выживаемость (17). Метаанализ девяти рандомизированных исследований, сравнивавших результаты операции и лучевой терапии и одной операции, не показал различий в выживаемости у больных с N2 (18). В исследовании, сравнивавшем послеоперационную лучевую терапию (одну) и её сочетание с одновременной химиотерапией Цисплатин + Этопозид, преимуществ последней не выявило (19).
В настоящее время, профилактическая химиотерапия не может быть рекомендована как стандартный метод лечения и находится в процессе изучения (20).
III B – стадия НМРЛ (T4 или N3, M0).
Стандартным подходом к лечению больных с неоперабельной III B – стадией, при хорошем их состоянии, является химио-лучевая терапия. Однако, больным со злокачественным плевритом редко проводится лучевая терапия и их лечение подобно лечению больных с IV-й стадией.
Многочисленные рандомизированные исследования показали преимущества по выживаемости, у больных с нерезектабельной III B стадией, при одновременной цисплатин-содержащей химиотерапии и лучевой терапии, по сравнению с одной лучевой терапией (21). Ослабленные больные с III B стадией являются кандидатами для паллиативной лучевой терапии. Основными вопросами, которые обсуждаются в настоящее время, являются – выбор оптимальной последовательности химиотерапии и лучевой терапии, оптимального режима химиотерапии и конкретных цитостатиков с учётом их радиосенсибилизирующих свойств.
Результаты II-й фазы клинического исследования LAMP (Locally Advanced Multimodality Protocol) дали некоторую информацию по этим вопросам (22). В исследование было включено 276 больных, рандомизированных на 3 группы.
- Таксол + Карбоплатин * 2 цикла, затем лучевая терапия (ЛТ) в дозе 63 Гр. Медиана выживаемости – 12,5 мес.
- Таксол + Карбоплатин * 2 цикла, затем Таксол + Карбоплатин в еженедельном режиме + ЛТ в течение 7-и недель, 63 Гр.
Медиана выживаемости – 11 мес.
- Таксол + Карбоплатин + ЛТ в течение 7-и недель, 63 Гр., затем Таксол + Карбоплатин * 2 цикла.
Медиана выживаемости = 16,1 мес.
Медиана выживаемости в трёх рукавах этого исследования сравнивалась с медианой выживаемости 14,5 мес., продемонстрированной при последовательной химио-лучевой терапии в исследовании RTOG - 8808 (23). Анализ показал отсутствие улучшения выживаемости у больных в 1,2-й группах по сравнению с историческим контролем. Наилучший терапевтический эффект был получен в 3-й группе. Лечение оказалось хорошо переносимым. Несмотря на частые эзофагиты в группе 3 – 67% больных закончили химио-лучевую терапию и 75% - консолидирующую химиотерапию.
Два исследования по III-й фазе показали преимущество одновременной химио-лучевой терапии, что отразилось на выживаемости (24). Исследование Furuze продемонстрировало улучшение непосредственной эффективности и выживаемости у больных, получавших одновременное химио-лучевое лечение (общий эффект – 84% против 66%, p=0,0002; медиана выживаемости – 16,5 мес. против 13,3 мес., p=0,03998). Кроме того, были выше показатели пятилетней выживаемости . II-я фаза SWOG – 9504 также показала преимущество совместной химио-лучевой терапии в комбинации с консолидирующей химиотерапией. Однако, проведение одновременной химио-лучевой терапии может привести к усилению токсичности.
В некоторых исследованиях использовались “старые” (традиционные) режимы химиотерапии. Пока нет рандомизированных исследований по III-й фазе, в которых бы изучалась последовательность применения современных химиотерапевтических режимов. В рамках I – II-й фазы определены некоторые комбинации, активные при НМРЛ, которые могут назначаться неоперабельным больным с III-й стадией. Широко изучался режим Таксол + Карбоплатин в сочетании с ЛТ, демонстрируя общий эффект 50-79%, и медиану выживаемости 14-26 мес., при хорошей общей переносимости. По мнению некоторых исследователей, назначение индукционной химиотерапии перед химио-лучевой терапией может ухудшать переносимость последней, что может привести к ухудшению отдалённых результатов. Целесообразность проведения консолидирующей химиотерапии после химио-лучевого лечения, остаётся в настоящее время предметом изучения.
Таким образом, сочетанная химио-лучевая терапия – стандартный метод лечения больных с неоперабельной III-й стадией НМРЛ, а также – для больных с любой стадией, которые не могут быть оперированы по медицинским причинам (25). Лечение может меняться в зависимости от индивидуальных особенностей пациента. Для ослабленных (PS х 2) и пожилых полные дозы сочетанной химио-лучевой терапии могут оказаться токсичными. Возможно, новые менее токсичные режимы, включая расщеплённый курс лучевой терапии, могут стать приемлемыми для лечения этой категории больных. На сегодняшний день мало исследований, изучающих этот вопрос (26).
Лечение НМРЛ IV стадии (M1)
Доказано, что использование системной паллиативной химиотерапии у больных с неоперабельной III B и IV стадиями НМРЛ даёт улучшение выживаемости по сравнению с оптимальной поддерживающей терапией (симптоматическим лечением) (27).
Метаанализ показал, что применение Цисплатин-содержащих режимов улучшает 1-летнюю выживаемость на 10%. Кроме того, у 65% больных, отмечено симптоматическое улучшение. Часто пациенты с распространённым опухолевым процессом имеют серьезные сопутствующие заболевания, ухудшающие их состояние, что осложняет проведение агрессивной химиотерапии. Появление в последние годы новых, более эффективных и хорошо переносимых препаратов расширяет контингент больных, подлежащих лекарственному лечению.
Выбор метода лечения основывается на анализе прогностических факторов. Наиболее важными являются – общее состояние больного (Performance Status – PS), возраст и потеря веса (28). В многочисленных исследованиях было показано, что больные в хорошем общем состоянии имеют больше шансов достичь объективного ответа на химиотерапию и добиться лучшей выживаемости, а также меньшую вероятность развития серьезных осложнений (29).
По данным SWOG, 1-летняя выживаемость пациентов с PS = 0-1, составила 20%, по сравнению с 9% для пациентов с PS = 2-4 (29). Ретроспективный анализ 5-и клинических исследований ECOG (1960 больных), также подтвердил, что PS достоверно влияет на медиану выживаемости (30). Следует также учитывать пол, локализацию и количество метастатических очагов, уровень гемоглобина и ЛДГ, число лейкоцитов (31). Что касается выбора препаратов, то в настоящее время предпочтение отдаётся платиносодержащим комбинациям, хотя в некоторых исследованиях показана сопоставимая эффективность неплатиновых и платиносодержащих режимов (32).
Мультицентровые рандомизированные исследования показали преимущество платиносодержащих режимов с включением новых препаратов, таких как Таксол, Таксотер, Гемзар, Навельбин, Иринотекан, по сравнению со стандартной комбинацией Этопозид + Цисплатин (33). Сравнение в проспективном рандомизированном исследовании 4-х наиболее часто используемых в настоящее время режимов: Цисплатин + Таксол, Гемзар + Цисплатин, Таксотер + Цисплатин, Карбоплатин + Таксол не выявило достоверных различий в эффективности и выживаемости. В другом мультицентровом рандомизированном исследовании (TAX-326) сравнивались 3 режима: Таксотер + Цисплатин, Таксотер + Карбоплатин и Навельбин + Цисплатин. Выживаемость в группе больных, получавших комбинацию Таксотер + Цисплатин, оказалась достоверно выше чем в группах, леченных Навельбином и Цисплатином. Качество жизни больных, получавших Таксотер-содержащие режимы, также оценено как более высокое (34).
Химиотерапию у больных распространённым НМРЛ следует начинать как можно раньше. Длительность её зависит от результатов лечения и переносимости. Согласно практическим рекомендациям ASCO (1997 г.), для лечения неоперабельных больных НМРЛ не следует проводить более 8-и курсов химиотерапии (35). Больные в хорошем состоянии, обладающие первичной резистентностью к 1-й линии химиотерапии, могут достичь частичной регрессии при проведении 2-й линии. Большие шансы на успешное лечение имеют пациенты, у которых отмечалось объективное улучшение и длительный период до прогрессирования. Перспективным направлением в лечении распространённого НМРЛ является изучение принципиально новых препаратов, воздействующих на молекулярные мишени (ингибиторы эпидермального фактора роста, антисенсы, ингибиторы ангиогенеза и др.).
Новые направления химиотерапии
Новые “таргетные”, или целевые агенты – это совершенно уникальный подход в лекарственном лечении злокачественных опухолей, кардинально меняющий не только методику клинического изучения новых лекарств, но и всю стратегию химиотерапии.
Каждый из этих препаратов действует на свою собственную мишень, экспрессия которой тем или иным образом влияет на опухолевый рост. Они отличаются от классических цитотоксических препаратов не только по механизму действия, но и по токсичности. Многие из них направлены на стабилизацию опухолевого процесса, на перевод его в хроническое состояние. И поэтому многие из них должны быть использованы на более ранних этапах лечения, когда ещё нет повреждения мишеней другими агентами и при более ранних стадиях болезни. Это предопределяет и изменение методики оценки их действия. В связи с этим меняется последовательность фаз их классического изучения. Так антиангионеггые препараты начали одновременно изучаться и в разных дозовых режимах, и в комбинации с химиотерапией.
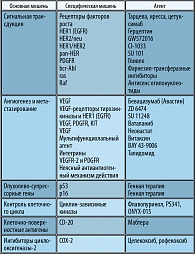
Антиангиогенные ЛС:
- ингибиторы эндотелиальной тирозинкиназы и пептидов, блокирующих VEGF – бевацизумаб (авастин), неовастат (AE-941).
Бевацизумаб (Авастин) изучается одновременно при НМРЛ в режимах неоадъювантной химиотерапии при операбельном процессе и при диссеминированныом НМРЛ, а при МРЛ – как при локализованном, так и при распространённом процессе.
CR= полный эффект, CRp= частично-полный эффект, ORR= Общий ответ, OS= Выживаемость, PFS= время до прогрессирования, PR= частичный эффект TTP= VEGF= сосудистый эндотелиальный фактор роста
Так Sandler с соавторами на ASCO-2005 представил данные по изучению комбинации таксол + карбоплатин в сочетании с бевацизумабом (авастин) у 842 больных с НМРЛ IIIB – IV ст. по II/III фазе. Оказалось, что добавление авастина к стандартной комбинации таксол + карбоплатин позволяет увеличить медиану выживаемости на 25%.
Ингибиторы тирозинкиназы EGFR
- ZD-1839 (Иресса) и OSI-774 (Тарцева)
Предклинические исследования препарата Тарцевы (Эрлотиниб), который обратимо связывает тирозин-киназу HER-1, продемонстрировали его противоопухолевую активность.
Первоначальное клиническое изучение показало эффективность препарата в дозе 150 мг/день при раке яичников, плоскоклеточном раке головы и шеи и НМРЛ. Более чем у трети больных при этих опухолях достигнута стабилизация процесса. Дальнейшие исследования по II и III фазам проводятся практически одновременно по международным мультицентровым кооперированным протоколам.
Добавление эрлотиниба к химиотерапии 1-й линии у больных НМРЛ не улучшило результаты лечения. Однако один эрлотиниб после 2-й линии химиотерапии вызвал достоверное улучшение общей и безрецидивной выживаемости.
Эрлотиниб (Тарцева) при распространённом НМРЛ
1-я линия:
- Гемзар/Цисплатин ± Эрлотиниб (TALENT)
- Таксол/Карбоплатин ± Эрлотиниб (TRIBUTE)
- Отсутствие достоверного улучшения результатов
3-я линия:
- Монотерапия Эрлотинибом (731 б-ной, прогрессирование после 2-й линии химиотерапии)
18 ноября 2004 г. Тарцева (эрлотиниб) получил полное одобрение в FDA, в качестве монотерапии для лечения больных с местнораспространенным или метастатическим НМРЛ, после неэффективной предыдущим режимом химиотерапии (36).
Гефитиниб (Иресса) – ингибитор рецепторов тирозинкиназы, преимущественно цитостатического механизма действия, взаимодействующий с EGFR-экспрессирующими клетками, изучался сразу же после установления режима его применения одновременно по II и III фазам.
Была отмечена зависимость между эффективностью лечения Ирессой и появлением кожной сыпи. Эффективность лечения выше у больных с появлением кожной сыпи, чем у больных без сыпи. Так медиана выживаемости составила 10,8 мес. против 4,0 мес. соответственно.
Изучение Ирессы в комбинации с химиотерапией (INTACT 1 и 2) по схемам гемзар + цисплатин и таксол + карбоплатин не дало улучшения показателей выживаемости и времени до прогрессирования с помощью присоединения Ирессы.
Однако, несмотря на это, гефитиниб (Иресса) с учётом данных его объективного и субъективного эффекта у больных распространённым НМРЛ был утверждён Комитетом по лекарственным препаратам и пищевым продуктам США для лечения больных рефрактерным НМРЛ.
- Ингибиторы фарнезилтрансферазы (RAS-мутации)
- SCH 66336 (лонафарниб);
- R 115777 (зарнестра)
- Ингибиторы рецепторов Her-2/neu
- трастузумаб
- Блокаторы или ингибиторы протеинкиназы С, влияющий на апоптоз
- SIS 3521
- UCN-01 – производное сткуроспорина
- бриостатин
- Ретиноиды (влияющие на апоптоз)
- бексаротин (LGD-1069)
Они имеют более выраженное не цитотоксическое, а цитостатическое действие, вызывая остановку опухолевого роста, приводя к стабилизации опухолевого процесса. Эти новые ЛС требуют не только пересмотра подходов к оценке противоопухолевого эффекта, но и более тщательной методики клинических испытаний с правильным подбором контингента больных, подлежащих новому методу лечения во избежание ложных результатов.
Большое число исследуемых в последние годы целевых (или т.н. таргетных) агентов требует специальных методов их клинического изучения, которые включают в себя:
- Правильный дизайн исследования в стадии планирования
- Пересмотр методических подходов к изучению новых лекарств
- Поиск оптимальных путей применения новых таргетных препаратов
- Определение наличия или активности основной мишени опухолевого роста (ферментов, рецепторов фактора роста, онкогенов и др.)
- Экспериментальное обоснование комбинации таргетных и цитотоксических лекарств.
- Использование таргетных препаратов при ранних стадиях заболевания.
Заключение
Таким образом, на современном этапе проблема лечения местно-распространённого НМРЛ решается на стыке разных дисциплин и требует участия различных специалистов – торакального хирурга, химиотерапевта, радиолога.
Правильность выбора лечебной тактики зависит от объективного стадирования и общего состояния больного. Оптимальным методом лечения неоперабельных больных с III-й стадией НМРЛ является химио-лучевая терапия с использованием различных режимов химиотерапии и методик облучения.
Для больных с IV-й стадией в удовлетворительном состоянии, основным методом лечения является системная, паллиативная химиотерапия. На сегодняшний день не существует единого стандарта среди современных равноэффективных химиотерапевтических режимов. Выбор делается с учётом функциональных резервов больного и токсического профиля препарата.
Лучевая терапия играет вспомогательную роль, и используется для купирования тягостных симптомов болезни.
Оптимальным для больных с местно-распространённым и метастатическим НМРЛ является участие в клинических исследовательских программах, что обеспечивает использование новейших технологий диагностики и лечения. К сожалению, сейчас количество больных, включённых в клинические исследования, не превышает 1-2%.
В настоящее время, одним из наиболее активно изучаемых направлений лечебной стратегии при НМРЛ является использование “таргетных” препаратов.
Другая область исследовательского интереса – это создание функциональных моделей для прогнозирования ответа на лечение и индивидуализацию лечебного плана.
Возможно, в будущем это улучшит результаты лечения больных НМРЛ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.