Современные возможности анти-PD-1-терапии при распространенном уротелиальном раке
- Аннотация
- Статья
- Ссылки
- English
Введение
Уротелиальная карцинома, или уротелиальный рак (УР), – злокачественное новообразование, которое развивается из эпителия мочевыводящих путей. УР занимает четвертое место по распространенности после рака молочной железы, рака легкого, колоректального рака и рака предстательной железы [1]. Данное заболевание может развиваться на уровне как верхних мочевыводящих путей, к которым относятся чашечно-лоханочная система почки и мочеточники, так и нижних – в мочевом пузыре и уретре. Частота развития рака на разных уровнях мочевыводящих путей неодинакова. Так, УР верхних мочевыводящих путей встречается достаточно редко – по разным данным, от 5 до 10% всех случаев [2]. На долю рака мочевого пузыря приходится около 90% всех случаев УР, что делает его самой частой злокачественной опухолью мочевыводящих путей и ставит на второе место среди всех злокачественных новообразований мочеполовых органов [3].
Помимо частоты возникновения опухоли установлена и закономерность в отношении инвазивности рака. Несмотря на более редкую частоту встречаемости УР верхних мочевыводящих путей, доля первоначально инвазивных форм в данных органах достигает 60%. Напротив, при УР мочевого пузыря лишь 15–20% опухолей прорастают в мышечный слой [4].
Приведенные факты обусловливают прогноз и выбор подхода к лечению. К сожалению, даже после радикального удаления опухоли в большинстве случаев развивается рецидив заболевания с переходом в метастатическую форму. Зачастую на этапе первичного обследования у пациентов диагностируется запущенная стадия заболевания. Несмотря на успехи в лечении уротелиальной карциномы, клинические исходы при метастатическом заболевании остаются неудовлетворительными, пятилетняя выживаемость составляет около 6% [5].
Кроме того, УР чаще встречается у пожилых пациентов (70 лет и старше), многие из которых имеют ряд сопутствующих заболеваний, в результате чего значительная доля вновь выявленных пациентов не могут перенести стандартные режимы химиотерапии на основе препаратов платины из-за развития непереносимой цитотоксичности. Таким образом, около 50% пациентов по тем или иным причинам имеют противопоказания к назначению платиносодержащей химиотерапии [6].
Благодаря созданию ингибиторов иммунных контрольных точек, блокирующих звенья пути передачи иммунного сигнала, таких как рецептор программируемой смерти 1 (PD-1), появилась альтернатива стандартному химиотерапевтическому лечению и увеличились показатели общей выживаемости у пациентов с неоперабельным местнораспространенным и диссеминированным УР. Заметим, что УР характеризуется высокой мутационной нагрузкой [7], что подчеркивает выраженную иммуногенность опухоли. Кроме того, имеются данные, подтверждающие наличие высокой экспрессии PD-L1 при раке мочевого пузыря, которая напрямую коррелирует со стадией заболевания, степенью дифференцировки опухоли и глубиной инвазии [8].
На основании изложенного можно говорить о потенциальной эффективности ингибиторов иммунных контрольных точек при распространенном УР. К разрешенным в России анти-PD-1-моноклональным антителам (МКА), активно используемым при УР, относятся пембролизумаб и ниволумаб [9].
Механизм действия этих препаратов следующий. На мембране иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (programmed cell death protein 1). При взаимодействии рецептора Т-лимфоцита с главным комплексом гистосовместимости на опухолевой клетке происходит ее распознавание. Т-лимфоцит готов уничтожить ее, но белок PD-1 связывается с расположенным на поверхности опухолевой клетки лигандом PD-L1 и/или PD-L2. Иммунная клетка инактивируется – тормозится пролиферация, не происходит выделения цитокинов, отвечающих за уничтожение злокачественных клеток. Таким образом, опухоль избегает иммунного надзора со стороны организма и продолжает расти. Чем больше опухолевых клеток и клеток микроокружения опухоли экспрессируют PD-L1/L2, тем активнее опухоль ускользает от иммунного ответа. Анти-PD-1-МКА блокируют связывание PD-1 c его лигандами PD-L1 и PD-L2, тем самым препятствуя инактивации T-клеток, что позволяет цитотоксическим лимфоцитам преодолевать защиту опухолевых клеток и уничтожать их.
Сегодня исследуется ряд новых иммунотерапевтических агентов для лечения пациентов с диссеминированным УР в первой и второй линиях, немышечно-инвазивным раком мочевого пузыря, а также в качестве нео- и адъювантного лечения и конкурентной опции у кандидатов на проведение лучевой терапии при местнораспространенных опухолях [10].
Ниволумаб
Ниволумаб является человеческим IgG4-антителом, нацеленным на PD-1-рецептор. Эффективность ниволумаба при распространенном УР подтверждена результатами двух исследований, в которых пациенты изначально получали платиносодержащую химиотерапию. Речь идет об исследованиях CheckMate 032 [11] и CheckMate 275 [12], результаты которых были оценены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration), и в феврале 2017 г. ниволумаб был одобрен для лечения платинорезистентного метастатического УР.
В открытом исследовании фазы I/II CheckMate 032 [11] 78 больным проводили внутривенную инфузию ниволумаба в дозе 3 мг/кг каждые две недели. Первичной конечной точкой была выбрана частота объективных ответов (ЧОО). Медиана наблюдения в исследовании составила 15,2 месяца, ЧОО достигла 24,4%, а у 5–6% больных был достигнут полный ответ на фоне лечения. Кроме того, показатели ответов не были связаны с экспрессией PD-L1. Из нежелательных явлений (НЯ) отмечались изменения кожных покровов – 42%. В 10% случаев наблюдались НЯ со стороны желудочно-кишечного тракта. Зарегистрировано два летальных исхода по причине тромбоцитопении и пневмонита [13].
В исследовании фазы II CheckMate 275 оценивали эффективность лечения ниволумабом у 265 больных с местнораспространенным неоперабельным или метастатическим УР после химиотерапии платиносодержащими режимами. Как и в исследовании CheckMate 032, ЧОО рассматривалась в качестве первичной конечной точки. Объективный ответ был зарегистрирован у 19,6% пациентов при медиане наблюдения семь месяцев. Частота ответов не была связана с уровнем экспрессии PD-L1. Выделение подгрупп пациентов проводилось с помощью анализатора Dako, уровнем отсечения в 1 и 5%. Медиана общей выживаемости (ОВ) составила 8,7 месяца, а ОВ при уровне PD-L1 ниже 1% и выше 5% достигла 6,0 и 11,3 месяца соответственно. Основными НЯ на фоне лечения были диарея и усталость. Токсичность 3–4-й степени отмечалась у 17,8% пациентов [13].
Пембролизумаб
Пембролизумаб относится к гуманизированным антителам, нацеленным на PD-1-рецепторы T-лимфоцитов, взаимодействие с которыми приводит к блокированию взаимодействия рецепторов PD-1 с лигандами PD-L1 и PD-L2 на поверхности опухолевых клеток и клеток микроокружения опухоли.
В рандомизированном исследовании фазы III KEYNOTE-045 [11] сравнивали эффективность пембролизумаба 200 мг каждые три недели и химиотерапии по выбору исследователя (паклитаксел, доцетаксел или винфлунин) у пациентов с ранее леченным метастатическим УР. В качестве первичных конечных точек были выбраны выживаемость без прогрессирования (ВБП) и ОВ. Согласно полученным данным, ОВ была достоверно выше в группе иммунотерапии – 10,3 месяца. В группе химиотерапии этот показатель составил 7,4 месяца. Медиана ВБП была сопоставима в указанных группах, но трехлетняя ВБП составила около 10% в группе пембролизумаба и 2% – в группе химиотерапии [14]. ЧОО была практически в два раза выше в группе иммунотерапии (21 против 11%), а у 7–19% (в зависимости от уровня экспрессии PD–L1) пациентов отмечался полный ответ. Кроме того, в группе пембролизумаба продолжительность ответа не менее 12 месяцев была значительно выше, чем в группе химиотерапии (68 против 35%). Иммунотерапия переносилась лучше, чем химиотерапия. Частота НЯ любой степени была ниже в группе пембролизумаба (69,1 против 90%). Количество случаев прекращения лечения из-за НЯ также было меньше в группе иммунотерапии (5,6 против 11%) [15]. Профиль НЯ пембролизумаба соответствовал таковому в исследованиях с участием пациентов с другими злокачественными новообразованиями. Таким образом, в исследовании KEYNOTE-045 продемонстрировано преимущество МКА в лечении распространенного УР, подтверждено увеличение медианы ОВ почти на три месяца по сравнению с химиотерапией при лучшей переносимости [14].
Последующее исследование фазы II KEYNOTE-052 проводилось у больных распространенным УР, у которых лечение цисплатином не представлялось возможным. Эффективность оценивали в зависимости от уровня экспрессии PD-L1: в ITT-популяции, у пациентов с уровнем экспрессии PD-L1 по показателю CPS (комбинированный показатель) < 10 и у пациентов с экспрессией PD-L1 (CPS ≥ 10). В данном исследовании участвовали 370 пациентов. В общей популяции пациентов ЧОО составила 29%, у 7% был достигнут полный, а у 22% – частичный ответ. В группе пациентов с CPS ≥ 10 ЧОО достигла 47%, а полный ответ зарегистрирован у каждого пятого больного. Достигнутые ответы в течение не менее двух лет сохранялись в 57% случаев при CPS ≥ 10 и в 45% – при CPS < 10. При этом медиана длительности ответа у пациентов с CPS ≥ 10 так и не была достигнута. Двухлетняя ОВ составила 47% у пациентов с CPS ≥ 10 и 24% – у пациентов с CPS < 10 [16].
Таким образом, на сегодняшний день показанием для назначения пембролизумаба в первой линии терапии при распространенном УР является прежде всего невозможность проведения первой линии химиотерапии с включением цисплатина. При этом обязательно PD-L1-тестирование опухолевой ткани с помощью тест-систем при иммуногистохимическом исследовании. Для назначения пембролизумаба положительной считается экспрессия PD-L1 ≥ 10 (по показателю CPS) [15, 17]. Еще одно показание к назначению анти-PD-1-МКА (пембролизумаба и ниволумаба) – прогрессирование заболевания после первой линии платиносодержащей химиотерапии независимо от уровня экспрессии PD‑L1 [12, 18, 19]. Однако необходимо отметить, что в настоящее время среди всех ингибиторов PD‑1/PD‑L1 только пембролизумаб продемонстрировал увеличение показателей ОВ в исследовании III фазы [14].
Клинический случай
Пациент П., 1952 г.р., впервые обратился за медицинской помощью в 2014 г. по поводу гематурии. Обследован в районной больнице, диагностирована папиллярная опухоль мочевого пузыря. В апреле 2014 г. выполнена трансуретральная резекция (ТУР) в Красноярском краевом клиническом онкологическом диспансере им. А.И. Крыжановского (КККОД). На основании результатов гистологического заключения верифицирована уротелиальная папиллярная карцинома, G2, с инвазией в подслизистый слой; инвазии в мышечный слой не определялось. Пациенту установлен диагноз: рак мочевого пузыря, T1N0M0G2, транзиторная макрогематурия. В послеоперационном периоде проведена внутрипузырная химиотерапия (ВПХТ) митомицином С, шесть введений. Больной находился на динамическом наблюдении: посещал контрольные осмотры онкоуролога через 3, 6, 12, 15 месяцев, признаков рецидива и прогрессирования не выявлено. На дальнейшие контрольные осмотры не являлся.
В марте 2016 г. по направлению терапевта лечебно-профилактического учреждения по месту жительства обратился в диспансер с жалобами на транзиторную гематурию, дизурию. В ходе обследования диагностировано множественное поражение мочевого пузыря: четыре образования от 0,8 до 3,0 см.
В апреле 2016 г. в КККОД выполнена ТУР мочевого пузыря, по результатам гистологического заключения – переходно-клеточный рак высокой степени клеточной анаплазии с инвазией в подслизистый слой, инвазия в мышечный слой не определена, множественные участки дисплазии от умеренной степени до CIS. Больному установлен диагноз: рак мочевого пузыря, T1N0M0, комбинированное лечение в 2014 г., рецидив. В послеоперационном периоде рекомендована ВПХТ, выполнено два еженедельных введения митомицина С в мочевой пузырь в дозе 40 мг (от дальнейшего лечения пациент отказался из-за явлений выраженного цистита). Рекомендации по динамическому наблюдению не выполнял.
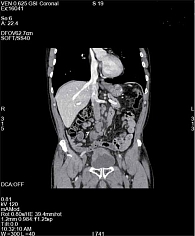
В ноябре 2018 г. мужчина обратился с жалобами на боль в нижних отделах живота. При дообследовании на компьютерной томограмме (КТ) определялась инфильтративная опухоль мочевого пузыря с множественным метастатическим поражением лимфоузлов таза и забрюшинного пространства до уровня почечных артерий (рис. 1).
Пациенту выполнена холодовая биопсия опухоли, гистологическое заключение – переходно-клеточный рак, G3. Установлен диагноз: рак мочевого пузыря, T1N0M0, комбинированное лечение в 2014 г., рецидив, ТУР + два курса ВПХТ в 2016 г., прогрессирование, множественное метастатическое поражение лимфоузлов забрюшинного пространства.
Для определения дальнейшей тактики ведения проведена оценка уровня экспрессии PD-L1: CPS – 49% (Ventana, SP-263). В феврале 2019 г. начата иммунотерапия пембролизумабом 200 мг один раз в три недели. Лечение переносил удовлетворительно. Из НЯ отмечались тошнота, сыпь, утомляемость 1-й степени. КТ брюшной полости и малого таза после шести введений пембролизумаба у пациента показала частичный ответ (уменьшение размеров таргетных очагов на 40%) по критериям RECIST 1.1.
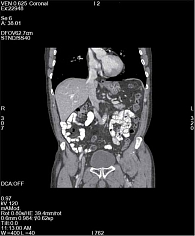
До марта 2020 г. пациент получил 17 введений пембролизумаба 200 мг один раз в три недели. Из НЯ сохранялась утомляемость 2-й степени. В марте 2020 г. проведена очередная КТ брюшной полости и малого таза: опухоль в мочевом пузыре не определена, тазовые лимфоузлы уменьшились до 8 мм, забрюшинные – до 10 мм по короткой оси (рис. 2). Всего пациент получил 19 введений пембролизумаба, от дальнейшего лечения отказался.
Таким образом, период наблюдения за пациентом с момента установления диагноза составил 75 месяцев. В качестве системной терапии по поводу прогрессирования заболевания выполнено 19 введений пембролизумаба. Последнее обследование больного проведено в июне 2020 г., признаков рецидива и прогрессирования нет. В ходе лечения пембролизумабом у пациента достигнут полный ответ по RECIST 1.1. Кроме того, отмечался приемлемый профиль токсичности, наиболее выраженное НЯ – утомляемость 2-й степени.
Заключение
Приведенный клинический случай наглядно демонстрирует эффективность ингибиторов иммунных контрольных точек у больных УР. Применение анти-PD-1-МКА при распространенном раке мочевого пузыря считается оправданным, поскольку увеличивает продолжительность жизни пациентов, улучшает ее качество и в ряде случаев приводит к полному или стойкому частичному ответу опухоли на лечение.
R.A. Zukov, PhD, Prof., D.V. Chernyaev
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
Treatment of urothelial cancer (UC) today is one of the most difficult tasks in oncology. Most tumors arise in the bladder and, despite the modern possibilities of surgical care, often recur and pass from a localized to a metastatic form. Until recently, the possibilities of anticancer drug therapy for UC were very limited. The basis of chemotherapy treatment is platinum-containing regimens that cause serious toxic reactions and have contraindications to the appointment. However, the emergence of inhibitors of immune checkpoints makes it possible not only to prolong the life of patients and improve its quality, but also, in some cases, to achieve a complete cure.
Registered anti-PD-1 drugs to date include pembrolizumab and nivolumab. International studies of these drugs have confirmed their high efficiency and low toxicity in the treatment of urothelial cancer. In this article, we present our own experience of treating a patient with advanced bladder cancer with pembrolizumab. As a result of treatment, a complete response was achieved with satisfactory tolerability of the drug.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.