Современный опыт применения комбинации Канглайта и Кселоды при метастатическом колоректальном раке
- Аннотация
- Статья
- Ссылки




Одним из новых лекарственных препаратов, внедряемых в клинику для лечения злокачественных новообразований, является Канглайт (КЛТ), разработанный профессором Ли Дапенгом, и с 1997 года широко используемый в онкологических клиниках Китая. Препарат зарегистрирован на российском рынке и разрешен к применению в клинической практике (регистрационное удостоверение П № 015334/01 от 05.12.03) в соответствии с законом РФ «О лекарственных средствах». Канглайт (эмульсия для инфузий) является современным типом противоопухолевых препаратов, приготовленным методом экстракции противоопухолевых компонентов из сырья семян китайского растения Semen Coicis по современной технологии и сформированным в липидную эмульсию для внутривенных и артериальных инъекций. Опыт клинического применения наглядно показывает, что КЛТ обладает существенной эффективностью при лечении различных видов опухолей, таких как карциномы легких, печени, желудка и молочной железы. В то же время, он стимулирует иммунный ответ и улучшает качество жизни: в комбинации с лучевой и химиотерапией, вспомогательной терапией КЛТ, демонстрирует значительное увеличение терапевтического эффекта и уменьшает его токсическое действие и вреда для организма.
Благодаря базовым исследованиям сегодня можно представить сложный механизм действия препарата на злокачественную опухоль:
- КЛТ блокирует митоз опухолевых клеток на границе G2 и М фаз клеточного цикла;
- КЛТ индуцирует апоптоз опухолевых клеток;
- КЛТ влияет на экспрессию генов опухолевых клеток, увеличивая экспрессию Fas/Apo-1 гена, являющегося промотором их роста;
- КЛТ ингибирует ангиогенез, существенно уменьшая образование новых кровеносных сосудов;
- КЛТ может преодолевать множественную лекарственную устойчивость опухолевых клеток, индекс преодоления устойчивости для некоторых видов химиотерапии может увеличиваться в 50 раз;
- КЛТ эффективно противодействует кахексии при раке.
Учитывая положительный опыт применения препарата при различных формах онкологических заболеваний, мы предприняли попытку изучения сочетания Канглайта и Кселоды у больных колоректальным раком.
Задачи исследования
Изучить эффективность и побочные реакции комбинации Канглайт + Кселода у больных с метастазами рака толстой и прямой кишки при I линии химиотерапии.
Проанализировать влияние комбинации Канглайт + Кселода на изменение показателей иммунной системы.
Критериями включения в исследование явились следующие клинические признаки:
- морфологически верифицированный диагноз аденокарциномы толстой или прямой кишки;
- метастазы в забрюшинные или периферические лимфоузлы, печень, легкие +/- наличие первичной опухоли;
- измеряемые + оцениваемые проявления болезни;
- больные, не получавшие химиотерапии в прошлом;
- больные, получавшие адъювантную химиотерапию после операции (срок от завершения лечения > 4 месяцев);
- общее состояние по ВОЗ 0-2;
- предполагаемая продолжительность жизни более 3 месяцев;
- возраст от 18 до 75 лет;
- допускается предварительная лучевая терапия, если облучаемая зона не является единственным измеряемым проявлением болезни;
- согласие больного на участие в исследовании.
Критериями исключения из исследования были:
- наличие метастазов в головной мозг (по клиническим признакам);
- серьезные сопутствующие заболевания, затрудняющие проведение лечения (язвенная болезнь желудка, двенадцатиперстной кишки и др.);
- беременность:
- признаки кишечной непроходимости;
- нейтрофилы ≤ 1500/мм3, тромбоциты ≤ 100 000/мм3, гемоглобин ≤ 9 г/дл;
- креатинин более > 1,25 х N*;
- билирубин более 1,25 х N*, АЛТ или АСТ 3 N и больше у пациентов, не имеющих метастазов в печень; при метастазах печени АЛТ и АСТ выше 5 N.
*N – верхний уровень нормы
Дозы и режим лечения
Дозы и режим лечения на схеме лечения.
Методика введения препаратов
- Кселоду назначали через 30 минут после еды после приема пищи.
- Канглайт вводили внутривенно без дополнительного разведения в фиксированной дозе 300 мл/день со скоростью 150 мл/час (2 часа).
Обследование больных
Для оценки лечебного эффекта всем больным проводились: УЗИ печени, забрюшинного пространства, пальпируемых лимфоузлов, при необходимости КТ, рентгенография легких, РЭА, иммунологическое исследование крови до начала лечения, перед III курсом и через 1 неделю после IV курса.
Во время лечения оценивалась степень выраженности побочных эффектов: контроль стоматита, диареи (ежедневно, дневник больного), общий анализ крови 1 раз в неделю, биохимический анализ крови – перед каждым курсом.
Всем пациентам проводился анализ иммунологических показателей до начала лечения и в процессе терапии, перед III курсом и после IV курса.
Проведен анализ 32 иммунологических тестов. Анализировались показатели: CD3, CD5, CD7, CD4, CD8, HLA-DR, CD38, CD25, CD50, CD16, CD11b, CD20, CD95, CD45RA, CD71, активность NK клеток; показатели гуморального иммунитета: иммуноглобулины G, A, M.
Оценка эффективности лечения проводится по критериям RECIST на каждом из этапов: в период лечения, непосредственно после его завершения (далее по тексту сказано, что больные проходили обследование после 2, 4, 6 и 8 курсов.).
Характеристика больных
В исследование включено 10 пациентов с метастатическим раком толстой кишки (рак толстой кишки – 6 больных, рак прямой кишки – 4 больных). Средний возраст составляет 60,5 лет (от 44 лет до 83 лет).
Все больные имели морфологически подтвержденный диагноз. Они прежде не получали лечения химиотерапией по поводу метастатического колоректального рака. Один больной имел 2 метастаза в печень размером до 3 см, один больной имел 1 метастаз в легкие до 3 см и имел противопоказания к операции. Восемь больных имели множественные метастазы: Двое больных множественные (больше 5) имели метастазы в печень размером от 5 до 10 см. У одного больного были множественные (больше 5) метастазы в печень размером более 10 см, один больной имел множественные метастазы (больше 5), размером до 5 см, один больной имел множественные метастазы от 5 до 10 см, асцит и метастазы в забрюшинные лимфоузлы.
У одного больного были мелкие множественные метастазы в печень и 2 метастаза до 5 см. Один больной имел множественные метастазы по брюшине более 5 см. Один больной имел множественные метастазы в легких размером до 3 (таблица 1).
Таким образом, 8 из 10 леченных больных имели множественные метастазы.
Пять из 10 больных имели размеры метастазов от 2 до 5 см, 4 – от 5 до 10 см, 1 больной – более 10 см.
У шести больных метастазы были выявлены одновременно с паллиативной операцией. У одного больного метастазы в легких были диагностированы через 2 месяца после операции. У одного больного от момента операции до диагностики метастатической болезни прошло 11 месяцев. У одного больного метастаз в легком был выявлен через 2 года 11 месяцев от постановки основного диагноза. У одного больного от операции и диагностирования метастазов до лечения прошло 2 года (ранее больной лечения не получал).
Средний уровень РЭА был до начала лечения 323,22 нг/мл. Один больной имел нормальный уровень РЭА, 2 больных имели уровень РЭА до 50 нг/мл, 1 больной – от 50 до 100 нг/мл, 3 больных имели уровень РЭА больше 100 нг/мл и 3 больных – уровень РЭА выше 500 нг/мл (таблица 2).
Таким образом, проявления метастатического рака толстой кишки до лечения были значительные.
Характеристика режима лечения (побочные эффекты)
При анализе побочных эффектов не выявлено какой-либо значимой токсичности, связанной с введением Канглайта. При попадании под кожу эмульсии Канглайта (в 1 случае) развития некроза не отмечено.
Ни у одного из 10 пациентов не было зарегистрировано гематологической токсичности во время лечения комбинацией Канглайт + Кселода. Гастроинтестинальная токсичность у больных, получавших Канглайт с Кселодой, также не зарегистрирована.
Не было отмечено ни одного случая развития аллергических реакций.
В одном случае отмечалось появление стенокардии II степени у больного 61 года с кардиосклерозом, прекращающейся при приеме Кселода, впоследствии контролируемой нитросорбидом. Развитие стенокардии в этом случае вероятнее всего связано с применением Кселоды, а не с Канглайтом.
У пяти больных отмечалось развитие ладонно-подошвенного синдрома I-II ст. – 40%, III ст. – 20% (после 3-5 курсов), что связано с применением Кселоды.
Особый интерес вызывают случаи повышения веса во время лечения, что, несомненно, может быть объяснено только применением Канглайта.
У трех больных, имевших значительное снижение веса тела до лечения, через 6 недель лечения Канглайтом и Кселодой было зафиксировано увеличение веса на 6 и 7 кг. Еще 2 больных отмечали значительное улучшение качества жизни (уменьшение слабости и др.) уже после первого курса лечения.
Результаты лечения
Проведено 40 курсов лечения Канглайтом и Кселодой; от 2 до 8 курсов. Все пациенты имели обследование после 2, 4, 6 курсов. Эффективность лечения составляет:
- частичная регрессия опухоли + длительная стабилизация (≥ 6 мес.) достигнута в 40% случаев (4 пациента);
- 2 пациента к настоящему времени получили 14 недель лечения Канглайтом, 2 больных – 10 недель лечения Канглайтом и продолжают лечение Кселодой в монотерапии.
Частичная регрессия и длительная стабилизация болезни (более 6 мес.) сопровождалась уменьшением уровня РЭА более чем в 6 раз в 1 случае, более чем в 3 раза – в 2 случаях, в 2 раза – в 1 случае.
Из 4 больных, у которых зафиксирована стабилизация, 2 получали Канглайт в течение 10 нед., 2 – в течение 14 нед. Все эти пациенты далее продолжили лечение Кселодой в монотерапии.
Время до прогрессирования: у 5 из 10 человек сохраняется лечебный эффект более 6 мес., лечение продолжено только Кселодой.
Восемь из 10 пациентов в настоящее время живы, 7 больных продолжают лечение (Кселода или другие режимы).
Динамика показателей иммунного статуса у больных раком толстой кишки при лечении препаратом канглайт в комбинации с кселодой
Состояние клеточного иммунитета оценивали по экспрессии поверхностных антигенов на лимфоцитах периферической крови методом проточной цитофлюориметрии с использованием моноклональных антител к антигенам CD3, CD5, CD7, CD4, CD8, CD20, CD16, HLA-DR, CD38, CD11b, CD25, CD71, CD95, CD50. Кровь для иммунологических анализов брали из локтевой вены утром натощак до лечения и после 2, 4 и 6 курсов. Для оценки цитотоксического действия NK-клеток применяли колориметрический метод с использованием МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиум бромид). В качестве клеток-мишеней использовали клетки эритромиелоидной лейкемической линии человека К-562, чувствительной к воздействию NK-клеток. Продукцию сывороточных иммуноглобулинов G, A, M определяли методом радиальной иммунодиффузии по Манчини.
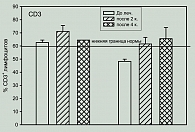
В результате проведенных исследований по изучению влияния терапии Канглайтом на субпопуляционный состав лимфоцитов периферической крови показано, что процент СD3+ лимфоцитов до лечения у 4 больных был в пределах нормы (62,6±1,88), у 3 – ниже нормы (48,3±1,82). В процессе лечения у 3 больных, имевших нормальные значения показателя, процент CD3 клеток по-прежнему оставался в пределах нормы, однако у одной больной процентное содержание этих клеток сильно снижалось (60,7% – до лечения, 49,3% – после двух курсов и 21,1% – после четырех курсов). Лечение этой больной было продолжено, и после VI курса процент CD3 клеток у нее возрос до 54,4%. Следует отметить, что только у этой больной процент лимфоцитов, экспрессирующих общий лейкоцитарный антиген CD5, в процессе лечения снижался и при тестировании после 2 и 4 курсов был ниже нормы (70,3% и 68,0% при норме 85-100%), что является неблагоприятным признаком. Однако после VI курса лечения он приходил к норме. У больных с исходно сниженными значениями процента CD3+ в процессе лечения отмечалось повышение доли этих клеток; хотя у одного больного, показатель не достиг нормального уровня и у одного больного после IV курса несколько превысил норму (рисунок 1).
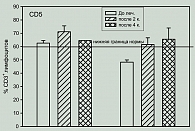
Одновременно в процессе лечения происходила нормализация и процентного содержания лимфоцитов, экспрессирующих маркер CD5, как у больных с повышенным, так и у больных с пониженным содержанием этих клеток. Проводимая терапия не влияла на долю этих клеток у больных с нормальными показателями. CD5+ лимфоциты были снижены до лечения у двух больных. После II курса отмечено повышение этого маркера с 54,1% до 60,3% антиген-положительных клеток, после IV курса – до 63%. В процессе лечения у 3 больных с нормальными показателями число CD5+ клеток оставалось в пределах нормы, а у 2 больных с повышенными показателями они нормализовались (рисунок 2).
CD7+ клетки были снижены до лечения у одного больного. После второго курса этот показатель возрос с 58,9% до 73,3%. У пяти больных с исходно нормальным относительным содержанием CD7+ лимфоцитов число этих клеток практически не менялось в процессе терапии. До лечения оно составляло 71,3±3,6%, после II курса – 80,2±5,4%, после IV курса – 63,9±2,1%. После шестого курса у 2 больных отмечено снижение этого маркера до 54,9±2,7%. У одного больного с исходно повышенным показателем процент этих клеток после второго курса оставался на том же уровне – 83,9% и 82,2% соответственно.
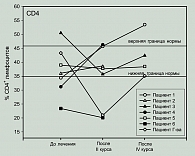
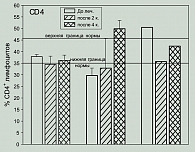
В процессе лечения у большей части больных наблюдалась также тенденция к нормализации процентf СD4+ лимфоцитов как при исходно пониженном показателе, так и при исходно превышающем норму. Процент CD4+ клеток до лечения у 3 больных был в пределах нормы, у 3 был ниже нормы, у одного – выше нормы. У двух больных с исходно нормальными значениями показателя процент этих клеток практически не менялся. В то же время у одной больной, имевшей значительное снижение, процент CD3+лимфоцитов, как указано выше, доля CD4+ клеток после второго курса также значительно снижалась (до 20,5% при норме 35-46%), однако после третьего курса процент этих клеток возвращался к нормальному значению. У двух больных, имевших до лечения сниженный процент CD4+ клеток, доля этих клеток после второго курса лечения повышалась практически до нормальных значений, у одного больного не менялась. У пациента с исходно повышенным показателем процент этих клеток приходил к норме (рисунки 3 и 4).
До лечения у больных отмечались значительные различия в процентном содержании CD8+ лимфоцитов (процент СD8+ клеток колебался от 7,1 до 49,7%). Нормальные значения показателя отмечались лишь у двух из семи больных. Следует отметить, что в процессе лечения у больных с повышенным процентом этих клеток показатель снижался, а у больных с пониженным – повышался. В то же время у одной больной процентное содержание CD8+ лимфоцитов оставалось на одном уровне и было на все сроки тестирования ниже нормы.
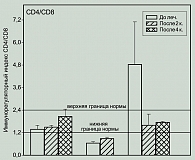
Нормализация процентного содержания основных популяций Т клеточного звена: CD4+ и CD8+ лимфоцитов сопровождалась и положительной динамикой одного из важных показателей состояния иммунологической реактивности организма – величины иммунорегуляторного индекса CD4/CD8. У больных с повышенными значениями он снижался до нормы, а у больных с пониженными – повышался, хотя и не достигал при тестировании в указанные сроки нормальных значений. До лечения у двух больных зарегистрировано снижение соотношения CD4/CD8 клеток до 0,64, у двух больных отмечено повышение до 4,8. После второго курса иммунорегуляторный индекс составил 0,88 и 1,59 соответственно (рисунок 5).
Процентное количество CD20+ В клеток до лечения у пяти больных было в пределах нормы. У двух больных процент СD20+ колебался в процессе лечения, и после второго курса был ниже нормы, а затем вновь происходила его нормализация. У одной больной показатель исходно был незначительно ниже нормы и в процессе лечения приходил к норме. У одной больной процент CD20+ лимфоцитов до лечения был сильно повышен (21,3% при норме 5-15%), однако уже после двух курсов количество этих клеток приходило к норме.
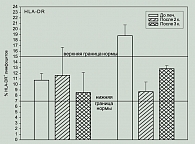
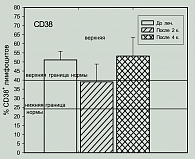
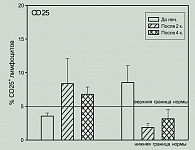
Изучение влияния проводимого лечения на процентное содержание лимфоцитов, экспрессирующих активационные антигены HLA-DR, CD38 и CD25, показало, что процент лимфоцитов, экспрессирующих эти антигены до лечения, был или в пределах нормы, или превышал ее: процент HLA-DR: 4/7 – N, 3/7 > N.
В процессе лечения отмечались колебания этих показателей как в сторону снижения, так и в сторону повышения значений (рисунки 6, 7, 8).
До лечения количество CD45RA+ лимфоцитов было снижено у одного больного, у трех больных этот показатель находился в пределах нормы и у трех больных был выше нормы. После проведения двух курсов терапии КЛТ отмечено повышение количества CD45RA+ клеток у больного со сниженным показателем с 39,1% до 57,7%; с нормальными – оставалось на том же уровне, с повышенными показателями приходило в норму с 71,7% до 57,3%. Эта тенденция сохранялась и после четырех курсов терапии.
Отмечено повышение в процессе лечения процента клеток, экспрессирующих антиген CD16 (NK- клетки), у больного с исходно нормальным показателем (до лечения – 19,8%, после второго курса – 24,4% и после четвертого курса – 29,0%) и резкое повышение у пациентки с исходно низким значением (до лечения – 6,1%, после второго курса – 43,5% и после четвертого курса – 37,4%). Возможно, это явилось компенсаторной реакцией, так как у этой пациентки параллельно отмечалось значительное снижение процента CD4+ лимфоцитов (рисунок 9).
Повышение экспрессии антигена CD95 (Fas/Apo-1) антигена отмечено у трех больных, но в то же время у четырех больных зафиксировано снижение числа CD95+ клеток в процессе лечения.
Увеличение синтеза IgG, IgA, IgM было зарегистрировано соответственно у 85,7% больных, у 28,5% пациентов, у 42,8% больных. У одного больного отмечено снижение исходно низкой продукции IgG с 8,0 г/л до 7,4 г/л.
Выводы
- Комбинация Канглайт + Кселода у группы больных метастатическим колоректальным раком высокоэффективна. Частота объективного эффекта составила 40%. Кроме частичной регрессии и длительной стабилизации болезни (≥ 6 мес.) наблюдали снижение уровня РЭА в 2-6,5 раза.
- Не отмечено гематологической и гастроинтестинальной токсичности, несмотря на использование высокой дозы Кселоды (2 г/м²/день). Можно предположить, что Канглайт предупреждает развитие возможных побочных эффектов. Вместе с тем, Канглайт не предотвращает развитие ладонно-подошвенного синдрома при использовании Кселоды.
- Канглайт нормализует и поддерживает иммунитет при проведении химиотерапии у больных с метастазами колоректального рака. Главным образом это касается Т-клеточного звена иммунитета, что сопровождалось и положительной динамикой одного из важных показателей состояния иммунологической реактивности организма – величины иммунорегуляторного индекса CD4/CD8. Также, несмотря на проведенную химиотерапию, содержание CD45RA+ клеток оставалось на прежнем уровне у больных с нормальными показателями.
- Канглайт улучшает качество жизни при комбинации с Кселодой: отмечено значительное увеличение веса тела (на 5-7 кг) больных, уменьшение астении и др.
- Применение Канглайта рекомендуется в комбинации с другими противоопухолевыми препаратами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.