Коррекция гепатоцеллюлярной недостаточности путем внутрипортального введения мононуклеарных клеток аутологичного костного мозга при циррозе печени: опыт ГБУЗ ГКБ им. С.П. Боткина ДЗМ
- Аннотация
- Статья
- Ссылки
- English

Введение
Цирроз печени (ЦП) – это диффузный процесс, характеризующийся фиброзом и трансформацией нормальной структуры печени с образованием узлов. ЦП представляет собой финальную стадию большинства хронических диффузных заболеваний печени [1]. По данным ВОЗ, смертность от заболеваний печени в мире в 2016 г. составила 40,3 человек на 100 тыс. населения. Летальность от ЦП различной этиологии и его осложнений в Москве в 2021 г. составила 1810 случаев – 48,6% от всех летальных исходов, связанных с заболеваниями органов пищеварения. Внутрибольничная смертность от ЦП превышает общегоспитальную в 7,2 раза. Таким образом, бремя летальности от осложнений ЦП диктует необходимость поиска новых способов лечения печеночной недостаточности.
Наиболее эффективным и зачастую единственным радикальным методом лечения больных с терминальной стадией хронических заболеваний печени служит трансплантация печени [2]. В связи с совершенствованием трансплантологической помощи показания к включению в лист ожидания расширяются, как следствие, возрастает неравенство между растущим числом пациентов, нуждающихся в лечении, и сохраняющимся «плато» числа трансплантатов, взятых от умерших доноров, что приводит к увеличению длительности ожидания [3, 4]. От 4,95 до 22,3% пациентов ежегодно выбывают из листа ожидания по причине смерти (UNOS, 2011 [4]). Летальность среди реципиентов, ожидающих пересадки печени, по данным С.В. Готье, достигает 57,4%. Длительность нахождения пациентов в листе ожидания часто превышает два года, а летальность на сегодня в ряде регионов превышает 40% [5].
Коррекция печеночной недостаточности является одной из сложнейших проблем у пациентов на стадии ЦП. В России для лечения ЦП наиболее часто назначаются гепатопротекторы, эффективность которых для коррекции гепатоцеллюлярной недостаточности спорна и требует проведения дальнейших исследований [6–8]. Применение этой группы препаратов как на стационарном, так и на амбулаторном этапах лечения пациентов с ЦП является предметом дискуссий [6].
В мире постоянно ведется поиск новых способов восстановления синтетической функции печени. В настоящее время в клиническую практику внедрены молекулярные абсорбирующие рециркулирующие системы (MARS) и модули для сепарации и адсорбции фракционированной плазмы (FPSA), протезирующие белково-синтетическую функцию печени, однако применение этих методов ограничивается высокой стоимостью и кратковременным клиническим эффектом [9].
Перспективным методом коррекции гепатоцеллюлярной недостаточности представляется использование клеточной терапии, основанной на применении регенеративного потенциала стволовых клеток взрослого организма для лечения ряда тяжелых заболеваний, в том числе ЦП [10–14]. Установлено, что введение мезенхимальных и мононуклеарных стволовых клеток способно индуцировать дедифференцировку зрелых гепатоцитов в овальные клетки, экспрессирующие маркеры стволовых и родоначальных клеток печени и способные к созреванию в пролиферирующие гепатоциты [2, 15, 16]. По данным ресурса clinicaltrials.gov, к 2022 г. зарегистрировано 132 клинических исследования, направленных на исследование эффективности применения стволовых клеток при патологии печени. По результатам большинства исследований, клинические эффекты введения клеток оцениваются авторами как положительные, что позволяет считать применение клеток костного мозга безопасным и перспективным методом лечения печеночной недостаточности [12, 13, 17–24].
Клинический случай
Пациентка П., 38 лет, в сентябре 2021 г. госпитализирована с жалобами на иктеричность кожи и склер, увеличение размеров живота, слабость, сонливость. Два года назад при развитии первого эпизода декомпенсации цирроза зафиксировано наличие асцита, желтухи, печеночной энцефалопатии, что послужило основанием для экстренной госпитализации. Установлен диагноз острого алкогольного гепатита на фоне цирроза печени смешанного генеза (вирусный гепатит С, алкогольный). В стационаре проведена терапия преднизолоном в стартовой дозе 5 мг/кг в сутки с последующим снижением и отменой. С января 2020 г. пациентка полностью отказалась от употребления алкоголя (шкала AUDIT – 4 балла). В течение последующих 18 месяцев было трижды проведено стационарное лечение в связи с нарастанием желтухи и асцитического синдрома. В июне 2021 г. при очередной госпитализации проведено лигирование варикозного расширения вен пищевода (ВРВП) второй степени. В июле 2021 г. консультирована в центре лечения вирусных гепатитов Инфекционной клинической больницы № 1, выявлена репликация вируса гепатита С и проведена противовирусная терапия софосбувиром и даклатасвиром с последующим достижением вирусологического ответа. В связи с сохраняющейся гепатоцеллюлярной недостаточностью рекомендована консультация трансплантолога. После дообследования пациентка включена в лист ожидания на трансплантацию печени. В ноябре 2021 г. после получения согласия этического комитета РМАНПО на проведение клинического исследования внутрипортального введения мононуклеарных клеток аутологичного костного мозга пациентке предложено участие в протоколе исследования. После подписания информированного согласия и подтверждения наличия ультразвукового окна проведена пункция воротной вены. Предварительно оценены исходный статус больной: Child – Pugh – Turcotte – класс С, MELD-Na – 18 баллов, исходное качество жизни по опроснику SF-36: физическое и психическое здоровье – 38 и 42 балла соответственно. На стационарном этапе проведено лечение: альбумин 25% – 100 мл в/в ежедневно в течение семи суток, трансфузия свежезамороженной плазмы – три дозы, таблетки спиронолактон 300 мг/сут, таблетки фуросемид 40 мг утром ежедневно, таблетки метронидазол 500 мг для деконтаминации кишки с целью снижения степени печеночной энцефалопатии (на амбулаторном этапе пациентка в течение трех недель принимала таблетки рифаксимин 1200 мг/сут без значимого клинического эффекта). Первым этапом проведена стимуляция костного мозга путем введения гранулоцитарно-макрофагального колониестимулирующего фактора в дозе 900 мкг/сут в течение четырех суток, введение препарата не сопровождалось побочными эффектами. На четвертые сутки в общем анализе крови отмечалось повышение уровня лейкоцитов до 24,5 × 109л, методом проточной цитофлуориметрии выявлена достаточная концентрация CD34+, после чего в условиях отделения трансплантации костного мозга проведена установка туннельного катетера (в кубитальную вену), путем афереза с использованием сепаратора Spectra Optia проведена мобилизация мононуклеарных клеток (МНК) аутологичного костного мозга из периферической крови. Полученная культура клеток в условиях термоконтейнера была направлена в лабораторию, где выполнен качественный анализ МНК аутологичного костного мозга и популяции СD34+ с оценкой их жизнеспособности при проточной цитофлуориметрии, ресуспензирование МНК с последующей шоковой заморозкой.
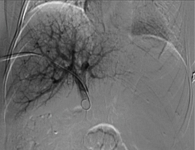
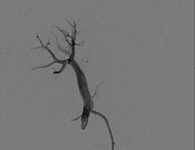
Через двое суток в операционной под местной анестезией после пункционной биопсии печени под УЗ-навигацией выполнена пункция воротной вены. В стволе воротной вены установлен катетер, выполнена портография 20 мл водорастворимого контрастного препарата, определена оптимальная скорость введения МНК – 1,0 мл/с (рис. 1, 2). После введения 87,5 мл суспензии МНК выполнена пломбировка канала гемостатической губкой.
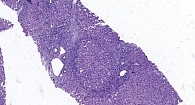
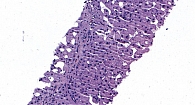
Вмешательство и последующий послеоперационный период пациентка перенесла удовлетворительно. Через 24 часа проведено контрольное ультразвуковое исследование – признаков кровотечения не выявлено. Выписана на вторые сутки в стабильном состоянии. При гистологическом исследовании ткани печени определяются выраженная диффузная лимфоцитарная инфильтрация, формирование ложных долек, признаки активного цирроза печени по METAVIR A2F4 (рис. 3).
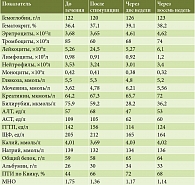
После выписки из стационара проведена консервативная терапия таблетками спиронолактон 100 мг/сут, Л-орнитин-Л-аспартат, лактулоза, β-адреноблокаторами с целью профилактики кровотечений из ВРВП. Удалось отказаться от приема петлевых диуретиков, прогрессирования отечно-асцитического синдрома в течение периода наблюдения не отмечено. При динамической оценке лабораторных показателей обращают на себя внимание стойкое повышение уровня альбумина, нормализация свертывающей функции печени, снижение холестатической активности (табл. 1).
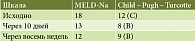
В последующем был проведен плановый осмотр через 14 дней и восемь недель с оценкой MELD-Na, CTP и качества жизни, повторной госпитализации не потребовалось. Отмечено снижение MELD-Na на 10 баллов в течение восьми недель, снижение класса Child – Pugh – Turcotte через 10 дней (табл. 2).
В течение восьми недель наблюдения отмечено улучшение качества жизни в связи с увеличением физической активности, уменьшением количества лекарственных препаратов и частоты госпитализаций (табл. 3).
Через 12 недель пациентка перенесла ортотопическую трансплантацию печени. В посттрансплантационном периоде осложнений не отмечено. При гистологическом исследовании ткани печени отмечается выраженная положительная динамика: снижение активности воспаления в виде уменьшения лимфоидной инфильтрации портальных трактов, дольковое и трабекулярное строение печени в исследованных препаратах сохранено (рис. 4).
Обсуждение
Развитие гепатоцеллюлярной недостаточности обусловлено преобладанием процессов некроза или апоптоза гепатоцитов в результате воспаления над их регенерацией. Регуляция процесса воспаления и последующей прогрессии фиброза в ткани печени осуществляется резидентными иммунокомпетентными клетками. Истощение пула резидентных клеток приводит к неконтролируемой прогрессии воспаления с формированием последовательных стадий фиброза и в итоге цирроза [10]. Таким образом, имеется патогенетическое обоснование гипотезы, что культура аутологичных полипотентных стволовых клеток может брать на себя функцию фагоцитоза и регуляции, сдвигая баланс профиброгенных факторов в сторону прекращения воспаления и стимуляции регенерации гепатоцитов [12–14, 20]. Еще одним основанием ожидаемого клинического эффекта при введении клеток являются данные проведенных ранее исследований с использованием иммуногистохимического метода у пациентов с вирусными поражениями печени до и после окончания противовирусной терапии, указывающие на потенциальную обратимость стадии цирроза [18]. При наличии выраженной портальной гипертензии, ассоциированной с риском развития геморрагических осложнений, трансплантация печени по-прежнему остается золотым стандартом лечения, и внутрипортальное введение мононуклеарных клеток аутологичного костного мозга является в настоящий момент эффективным методом для снижения летальности в листе ожидания и улучшения качества жизни пациентов с циррозом печени.
Отдельного обсуждения заслуживает совершенствование протокола получения культуры клеток: проведение трепанбиопсии для получения достаточного количества МНК сопряжено как с болевыми ощущениями, так и с высоким риском ассоциированных осложнений у пациентов с признаками коагулопатии и белково-синтетической недостаточности, в то время как сепарация клеток из периферической крови не сопровождается дополнительными рисками, в связи с чем представляется наиболее обоснованным методом. При выборе пути введения клеток, по результатам обзора литературы, вариант внутрипортального введения клеток с предварительной портофлоуметрией позволяет минимизировать потери суспензии МНК.
Ключевым фактором, позволившим оптимизировать методику внутрипортального введения МНК, явилась многопрофильность стационара, позволившая реализовать все этапы клеточной терапии в одном учреждении.
Заключение
Клиническое наблюдение демонстрирует безопасность и эффективность представленного способа коррекции гепатоцеллюлярной недостаточности. Персонализированный подход на всех этапах – от стимуляции гранулоцитопоэза до внутрипортального введения МНК – позволил достигнуть значимого снижения MELD-Na, улучшения качества жизни, снижения объема лекарственной терапии в процессе нахождения в листе ожидания трансплантации печени. По данным морфологического исследования, подтверждено снижение активности воспаления и ремоделирование ткани в сторону регресса фиброза печени. По мере включения пациентов в проводимое научное исследование будут изучены эффективность и безопасность предложенного метода терапии данной группы больных. По результатам работы планируется сформулировать практические рекомендации по применению метода в клинической практике.
Авторы заявляют об отсутствии конфликта интересов.
Исследование проводилось без спонсорской поддержки.
А.V. Shabunin, Academician of RAS, PhD, Prof., V.V. Bedin, PhD, Ch.S. Pavlov, PhD, Prof., О.N. Levina, PhD, P.А. Drozdov, PhD, Yu.A. Oleynik, G.M. Chechenin, PhD, V.А. Tsurkan
S.P. Botkin City Clinical Hospital, Moscow
Russian Medical Academy of Continuous Professional Education, Moscow
Sechenov University, Moscow
Contact person: Oksana N. Levina, levinaoks@mail.ru
Hepatic failure is one of the most common manifestation of liver cirrhosis. Currently, there are no medication or invasive procedure, which can reliably improve liver function. Research on the use of autologous bone marrow mononuclear stem cells to correct the morphofunctional manifestations of acute and chronic liver failure is encouraging. This clinical case demonstrates the safety and clinical effectiveness of intraportal administration of autologous bone marrow mononuclear cells obtained by apheresis after stimulation with granulocyte-macrophage colony-stimulating factor.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.